BMJ子刊:GPR21的缺失改善了葡萄糖稳态,并通过不同的机制抑制了CCL2-CCR2轴
2021-11-23 MedSci原创 MedSci原创
慢性低度炎症是肥胖诱导的胰岛素抵抗发病机制的一部分,表现为免疫细胞浸润脂肪组织。
慢性低度炎症是肥胖诱导的胰岛素抵抗发病机制的一部分,表现为免疫细胞浸润脂肪组织。代谢和免疫细胞(包括脂肪细胞和巨噬细胞)的数量与各种促炎受体和信号通路的激活平行,在胰岛素抵抗和炎症之间建立了一种机械联系。
G蛋白偶联受体GPR21在免疫细胞浸润和肥胖诱导的胰岛素抵抗中发挥的潜在作用已经被很多研究提出,本研究通过GPR21选择性敲除小鼠模型结合2型糖尿病患者样本,阐述Gpr21的相关问题,并评估GPR21作为潜在治疗靶点的作用。

研究结果显示,Gpr21的高脂喂养研究−/− 小鼠的糖耐量有所改善,炎症基因表达也有轻微变化。Gpr21−/− 单核细胞和腹腔巨噬细胞对单核细胞趋化蛋白(MCP)-1的趋化反应选择性受损,尽管Ccr2的表达没有改变。进一步的基因型分析显示,趋化性损伤是由于单核细胞极化失调所致。患者样本显示2型糖尿病患者外周血单个核细胞中GPR21表达升高,这与HbA1c%和空腹血糖水平相关。
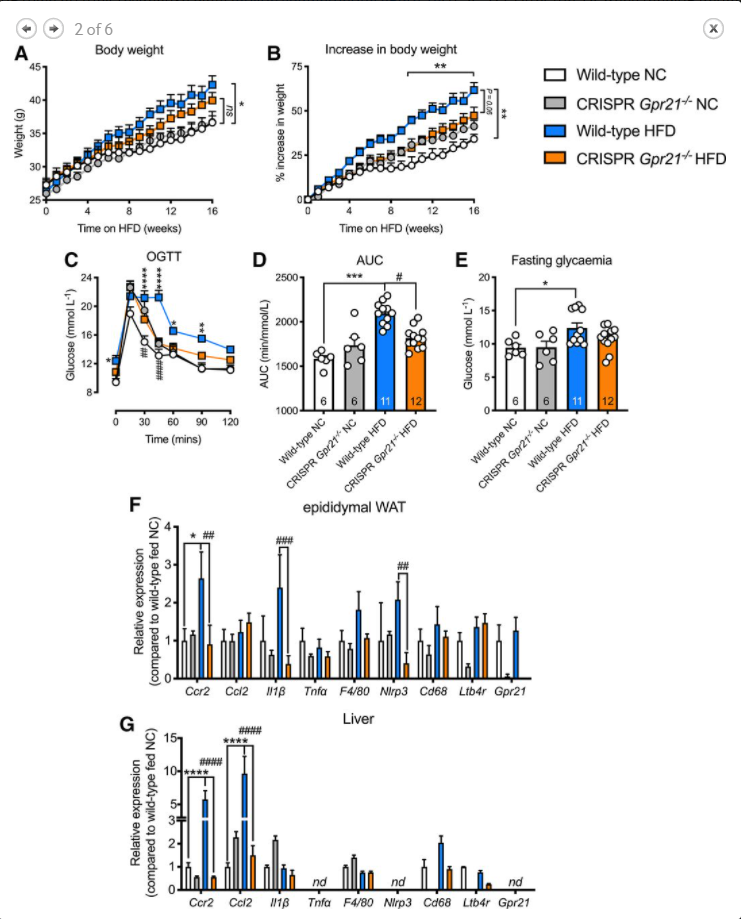
在16周的喂食期后,喂食高脂饮食(HFD)的野生型对照组显示出与喂食正常饮食(NC)的动物相比预期增加的体重(图2A,B,n=6-12)。Gpr21−/− 与对照组小鼠相比,服用HFD的动物体重增加较少,并且在整个实验期间,无论他们是服用HFD还是NC,体重增加量相同(图2B,n=6-12)。尽管HFD治疗6周后葡萄糖耐量无明显基因型差异,但12周后的OGTT显示Gpr21的葡萄糖处理能力有所改善−/− 与对照组相比,喂食HFD的动物(图2C,D,n=6-12)。然而,空腹血糖水平似乎不受Gpr21缺失的影响(图2E,n=6-12)。HFD促进野生型动物附睾WAT(eWAT)和肝脏中Ccr2、Ccl2、Il1和Nlrp3的表达,而Gpr21的表达部分较低−/− 小鼠(图2F,G,n=6-12)
总体而言,人类和小鼠数据表明GPR21影响葡萄糖稳态和MCP-1/CCL2-CCR2驱动的单核细胞迁移。然而,Gpr21−/− 小鼠骨髓移植和高脂喂养研究显示对葡萄糖稳态没有影响,这表明单核细胞驱动的炎症和葡萄糖稳态的相关机制没有(或有限)重叠。
参考文献:, et al. Deletion of GPR21 improves glucose homeostasis and inhibits the CCL2-CCR2 axis by divergent mechanisms.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CCR2#
80
#稳态#
84
#葡萄糖稳态#
103
#CCL2#
83
#BMJ#
77