Nature子刊重磅综述:急性淋巴细胞白血病(诊断和治疗部分)
2024-06-19 聊聊血液 聊聊血液 发表于上海
研究讨论了 ALL 的流行病学、机制、诊断和治疗,以及 ALL 的最新进展,强调了在改善患者结局和生活质量方面的创新方法。
急性淋巴细胞白血病 (ALL) 是一种以未成熟淋巴细胞不受控制的增殖为特征的血液系统恶性肿瘤。在过去的几十年里,人们在理解 ALL 的生物学方面取得了重大进展,使其诊断、治疗和监测得到了显著的改善。《Nature Reviews Disease Primers》近日发表长篇综述,讨论了 ALL 的流行病学、机制、诊断和治疗,以及 ALL 的最新进展,强调了在改善患者结局和生活质量方面的创新方法。文章较长,现分两部分翻译,水平有限,如有错误敬请谅解。

诊断、筛查和预防
临床表现
ALL 通常表现为突然发作,但部分病例可能在数月内逐渐进展。体征和症状通常与白血病负荷和骨髓受累程度相对应,以及(如果存在)对应髓外部位浸润(如淋巴结、肝脏、脾脏和脑膜)。其主要症状是血细胞减少的结果,包括继发于贫血的疲乏和无力、中性粒细胞减少性感染或副肿瘤性发热和出血倾向。前体 T-ALL/LBL 患者常表现为纵隔内肿块,有时伴胸水积聚,可引起呼吸困难和上腔静脉综合征相关症状。ALL 还可累及眼眶组织、睾丸、扁桃体和腺样体。B 细胞 LBL 可表现为头颈部皮肤损害或淋巴结肿大或离散性骨损害。全血细胞计数可显示贫血、血小板减少、中性粒细胞减少和白细胞减少或白细胞增多。高达18%的儿童患者存在高白细胞血症 (>100× 109/L),成人中高白细胞血症为10%-30%。KMT2A 重排、BCR::ABL1、TCF3::PBX1、T-ALL表型、纵隔肿块和中枢神经系统受累更常与高白细胞血症相关。需要骨髓环钻活检和穿刺,使用多参数流式细胞术明确诊断。免疫表型可通过区分10000个正常细胞中的一个白血病细胞(1×10-4),达到分配谱系、定义 ALL 亚组和监测 MRD 状态。MRD 评价的高精度方法包括通过逆转录定量PCR(RT–qPCR) 检测免疫球蛋白或 T 细胞受体 (TCR) 基因的白血病特异性重排,灵敏度可达到10-4和10-5(10000–100000个正常细胞中有1个白血病细胞),比新兴的、但未标准化的、基于NGS的方法低1-2个对数。
通过细胞形态学标准进行诊断
淋巴母细胞通常由小到中等大小的细胞组成,细胞核-细胞质的比例很高。染色质从中度浓缩到分散不等,核仁不明显,胞质有限嗜碱性、无颗粒(图4)。在谱系上几乎无法区分。
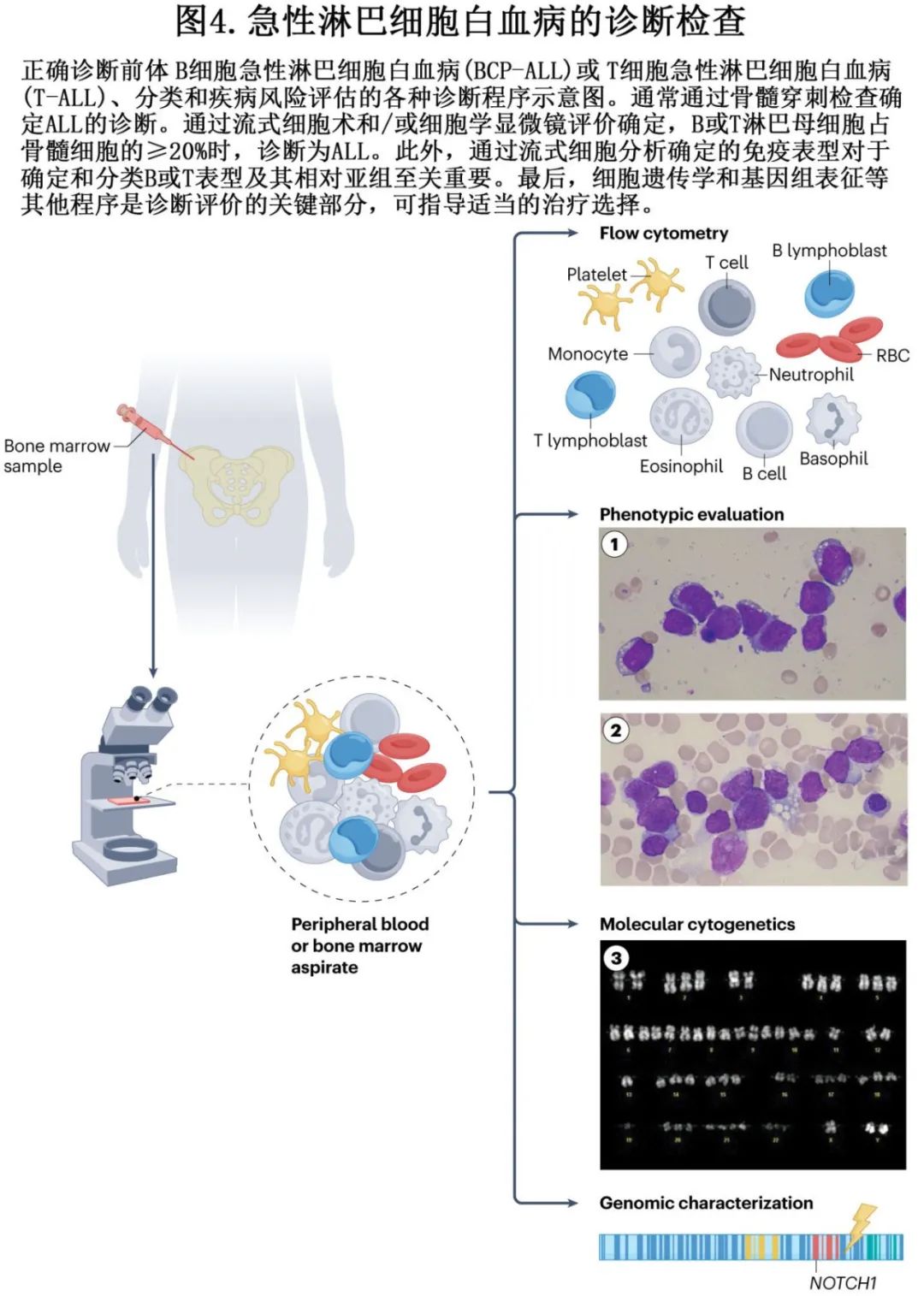
欧洲白血病免疫学特征组 (EGIL) 根据成熟标志物的免疫表型进行分类,BCP-ALL 中的分化簇 (CD) 标志物(CD19、CD20、CD22、CD24和CD79a)可区分变异亚型。pro-B-ALL的分类(EGIL B-I亚型)是基于至少存在以下早期 B 细胞分化标志物中两种以上:CD19、CD22(细胞膜或细胞质)和CD79a。CD10(也称为常见急性淋巴细胞白血病抗原或CALLA)可标记 ALL 亚型EGIL B-II,存在Igμ (mu;cγμ) 重链或表面或膜免疫球蛋白 (mIg) 轻链可识别前 B 亚型(EGIL B-III亚型)(表3)。还有基于免疫球蛋白表达的精炼表型,如具有不同结局的过渡性pre-B-ALL。尽管可鉴别成熟原始细胞表型(EGIL B-IV),例如在 Burkitt 淋巴瘤或 Burkitt 细胞白血病中(通过仅存在膜 IgM[mIgM]或存在轻链受限),但在 WHO-HAEM5 2022 中,它们不再归类为BCP-ALL/LBL,而是归类为成熟 B 细胞肿瘤。但有证据表明,B-IV亚组具有高度异质性,可能包括罕见的、表达末端脱氧核苷酸转移酶 (TdT) 的BCP-ALL,其通常为阴性,并携带IG::MYC易位,正如 Burkitt 淋巴瘤。Ph 阳性 ALL可表达 CD13 和 CD33 髓系或跨系抗原,以及 CD34 干细胞抗原。
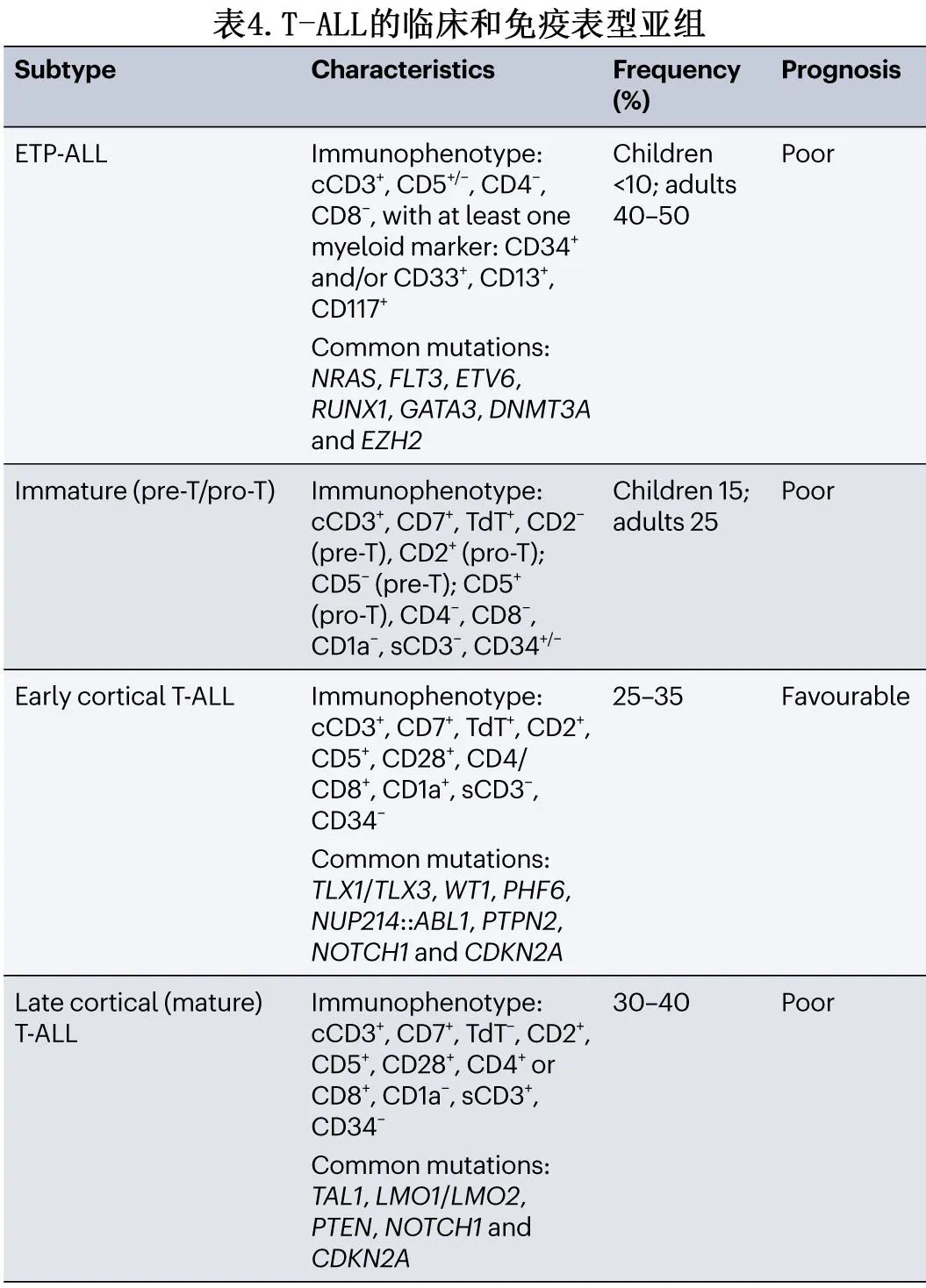
T-ALL 通常被细分为4个不同的表型、生物学和临床亚组,广泛反映了胸腺细胞发育停滞的不同阶段。通过以下抗原的表达可区分这些组:TdT、CD7、CD2、CD5、CD1a、CD3(细胞质或细胞膜)、CD4和CD8。这些亚组包括:ETP-ALL;早期皮质 T-ALL pro-T(T-I) 和pre-T(T-II);皮质 (T-III) 和晚期皮质或成熟T-ALL(T-IV)。ETP-ALL 占儿童病例的15%和成人病例的35%,其特征为缺乏CD8、CD4、CD1a、弱 CD5 表达和存在至少一种髓系或干细胞抗原(CD34、CD33、CD13、CD11b、CD65和/或HLA-DR)(表4)。ETP-ALL 具有未成熟 MPAL 的典型额外特征,但其特征为不同的复发性遗传事件。历史上,ETP-ALL与儿童和成人患者的不利结局和不良预后相关,但最近的研究提出,尽管 ETP-ALL 患者表现出早期化疗耐药,但通过在完全缓解期给予常规化疗或造血干细胞移植 (HSCT) 强化治疗,ETP-ALL患者可获得与非 ETP 队列相似的5年 EFS 和 OS。
传统的细胞遗传学和分子遗传学技术
传统的细胞遗传学、荧光原位杂交或分子方法,如RT-qPCR,是鉴定特异性染色体异常的标准诊断技术。整个基因组的拷贝数变化可能通过基于阵列的比较基因组杂交或 SNP 阵列分析来鉴定(图4)。那些用于计算精炼的预后指数和 IKZF1plus 状态的特定拷贝数异常,可通过多重连接依赖探针扩增可靠地检测。转录组测序已确定了 ALL 的新亚型,并正在迅速成为患者的诊断标准筛查工具。WGS、靶向 NGS 和光学基因组图谱的结合进一步完善了基因检测,特别是与新发亚型和亚型定义突变相关的基因检测。这些基于 DNA 的技术的优点在于可以在个体或小群体患者上进行。这些方法目前正在验证中,但它们在检测 ALL 预后相关的基因亚型方面显示出高度一致性,并将可能很快取代细胞遗传学和荧光原位杂交作为常规诊断检查。
通过二代测序技术进行诊断
ALL 的极端异质性导致使用常规技术识别所有基因改变具有挑战性,从而证明 NGS 在 ALL 诊断过程中的应用越来越多是合理的,包括转录组测序和WGS,尽管目前成本很高。转录组测序是一个综合平台,不仅可以识别基因融合(如BCR::ABL1、ETV6::RUNX1等),还可以识别其他基因改变,包括序列突变(如PAX5P80R、IKZF1N159Y等)、基因表达水平异常(如LYL1/LMO2、SPI1)和表型亚型(例如BCR::ABL1样,ETV6::RUNX1样,来自其基因表达标记)。WGS 有多个优点,例如能够识别(不一定导致嵌合转录本表达的)重排。WGS 可以检测所有的序列突变,特别是非编码区的序列突变、结构变异和拷贝数异常。从基于 DNA 和 RNA 的测序平台信息进行综合分析有助于全面了解和提高 ALL 的诊断。一个极好的例子为T-ALL 方面的里程碑式工作。通过整合1300多例一致性治疗的 T-ALL 儿童的基因组和转录组测序,再加上表观基因组和单细胞分析,该研究确定了15种不同的 T-ALL 亚型。这些亚型表现出独特的基因组驱动因子、基因表达谱、发育阶段和结局。值得注意的是,该分析还揭示出增强子失调的多种机制,揭示了非编码基因组在 T-ALL 发病机制中的显著参与,而这之前尚未得到充分探索。此外,该研究重新定义了高危ETP-ALL亚型,描述了ETP 样白血病的更广泛类别,并确定了许多基因改变和疾病亚型作为生存和治疗失败的独立预测因素。该研究为未来 T-ALL 的重新分类、危险分层和机制理解提供了有价值的见解。
可测量残留病
MRD 是成人和儿童 ALL 患者复发和生存的独立预测因素,其基于使用骨髓标本的敏感方法,在患者治疗过程中的各个时间点检测白血病细胞,包括多色流式细胞术 (MFC) 和 PCR 技术,检测融合转录本或白血病特异性免疫球蛋白和 TCR 基因重排(图4)。多国研究塑造了美国和欧洲使用 MFC 进行 MRD 评估的临床标准。尽管 MFC 可以在40-70%的 BCP-ALL 病例中检测到白血病相关MRD,但是否达到10-4的标准临界值取决于样本质量和操作者经验。先进的8-12色流式细胞仪可将 MRD 检测灵敏度提高至10-5。MRD PCR技术可检测和定量免疫球蛋白和 TCR 基因重排、染色体易位断裂点和融合基因转录本,可以在高达10万个正常细胞中鉴定出单个白血病细胞 (10-5)。较新的方法,如数字液滴 PCR 和基于 NGS 的深度测序可提供高达10-6的灵敏度,但在成本和标准化方面存在局限性,需要进一步解决。然而,与基于PCR的方法相比,NGS-MRD通过扩增更广泛的遗传标记而不需要患者特异性引物,从而为ALL提供高灵敏度。
MRD 已整合到 ALL 方案中,用于指导治疗决策、确定接受强化治疗或异基因 HSCT(allo-HSCT) 的高危患者以及首次完全缓解时可能不需要 allo-HSCT 的预后良好的患者。诱导结束时或 allo-HSCT 前 MRD 水平升高预示着复发风险升高,需要采取额外的干预措施降低 HSCT 前MRD 水平。
治疗
根据年龄、淋巴细胞生物学和复发风险进行调整的治疗手段
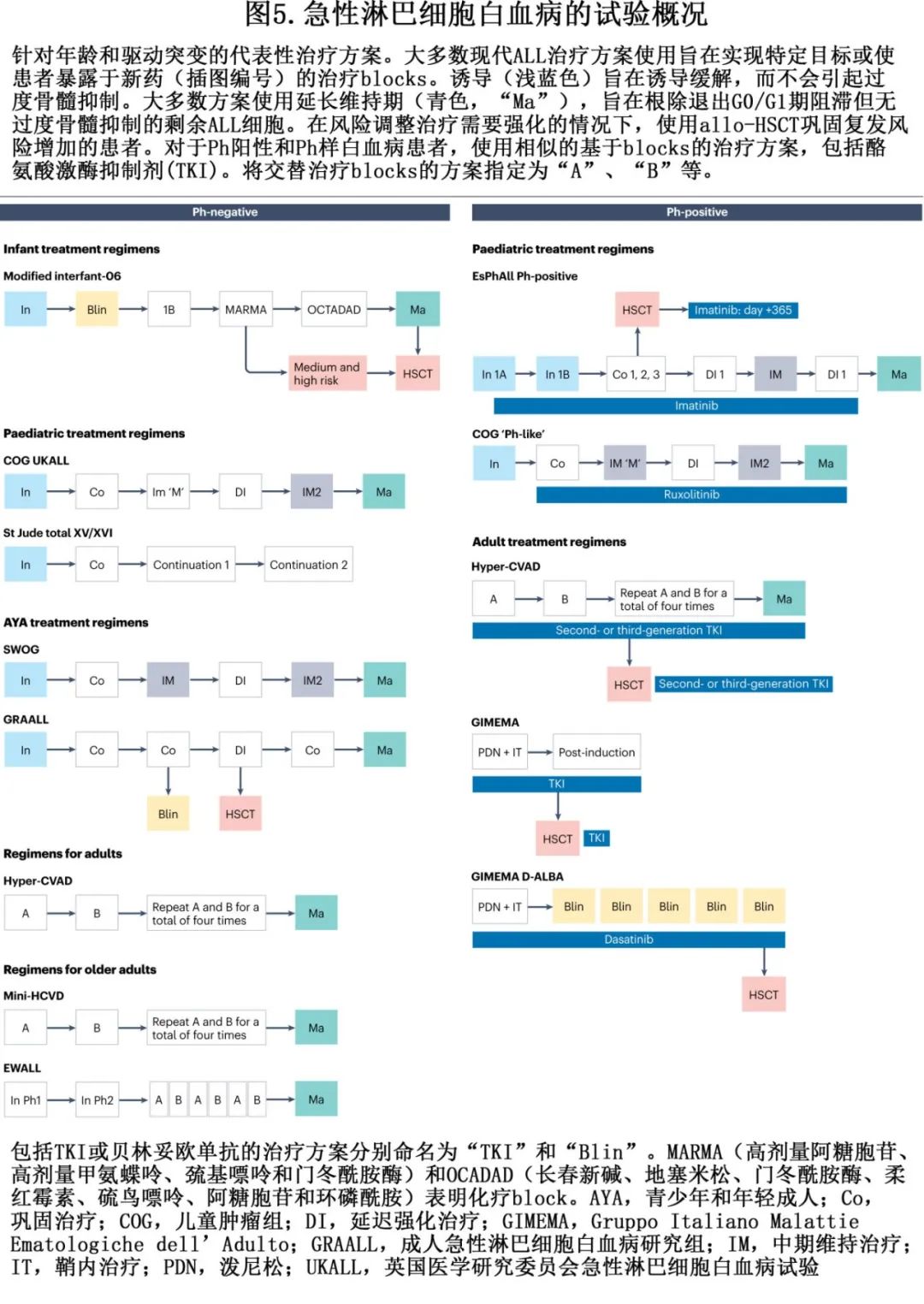
在过去五十年中,一些迭代进展显著促进了成功 ALL 治疗的进展,相关进展主要是通过采用风险和 MRD 驱动的治疗原则、改善支持治疗以及纳入小分子、免疫治疗和其他新型、靶向治疗进入传统多药化疗方案来实现的(表5和图5)。由于 ALL 可影响整个生命周期的患者,因此需要调整治疗方案,以提供适合年龄的强化治疗,减轻联合治疗的不良反应。婴儿中开发了治疗策略,以适应儿童肝肾功能不成熟的独特药代动力学和药效学。在该年龄组中,KMT2A重排白血病占优,需要尽可能强化靶向治疗,但与在年龄较大儿童(大于12个月)相比的EFS和 OS 率持续落后。与婴儿 ALL 不同,治疗降级策略已成功用于1-10岁的TCF3::PBX1、ETV6::RUNX1和高超二倍体白血病儿童,这些儿童需要较低强度的方案,5年 EFS 和/或 OS 率可达到85-90%。青少年和年轻成人(15-40岁)从强化治疗获得的获益与接受儿童(paediatrics-inspired)方案的成人相同,但年龄的增加(>40岁)导致毒性限制了强化策略的使用。使用 TKI 治疗显著改善BCR::ABL1阳性 ALL 的结局,导致 MRD 阴性完全缓解率升高和治疗相关死亡减少。免疫治疗在 Ph 阳性和 Ph 阴性 ALL 中也显示出希望,为该患者人群提供了新的治疗选择。此外,成人 T-ALL 的发生率略高,通常表现为 NCI 高危特征(诊断时的年龄和高 WBC 计数)且有持续的诱导后MRD的趋势。这些独特的年龄依赖性临床和分子特征对全球合作组织提出了挑战,需要设计安全、有效的治疗策略,以达到治愈每位患者的完美目标。
靶向治疗的兴起
21世纪早期标志着 ALL 治疗的一个重要过渡时期,当时研究者意识到进一步增加传统细胞毒性治疗的剂量不会改善结局,反而会带来额外的不良反应。在某些情况下,与蒽环类药物相关的心脏毒性、颅放射相关的认知障碍和神经内分泌失调以及移植相关疾病有关不良反应会对生存者的生活质量有长期影响。为了使 ALL 的治疗更容易、更安全和更有效,采取了广泛的步骤来开发靶向治疗,它们可整合到既定的治疗方案中,而不会失去疗效。这些将靶向治疗实施到治疗blocks的努力如图5所示,提高了许多 ALL 患者人群的生存率。
淋巴细胞生存通路的小分子抑制剂
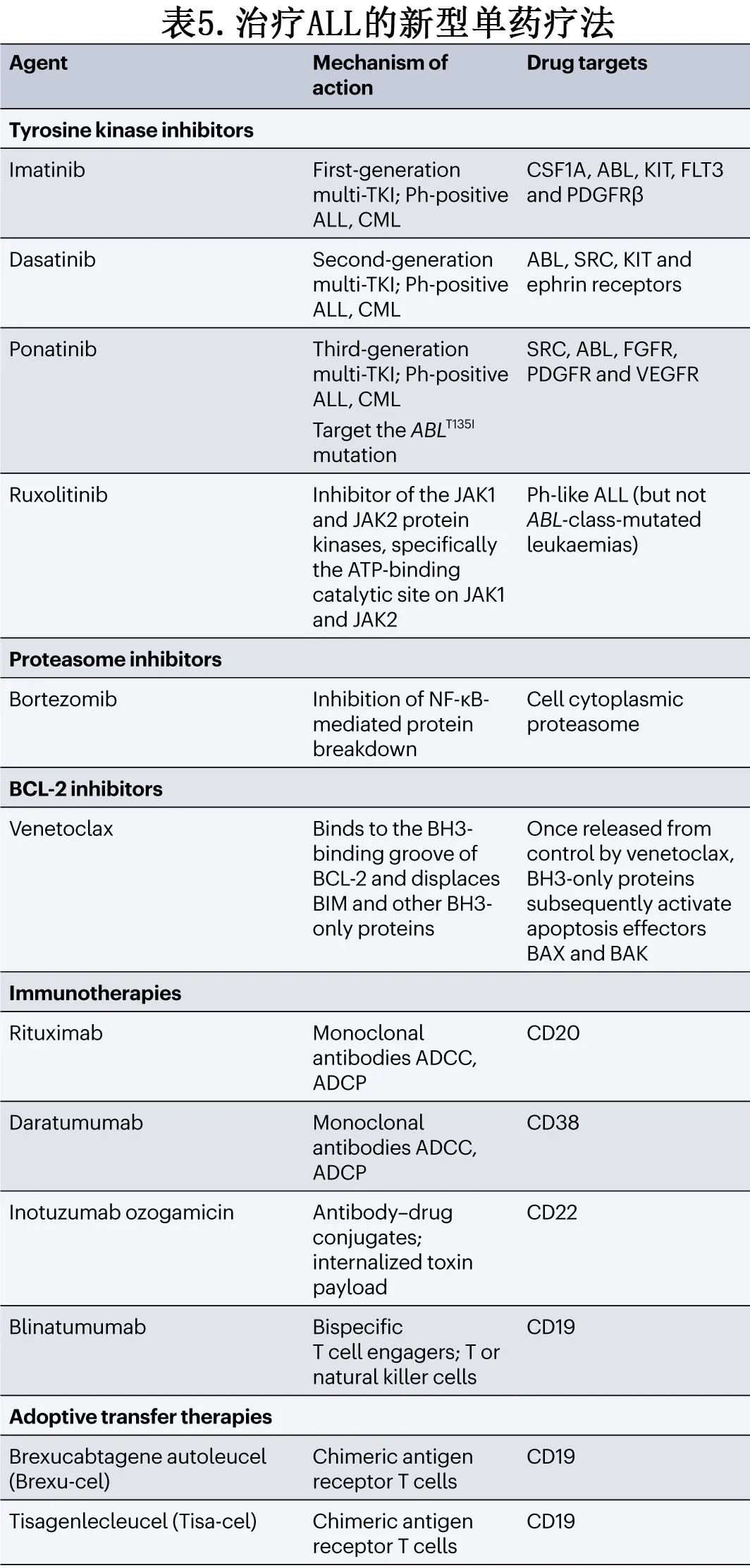
最初的主要成功之一是将TKI纳入ALL治疗,随后为小分子抑制剂,以及最近的免疫治疗和过继T细胞转移疗法,如表5所示。虽然Ph阳性ALL仅占儿童的3-5%,但成人BCP-ALL患者中高达30%。因此,大多数成人治疗策略包括尽快在治疗blocks中添加TKI以实现MRD阴性缓解。根据分子缓解水平和潜在异基因移植供者的可用性,Ph阳性ALL成人患者进行移植的策略现在受到新一代TKI联合免疫治疗的挑战。
2009年,使用基因表达谱筛选了在荷兰儿童肿瘤组 (DCOG) 和儿童急性淋巴细胞白血病合作研究组 (COALL)BCP-ALL 研究中接受治疗的儿童和年轻成人大型队列。患者亚组具有与 Ph 阳性 ALL 相同的基因失调特征(Ph样)但缺乏经典的BCR::ABL1融合。对该亚组的进一步分析确定了多种 ABL 类重排。CRLF2 重排和过表达的另一个子集也具有相同特征。这些发现导致开展了一系列临床试验,包括伊马替尼和芦可替尼在 ALL 化疗方案中的应用。
蛋白酶体抑制剂在重度经治多发性骨髓瘤患者中可诱导缓解,从而导致在其他造血恶性肿瘤中进一步研究,例如在治疗ALL方面具有令人惊讶的获益。基于此,硼替佐米被选为儿童肿瘤组(COG)针对患有T-ALL和T-LBL的儿童和年轻人的研究AALL1231的单一新药。它在T-LBL研究亚组中显示出疗效;另一方面,在COG改良的BFM方案中纳入nelarabine没有显著获益。
凋亡信号通路也是维奈克拉、其他 BCL-2 抑制剂或 TKI 靶向干预的重点。BCL-2 抑制剂通过与 BAX 和 BAD 的促凋亡作用解偶联发挥作用,导致线粒体外膜孔隙形成,导致细胞死亡。各种恶性肿瘤已显示对维奈克拉的反应,包括B-ALL、T-ALL和 KMT2A 重排白血病。维奈克拉和 BCL-2/BCL-XL navitoclax 抑制剂的组合在 R/R B-ALL 和 R/R T-ALL 中均显示出令人鼓舞的结果,为进一步开展的一线研究铺平了道路。
尽管针对特定ALL亚型的靶向治疗和新的靶向药物以更快的速度出现,这值得欣喜,但药物开发的归纳法(一个突变、一个基因、一个分子)似乎不足以在 R/R ALL中实现临床改善。例如,nelarabine是唯一获批用于 R/R T-ALL 的小分子药物,26例成人 R/R 患者的完全缓解率为23%。这一问题强调了在该临床环境中迫切需要开发新疗法。
克服这一局限性的一个方法在于,基于体外 ALL 细胞对小分子抑制剂的复发性反应模式和基于药物基因组学评分,开发多组学功能性平台,以优先考虑新的治疗方法,一次一例患者。该方法确定了多种临床策略,如在 LCK 和 pre-TCR 依赖性 T-ALL 中确定达沙替尼,在 R/R ETP-ALL 中确定维奈克拉和硼替佐米的组合或确定定义性 ALL 药理学类型。
利用效应细胞和内源性免疫系统的其他成员
与开发针对免疫系统效应细胞的药物有明显差异的是,已开发出需要NK细胞、巨噬细胞和其他效应细胞的抗白血病作用来诱导其抗白血病作用的新型药物。细胞介导的免疫防御机制,如抗体依赖性细胞毒性和抗体依赖性细胞吞噬作用,分别需要 NK 细胞或巨噬细胞-单核细胞系统的成员来识别抗体结合受体进行细胞破坏。利妥昔单抗是最著名的用于治疗 B 细胞血液恶性肿瘤的单克隆抗体 (mAb) 之一,因为它靶向CD20,CD20在 Burkitt 白血病和淋巴瘤中常见,也在大约三分之一的 BCP-ALL 中存在。使用成人急性淋巴细胞白血病研究小组 (GRAALL) 使用的儿童方案,利妥昔单抗可改善表达 CD20 的 BCP-ALL 患者的EFS,利妥昔单抗组的2年EFS为65%,而对照组为52%。尽管尚未获得批准,但利妥昔单抗或二代 CD20 靶向抗体已广泛用于 BCP-ALL 成人患者。
尽管 Burkitt 淋巴瘤及其罕见的白血病表型仅占所有淋巴肿瘤患者的1-2%,但将利妥昔单抗纳入抗增殖治疗方案一直是二十一世纪的成功案例之一。BURKIMAB、FAB LMB和其他协作组研究的结果一致表明,在儿童和 AYA 中,大多数新诊断患者的 EFS 和/或 OS 率均改善至>80%;然而,55岁以上的患者和接受含利妥昔单抗方案后复发的患者仍难以治愈。
达雷妥尤单抗是一种抗CD38 mAb,对 T-ALL 具有临床前和临床疗效。在目标靶标与靶向 mAb 连接后内化的情况下,毒素有效负荷可促进白血病细胞的根除,这一情况的最佳证据是使用奥加伊妥珠单抗和抗 CD22 刺孢霉素连接抗体-药物结合物 (ADC) 治疗BCP-ALL。奥加伊妥珠单抗可增加肝窦阻塞综合征风险,尤其是在接受移植的患者中,需要在移植前增加支持治疗并减少剂量。
贝林妥欧单抗是一种首创的 CD3/CD19 双特异性 T 细胞衔接系统 (BiTE),尽管在 R/R 中开展的初始 III 期 TOWER研究疗效一般,但仍显示出相当大的前景。基于 BLAST 研究的结果,已将该药物的批准扩展至所有疾病分期的持续性MRD。儿科 III 期研究(纳入30岁以下的AYA)显示,与标准化疗相比,贝林妥欧单抗对巩固二次完全缓解很有价值,具有良好的耐受性且增加异基因移植率。贝林妥欧单抗联合化疗治疗R/R KMT2A 重排 ALL 婴儿有效。最近的 ECOG-E1910 III 期研究取得了显著进展,证明贝林妥欧单抗作为巩固治疗在30-70岁 MRD 阴性 Ph 阴性 ALL 成人患者中的明显获益,该发现为其作为一线治疗的扩展使用打开了大门。在 Ph阳性 ALL 成人患者中,联合二代和三代 TKI治疗也取得进一步有前景的进展,促使人们考虑无化疗方案。在 D-ALBA II 期单组研究中,达沙替尼和贝林妥欧单抗序贯治疗获得令人印象深刻的18个月 OS 和无病生存率 (DFS),分别为95%和88%。48个月随访分析显示 OS 率为78%,DFS率为75%。诱导治疗后无分子学缓解的患者和 IKZF1plus 基因型患者(ΔIKZF1伴CDKN2A/B、PAX5或 PAR1 区域缺失;无 ERG 缺失)的 DFS 显著较差,分别为85%和47%。
以 CD19 为靶点的自体 CAR-T 细胞已出现。在 R/R 背景下,研究表明 CAR-T 细胞治疗可使缓解率达到70%-90%,几乎所有缓解者均达到 MRD 阴性。该策略存在显著但可控的不良事件,尤其是细胞因子释放综合征和免疫效应细胞相关神经毒性综合征。目前,两种 CAR-T 细胞疗法(tisagenlecleucel和brexucabtagene autoleucel)已获批用于儿童和成人 R/R BCP-ALL 患者。真实世界研究表明,这些 CAR-T 细胞的持续存在可能在维持缓解中起着至关重要的作用。常见的逃逸机制包括 CD19 抗原表达丧失,这可能是由于治疗时的高肿瘤负荷或既往暴露于贝林妥欧单抗(也靶向CD19)所致。理想情况下,T-ALL的 CAR-T 细胞的开发取决于两个主要标准:首先,发现一种跨各种 T-ALL 亚型表达的 T-ALL 抗原,其次,一种不存在于正常 T 细胞上的抗原,以最大限度地降低发生 自相残杀(fratricide)效应和持续 T 细胞再生障碍(aplasia)的风险。该方面已取得进展。CD5 CAR-T 细胞和 CD7 CAR-T 细胞控制自相残杀效应,目前处于早期开发阶段,此外异基因碱基编辑的 CD7 CAR-T 细胞在 R/R T-ALL 的 I 期研究中显示出可喜结果(图6)。
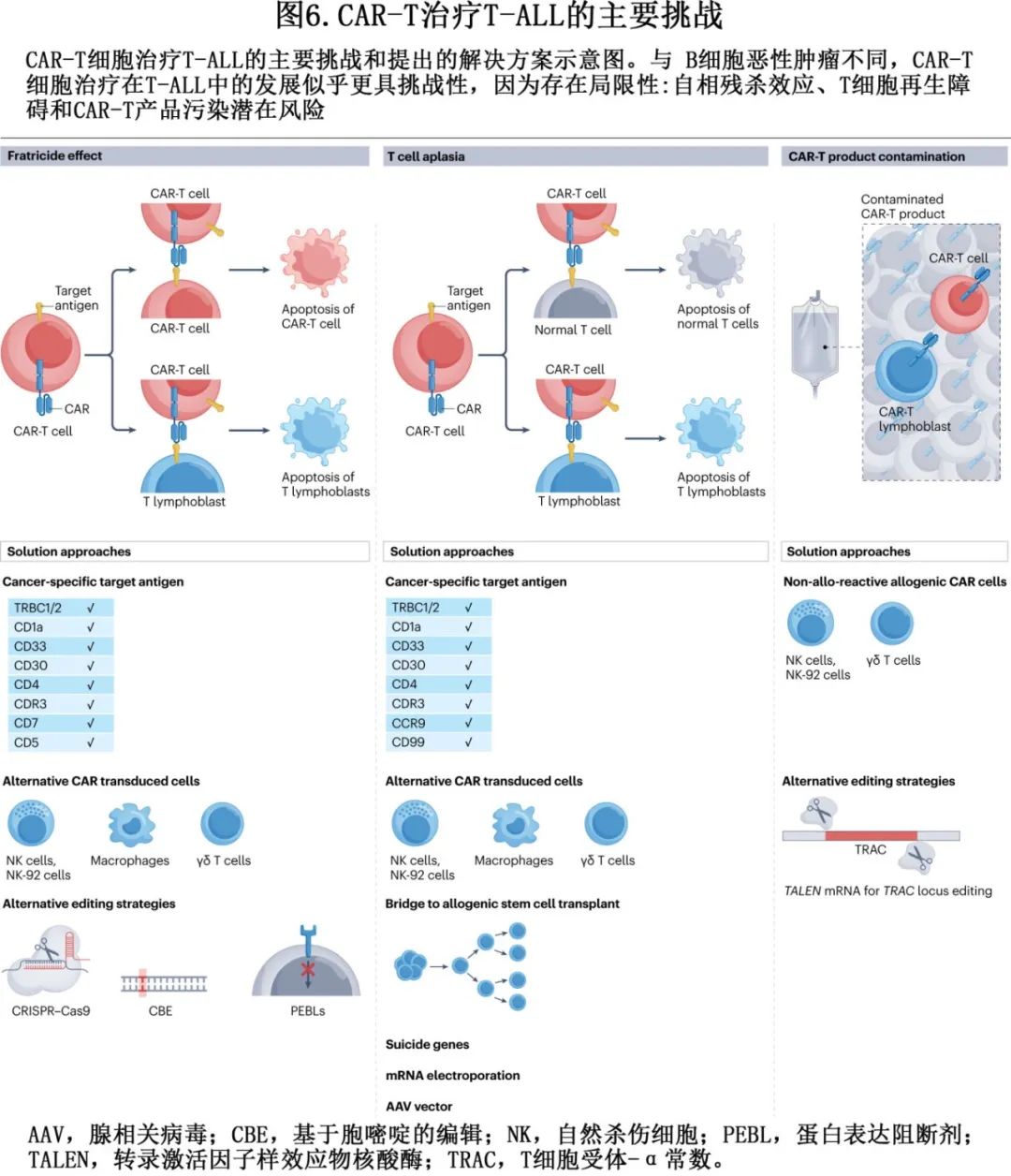
最后,目前该领域发展循序,包括使用这些疗法作为高危患者的一线治疗,靶向多种抗原缓解逃逸现象和使用来自异基因供者的 T 细胞为现成的治疗策略铺平道路(图6)。
异基因骨髓移植:在ALL治疗中的作用不断发展
Allo-HSCT仍是治疗复发或高危ALL的标准治疗方案的一部分,也适用于标危ALL但巩固后持续MRD的患者,但如果MRD为阴性则不适用。
许多合作小组使用Allo-HSCT治疗非复发ALL(图5),其在减轻治疗诱导的耐药方面很有用(后者通常预示着持续MRD)。鉴于MRD可作为ALL治疗中Allo-HSCT成功的预测指标,实现MRD阴性应被视为Allo-HSCT成功的先决条件。
大多数儿科工作组支持,巩固治疗结束时高水平MRD 的首次完全缓解患者应推荐allo-HSCT。对于复发患者,进行 allo-HSCT 的决定是基于表型(BCP-ALL或T-ALL)、首次完全缓解持续时间、高危遗传学(例如TP53突变、低亚二倍体、TCF3::PBX1、KMT2A重排)或对挽救治疗反应不充分等因素。值得注意的是,使用贝林妥欧单抗(而非化疗)巩固二次完全缓解作为 allo-HSCT 的桥接,已经证明可改善患者结局和安全性。
对于年轻患者来说,自从广泛采用儿童化疗方案以来,allo-HSCT的标准已经发生重大变化。尽管缺乏对照研究,但目前的建议是为具有高危特征的患者进行allo-HSCT,该特征包括诊断时白细胞计数高、不良表型(pro-B、早期/成熟T型)、高危遗传学(例如KMT2A重排、低亚二倍体、Ph阳性、Ph样)或MRD评估的早期治疗耐药。在二次完全缓解或之后,所有成人患者(包括原发难治性ALL患者)都适合allo-HSCT。成人allo-HSCT的指征通常使得供者选择范围更广,且结局不断改善。
对于老年患者,在计划移植前使用细胞减少治疗(cytoreduction)是一种常见的治疗策略。日本成人白血病研究组报道,在接受allo-HSCT前获得MRD阴性缓解(以10-5个细胞为临界值)的Ph阳性ALL患者中,allo-HSCT相对于观察,具有更高的OS(73%对50%)和无复发生存率(70%对20%)。在考虑allo-HSCT的情况下,首先获得MRD阴性缓解的重要性不应被夸大,但由于MRD应视为连续变量,新的数据表明,识别≤10-6个细胞的MRD水平的新方法可能未来用于避免allo-HSCT或用于降级治疗。
虽然目前有多种治疗方案进行实践,但一项儿科III期研究中显示,全身照射(TBI)可降低复发风险,但TBI也可导致移植长期幸存者生活质量下降,以及伴发多种并发症。
Allo-HSCT一直受到复发性ALL、方案相关毒性和移植物抗宿主病等常见问题的挑战,但随着TKIs、贝林妥欧单抗、奥加伊妥珠单抗和抗CD19或抗CD22CAR-T过继疗法的使用,许多并发症得到改善。同时,allo-HSCT已逐渐成为这些新兴免疫疗法和靶向治疗相结合的平台,包括移植后使用。例如,Ph阳性ALL进行allo-HSCT时,患者通常在移植后至少2年接受TKI治疗。此外,早期引入贝林妥欧单抗作为Ph阳性和Ph阴性成人ALL的一线巩固治疗,可增强MRD反应并降低高危亚组的allo-HSCT指征。一项前瞻性研究评估了CAR-T单一疗法在诱导和巩固反应较差的儿童和AYA中的潜在作用。
尽管这些创新方法显示出令人印象深刻的反应,但即使在R/R ALL病例中,allo-HSCT也将继续发展,旨在提高对干预的精确排序的理解,最终最大限度地减少不良反应并降低复发率。
生活质量
以治愈为总目标时,风险校正的、症状管理的治疗过程对白血病患者的生活质量具有最强烈的积极影响。避免复发和控制allo-HSCT的长期影响对于维持高质量的生活也至关重要。然而,常见不良事件的缓解,包括化疗引起的恶心和呕吐、中性粒细胞减少性发热、疲劳和神经系统并发症的缓解,也对患者是否完成预定的治疗有重大影响。在一项对来自42个国家的552名成年受访者(139名ALL患者、332名急性髓性白血病患者和81名急性早幼粒细胞白血病患者)的调查中,年龄较小、女性、收入较低以及身体能力下降与生活质量下降密切相关。所有的治疗都包含大量的变量,在积极治疗期间,需通过社会工作者、临床药剂师、营养师、物理治疗师、精神科医生和许多其他多专业团队成员的综合技能来满足每个患者的需求,从而提高生活质量,而与重新回归生活相关的议题则更适合治疗后的随访阶段。此外,生活质量在很大程度上取决于年龄相关的标准,例如减轻幼儿痛苦的治疗过程,防止AYA放弃治疗(他们还必须处理学校、工作和职业事务),老年人更容易发生与治疗相关的不良事件和自付费用带来的经济困难。为了实现这些目标,可以通过有效的支持性护理来改善生活质量,同时积极治疗,避免达到并维持长期缓解的患者发生晚期效应。
积极治疗期间的支持治疗
如果不使用止吐药物,化疗引起的恶心和呕吐可导致疲劳、恶病质和生活质量显著下降,最终导致停止治疗。5HT3拮抗剂可显著改善包括儿童在内的所有年龄段患者的生活质量。物理康复很重要,可提高生活质量,成功管理神经病、肌病和疲劳。同伴支持和护理人员应对技能的发展,也是所有接受ALL治疗的患者顺利度过癌症之旅的重要因素。
避免晚期效应:可能性的艺术
由于更好的ALL治疗方法改善了治疗结局,正在进入一个剂量递减成为可能的时代,其目标是减少或消除具有显著晚期效应的治疗。已经出现了三个重点领域:降级方案;药物基因组学;现代放疗。随着认识到蒽环类药物可导致心脏疾病,人们设计了新的方法来尽可能减少这些药物的使用,并在适当时使用右丙亚胺,以减少暴露于蒽环类药物的患者心肌收缩力受损的可能性。尽管对 ALL 有活性,但拓扑异构酶抑制剂与继发性恶性肿瘤的发生相关,要求在当前治疗方案中减少此类药物的使用。在成人中,强化方案导致治疗相关发病率和死亡率增加。根据年龄、对某些药物的遗传易感性(如TPMT 多态性相关的硫代嘌呤)调整化疗强度,或Ph 阳性 ALL 中降低化疗强度以支持 TKI,均有助于降低毒性。尽管头颅放疗和 TBI对白血病有效,也可作为复发的预防性治疗,但与内分泌病、认知功能障碍和继发性恶性脑肿瘤发展的晚期效应相关。总之,这些治疗可能会降低癌症生存者的生育力,需要男性在治疗开始前或移植前保存精子,女性保留卵巢组织。
从细胞到社会,以及漫漫前路
医学界需要评估影响生活质量的复杂社会因素,这可反映在作为少数群体而被边缘化的种族或族裔群体的低存活率上。在接受非普及保健治疗时,基于种族的结局存在差异,但在实行国有化保健方案的国家,儿童却没有这种差异,这引起了人们对保健差异和系统性不平等的关注。此外,生活在极端贫困中的儿童的复发率大约是对照组其他儿童的两倍,这并非完全归因于不遵守口服6-巯基嘌呤,而表明毒性应激、获得保健、粮食不安全和缺乏可靠的运输可能导致结局的差异。尽管许多研究人员继续更好地了解影响结局的生物学机制,但也可能是种族和贫困在患者的生活中起着至关重要的作用,他们应该得到更好的社会支持,以改善这一老问题。
展望
基因组技术的快速发展极大地提高了ALL的精确分子分类,对诊断、风险分层、预后预测和治疗决策具有重要的临床意义。尽管各种遗传异常目前将>90%的ALL患者分类,但仍需要进一步研究以充分了解其分子致病功能、所鉴定亚型的协作事件和前瞻性靶向治疗,可通过单细胞测序、WGS、蛋白质组学和代谢组学分析等工具。特别是,了解驱动克隆异质性和进化的机制,将可能表征具有临床影响的遗传和表观遗传病变的进化谱,特别是在R/R中。
尽管化疗仍然是大多数ALL病例的主要治疗,但迫切需要确定新的治疗策略,特别是靶向治疗。基于白血病细胞内特定依赖性的识别,未来可能会整合TKI之外的靶向治疗,成为化疗免疫治疗方案的支柱。
对于部分靶点,如CDK4/CDK6,在ALL临床前研究中早就成功,但临床转化仍未反映这些结果。合理的CDK4-CDK6组合或替代化学策略的发展,如CKD定向蛋白水解靶向嵌合体(PROTAC),可能会导致这些分子在临床中的持续使用。PTEN/PI3K/AKT/mTOR抑制剂的情况也相似;其中rapamaycin和rapalogues已进入临床试验,并在与既定方案结合时显示出疗效。
其他靶点的药物开发则更为初步。BH3模拟物维奈克拉已经在多种联合化疗和不联合化疗中进行测试。这些分子的安全性较有希望,在未来几年内,应该了解如何更好地将它们纳入临床实践。另一个例子是在表观遗传失调的白血病(如KMT2A重排白血病)中抑制menin,Menin抑制剂通过阻止Menin蛋白与KMT2A复合物的结合而起作用,从而发挥治疗作用。包括SNDX-5613、KO-539和DSP-5336在内的一些分子已经在临床试验中显示出令人满意的结果,特别是在患有NPM1c突变的R/R急性髓性白血病或KMT2A重排的ALL患者中。例如,Augment-101 I/II期研究显示,总缓解率为53%,有多例患者实现MRD阴性完全缓解。未来,靶向治疗也可能对新发现亚型的患者有益,如联合FLT3抑制剂治疗ZNF384 重排ALL,联合HDAC抑制剂治疗MEF2D重排ALL,但还需要进一步的临床试验。而治疗T-ALL必然需要更多努力。尽管NOTCH1仍然是合理靶标,但突变体选择性方法也正在出现。然而,CB-103 (limantrafin)是一种泛转录Notch抑制剂,在γ-分泌酶调节剂取得有限成功后,正在用于试验。此外,正常T细胞和淋巴母细胞中表面靶点或抗原的共同存在为T- ALL中ADC的发展提供了障碍。只有达雷妥尤单抗和抗IL-7R的ADC A7R-ADC-SN-38进入临床评价阶段。
可以期待新一代 CAR-T 细胞的蓬勃发展,包括异基因产品在内的制造技术得到显著改善,并朝着新的或复杂的靶点发展。
总之,在全球范围内实施化疗、靶向抑制剂、mAb、ADC、BiTE、CAR-T治疗或 allo-HSCT 等标准化、精准、个性化和协同治疗,将有望在未来几年改善 ALL 患者的结局,尤其是成人患者。新技术的快速发展及其成本的下降,有望在未来十年内影响这一过程,最终导致 ALL 的诊断和治疗更精简化。
参考文献
Pagliaro, L., Chen, SJ., Herranz, D. et al. Acute lymphoblastic leukaemia. Nat Rev Dis Primers 10, 41 (2024). https://doi.org/10.1038/s41572-024-00525-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#急性淋巴细胞白血病# #ALL#
33