协和医学杂志:肥厚型心肌病心脏性猝死的高危因素及预防
2023-08-24 协和医学杂志 协和医学杂志 发表于加利福尼亚
识别并筛查HCM患者SCD的高危因素,对于制订预防策略尤为重要。
肥厚型心肌病(HCM)是一组以心肌肥厚为特征的常染色体显性遗传病,可发生于任何年龄段[1],其发病率为2‰~5‰,在三级医疗中心的年死亡率为2%~4%[2]。
在我国,HCM的患病率为0.08%,估计患病人数超过100万例。心脏性猝死(SCD)是HCM最严重的结局,成年HCM患者的SCD年发病率约为0.5%~1%[3]。
发生SCD的患者可能存在如下高危因素:SCD家族史、不明原因的晕厥、非持续性室性心动过速(NSVT)、严重左心室肥厚、左心室收缩功能不全、左心室心尖室壁瘤(LVAA)、广泛晚期钆增强(LGE),另外,基因突变、异常血压反应(ABPR)、低龄、左心室流出道梗阻、N末端脑钠肽前体(NT-proBNP)等亦与SCD相关。
植入植入式心脏复律除颤器(ICD)是目前减少SCD风险最有效的措施,药物干预、外科室间隔心肌切除术和室间隔心肌酒精消融术(ASA)也可能有效。因此,识别并筛查HCM患者SCD的高危因素,对于制订预防策略尤为重要。
1 HCM患者SCD的高危因素
2011年,美国心脏协会(AHA)发布的SCD危险因素包括:SCD家族史;不明原因的晕厥;NSVT;最大左心室壁厚度以及运动期间的ABPR。上述5种非侵入性的临床指标虽然只有20%的阳性预测值,但其阴性预测值可达95%[4]。
2014年,欧洲心脏病学会(ESC)创建了SCD危险预测模型,为HCM患者提供了5年的SCD危险评分。该模型增加了3个新的危险因素,包括年龄、左心房内径(LAD)和左心室流出道梗阻[5]。
2020 AHA指南将HCM合并左心室收缩功能不全、LVAA和心脏MRI显示的LGE列为HCM患者发生SCD的临床危险因素[6]。另外,作为预测HCM患者预后的重要因素,近年来关于NT-proBNP和心肺运动试验(CPET)研究越来越多[7-8]。
2022年,ESC基于近年来SCD危险分层的新证据、诊断和治疗方案等,更新了HCM患者SCD的预防推荐[9]。目前学界公认的HCM患者SCD高危因素见表1。
表1 HCM患者SCD的高危因素

1.1 家族史
SCD家族史定义为一名或多名50岁以下的≥1级亲属或其他近亲发生过SCD[10]。SCD家族史与HCM患者发生SCD显著相关[11]。
一项荟萃分析表明,与无明显家族史的HCM患者相比,有SCD家族史的患者发生SCD的风险增加了13.4%[12]。2022年ESC指南建议HCM患者应进行遗传咨询、心电图和超声心动图检查。
对于年龄≥16岁、5年内发生SCD危险程度为4%~6%的HCM患者,符合下列条件之一时,应考虑植入ICD:(1)存在LGE;(2)LVEF<50%;(3)ABPR;(4)LVAA;(5)存在肌节病原性突变。对于年龄<16岁、估计5年SCD风险≥6%的HCM患者可考虑植入ICD[9]。
1.2 不明原因的晕厥
不明原因的晕厥定义为在过去6个月内出现一次不明原因的意识丧失,除外神经源性晕厥、血管源性晕厥等,无明确病因引起的晕厥史。不明原因的晕厥可增加HCM患者尤其是儿童和年轻患者的猝死率。Spirito等[13]评估了1511例HCM患者晕厥与SCD的关系,结果发现与无晕厥患者相比,近期(<6个月)不明原因晕厥患者发生SCD的相对风险增加了5倍,且与年龄无关。
1.3 NSVT
HCM 患者发生 SCD 的主要原因之一是其导致的室性心律失常,尤以NSVT最为常见。NSVT是指连续出现≥3次的室性期前收缩波形,频率至少为100次/min,持续时间<30 s。NSVT在HCM患者中发生率较高,可达20%~30%。一项荟萃分析纳入了19项研究(12146例HCM患者),结果发现NSVT是SCD最重要的预测因素,发生过NSVT的患者其SCD发生率增加了3倍[12]。
1.4 严重左心室肥厚
多项研究均指出,左心室壁厚度≥30 mm是SCD的独立预测因素[14]。当左心室极度肥厚(≥30 mm)时,HCM患者20年内SCD的发生率高达40%[15]。
2项队列研究发现,左心室肥厚与估计的SCD危险度之间呈倒置“U”形关系, SCD的风险随左心室壁厚度增加而增加,达到平台期后反而呈下降趋势,这种发现同时存在于成人和儿童患者中[16-17]。
1.5 左心室收缩功能不全
终末期HCM可引起左室收缩功能障碍,主要表现为LVEF<50%,这是HCM高度恶化的表现,具有较高的SCD风险[18]。当HCM患者LVEF<50%时,及时采取抗心衰治疗、植入ICD和心脏移植等预防措施对于降低终末期HCM患者不良预后发生率具有重要意义[19]。
1.6 LVAA
LVAA定义为左心室腔最远端部分的离散薄壁运动障碍,以薄壁、瘢痕和运动障碍性心尖缘为特征,伴有累及中隔和游离壁的弥漫性增厚,导致“沙漏”构型和中腔肌肉变窄。据报道,HCM患者的LVAA的发生率为1%~5%,SCD可发生于任何年龄段的LVAA患者中[20]。LVAA与SCD及室性心律失常风险增加有关,但动脉瘤的大小尚未被证明与SCD危险度相关[21]。
Rowin等[22]在其队列研究中发现,LVAA患者的SCD发生率为4.7%,是无室壁瘤患者的5倍。因此,有研究者建议将伴有严重症状的HCM患者的室壁瘤切除,以减少不良事件的发生率。
1.7 LGE
当心肌纤维化后,原有的心肌纤维被纤维瘢痕替代,纤维之间的间隙增大,钆对比剂便可在此聚集。LGE心脏MRI技术已作为诊断心肌纤维化的无创检查方法应用于临床,能够较为全面地评价心脏结构、功能及心肌活性,并由此推测发生恶性心律失常和SCD的可能[23]。
一项荟萃分析显示,SCD风险与LGE程度显著相关,LGE每增加10%,SCD的危险度增加36%[24]。值得注意的是,除考虑HCM患者是否存在LGE外,LGE的位置也可预测SCD的发生[25],室间隔外LGE患者的SCD发病率明显高于仅室间隔内LGE的患者[26]。
近年来,有学者提出,整体离散度评分(GDS)是一种新型的定量评价HCM心肌纤维化异质性的标志物。对于SCD风险评分为中低危的患者,与LGE范围>15%相比,GDS可识别出发生严重心脏事件的高风险患者[27]。LGE在HCM患者SCD中的预测价值值得更多临床研究关注。
2 HCM患者SCD的其他危险因素
2.1 基因突变
在HCM的发病机制中,迄今已确定20多个基因中的2000多种突变体。其中, MYH7(编码β-肌球蛋白重链7)、MYL2(编码肌球蛋白轻链2)、MYL3(编码肌球蛋白轻链3)、MYBPC3(编码心脏型肌球蛋白结合蛋白C)、TNNT2(编码心肌肌钙蛋白T2)、TNNI3(编码心肌肌钙蛋白I3)、ACTC1(编码心肌肌动蛋白1)和TPM1(编码α原肌球蛋白1)是具有高致病证据的基因[28]。在上述基因中,MYBPC3突变最常见,占已识别基因突变的50%,但MYBPC3基因突变被认为是一种“良性突变”,更多发生于老年人,SCD发生率也较低。
MYH7基因突变是另一种常见的突变方式,发生于25%~40%的HCM患者,其突变携带者多为青壮年,SCD发生率更高[14]。高达5%的HCM患者同时具有多种突变类型,尽管目前认为特定基因突变与SCD的关系存在争议,但同一患者携带2种或以上突变(无论突变是否来自同一基因),均可能导致更为严重的临床表型,SCD风险增加[29]。
2.2 ABRP
ABPR的特点是渐进性血压降低或收缩压不能恢复,定义为运动时相比静息状态下收缩压上升幅度小于20 mm Hg(1 mm Hg=0.133 kPa)或较运动高峰时血压下降幅度大于20 mm Hg。研究表明,ABPR评估HCM患者发生SCD的能力与年龄有关,年龄<50岁,ABPR有预测意义,特别是当运动期间收缩压改变不良时[30]。
2.3 年龄
Spirito等[13]评估了1511例HCM患者,发现SCD风险随年龄增长而显著降低。若患者较为年轻,SCD风险将增加,这些患者往往无症状或症状轻微,而60岁以上的患者发生SCD的情况则较为罕见。
2.4 LAD
LAD可作为普通人群以及HCM发生心血管事件的临床标志。在HCM患者中,左心房扩大较常见,左心房扩大能够预测房颤的发生,而房颤是HCM患者最常见的心律失常事件。LAD增大是HCM相关死亡率的单变量预测因素[31]。
2.5 左心室流出道梗阻
左心室流出道梗阻定义为心室流出道瞬时峰值压力差≥30 mm Hg,此时左心室射血分数大幅度降低,可能激活肾素-血管紧张素-醛固酮系统,导致心律失常的发生,从而增加了HCM患者发生SCD的风险。多变量分析表明,左心室流出道梗阻是SCD的独立预测指标,此类患者SCD风险增加了2.4倍[32]。
2.6 NT-proBNP
NT-proBNP已被证明是用于心力衰竭诊断和危险分层的既定生物标志物,可反映心脏功能,与各种心血管疾病的死亡率和发病率有关[33]。在HCM中,通常可观察到循环NT-proBNP水平升高,并与心力衰竭相关的死亡有关。
然而,对于HCM患者NT-proBNP水平与SCD之间的关系尚未确定[34]。一项前瞻性研究发现,NT-proBNP是HCM患者SCD的独立预测指标,可能有助于该病的危险分层。此项研究共纳入977例HCM患者,平均随访3年,29例患者发生了SCD,且随着基线NT-proBNP水平对数值升高,SCD发生风险增加,最高三分位数患者的SCD危险约为最低三分位数患者的15倍[7]。结合目前的HCM指南,检测HCM 患者NT-proBNP可能有助于对其SCD危险进行分层。
2.7 CPET
CPET可在患者运动状态下安全、无创地评估患者的心脏功能,其特异的波浪形呼吸是患者心力衰竭的典型临床表现之一[35],峰值摄氧量是CPET的核心指标,可反映人体最大有氧代谢能力和运动耐力。
Coats等[36]进行的一项单中心队列研究发现,峰值摄氧量每升高1 mL/(kg·min),死亡或心脏移植风险降低 21%。多项研究显示CPET与HCM患者的预后密切相关,并可提供危险分层,从而实现尽早对患者进行更全面的预后评估,降低SCD等恶性事件的发生率[8]。也有学者指出,CPET可有效预测心力衰竭,但与SCD无关,可能因室性心律失常与收缩功能丧失机制存在不同[37]。
3 HCM患者SCD的预防
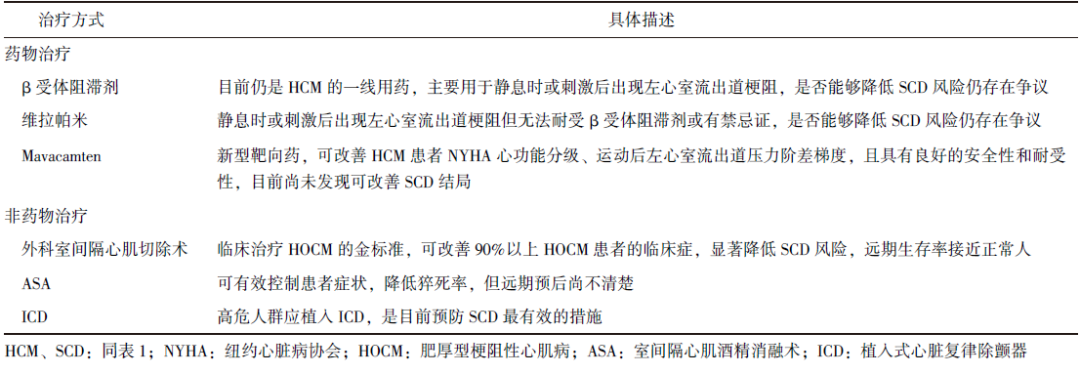
如何对HCM患者进行SCD危险分层和预防是临床最为重要的问题。目前对HCM进行早期干预的方式主要为药物治疗,对于左心室流出道阶差超过50 mm Hg且不能通过药物缓解症状的肥厚型梗阻性心肌病(HOCM)患者,需采取室间隔减容术,包括外科室间隔心肌切除术和ASA,ICD是预防HCM患者SCD唯一可靠的方法(表2)。
表2 HCM患者SCD的预防
3.1 药物治疗
3.1.1 β受体阻滞剂与维拉帕米
β受体阻滞剂作为HCM的一线用药,主要用于静息时或刺激后出现左心室流出道梗阻。维拉帕米则主要用于静息时或刺激后出现出现左心室流出道梗阻,但无法耐受β受体阻滞剂或有禁忌证的患者[1]。然而,目前研究表明,β受体阻滞剂或者维拉帕米是否能够降低SCD风险仍存在争议。
3.1.2 新型药物
随着对HCM药物治疗的深入探索,靶向药应运而生。Mavacamten是一种心肌肌球蛋白变构抑制剂,可通过减少肌动蛋白-肌球蛋白形成来靶向治疗HCM,从而降低收缩性并改善心肌能量。
EXPLORER-HCM研究发现,对于纽约心脏病协会心功能分级(NYHA)≥2级的左室流出道梗阻患者,Mavacamten能够有效降低左心室流出道压力并改善症状、运动表现和健康状况。
与安慰剂相比,该药可改善受试者的复合终点、NYHA心功能分级、运动后左心室流出道压力阶差梯度,且具有良好的安全性和耐受性[38]。但目前尚未发现Mavacamten可改善SCD结局。
3.2 外科治疗
3.2.1 外科室间隔心肌切除术
外科室间隔切除术旨在消除收缩期前向运动征的病理生理改变,已成为临床治疗HOCM的金标准,可改善90%以上HOCM患者的临床症状。国内外大量队列研究证实,HOCM患者接受外科手术治疗后,远期生存率接近于正常人群,SCD发生率明显降低[39-40]。
3.2.2 ASA
对药物治疗效果欠佳的HOCM患者或者临床症状虽不严重,但左心室流出道压力阶差高及有其他猝死高危因素的患者,可选择ASA。一项单中心研究显示,接受ASA治疗的HOCM患者SCD发生率较未经ASA治疗的患者降低[41]。
对于ASA给HOCM患者带来的收益是否更优于室间隔切除术,目前仍无定论。一项荟萃分析纳入4547例HOCM患者以比较接受室间隔切除术与ASA患者的预后,结果发现, 二者SCD并无显著差异(1.78% 比 0.76%,P=0.20),但接受室间隔切除术的患者可更多免于再次干预[42]。
总而言之,此两种技术对于预防SCD均安全有效,应根据患者的具体情况选择更为合适的治疗方案。
3.3 ICD
对有可能发生SCD的HCM高危人群植入ICD是最重要的临床管理进展之一,且是目前降低SCD风险最有效的措施。多项研究表明[43],对于将ICD 用于一级预防的患者,当其危险标志物数量≥1个时,ICD对室性心动过速/室颤发作的终止率为每年3%~4%。
最新指南指出,对于成人HCM患者,当患有高危因素中的1条时,即应考虑植入ICD进行一级预防(Ⅱa类推荐,B级证据);若无上述危险因素,但动态心电图检查发现NSVT,或发现广泛的心肌纤维化,可考虑植入ICD进行一级预防(Ⅱb类推荐,B级证据);无上述危险因素的HCM患者,不推荐植入ICD(Ⅲ类推荐,B级证据)[1]。
虽然ICD可保护有SCD风险的HCM患者,但相关并发症不容忽视,如血管损伤和感染等,且考虑到ICD价格昂贵,可能会给社会和家庭造成沉重的经济负担。
另外,指南建议医生在植入ICD前积极与患者沟通,植入后对患者进行心理状态评估及痛苦治疗(I类推荐,C级证据)[9]。如何平衡SCD高危患者植入ICD和不必要的ICD植入之间的问题,仍面临巨大挑战。
4 小结与展望
HCM是最常见的遗传性心肌病之一,常导致室性心律失常和SCD。HCM存在多种诱发SCD的高危因素,但其预测价值有限,且HCM患者常以SCD为首发症状,尤其是年轻患者,这更增加了该类疾病的严重程度。ICD的出现有效终止了恶性心律失常,有望降低SCD的发生率。在临床实践中,应早期识别SCD高危因素,并建立完善的危险分层方案,对患者进行早期干预和治疗,以改善HCM患者的预后。
参考文献
[1]国家心血管病专家委员会心力衰竭专业委员会, 中国医师协会心力衰竭专业委员会, 中华医学会心血管分会心力衰竭学组, 等. 中国肥厚型心肌病指南2022[J]. 中华心力衰竭和心肌病杂志,2022,06:80-105.
[2]Elliott PM, Gimeno JR, Thaman R, et al. Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy[J]. Heart,2006,92:785-791.
[3]Fananapazir L, Epstein ND. Prevalence of hypertrophic cardiomyopathy and limitations of screening methods[J]. Circulation,1995,92:700-704.
[4]Crocker TF, Brown L, Lam N, et al. Information provision for stroke survivors and their carers[J]. Cochrane Database Syst Rev,2021,11:CD001919.
[5]Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC)[J]. Eur Heart J,2014,35:2733-2779.
[6]Ommen SR, Mital S, Burke MA, et al. 2020 AHA/ACC Guideline for the Diagnosis and Treatment of Patients With Hypertrophic Cardiomyopathy: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines[J].Circulation,2020,142:e533-e557.
[7]Wu G, Liu J, Wang S, et al. N-terminal pro-brain natriuretic peptide and sudden cardiac death in hypertrophic cardiomyopathy[J].Heart,2021,107:1576-1583.
[8]Bayonas-Ruiz A, Muoz-Franco FM, Ferrer V, et al. Cardiopulmonary Exercise Test in Patients with Hypertrophic Cardiomyopathy: A Systematic Review and Meta-Analysis[J].J Clin Med,2021,10:2312.
[9]Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death[J]. Eur Heart J,2022,43:3997-4126.
[10]Geske JB, Ommen SR, Gersh BJ. Hypertrophic Cardiomyopathy: Clinical Update[J].JACC Heart Fail,2018,6:364-375.
[11]Maron MS. Family History of Sudden Death Should Be a Primary Indication for Implantable Cardioverter Defibrillator in Hypertrophic Cardiomyopathy[J]. Can J Cardiol,2015,31:1402-1406.
[12]Liu Q, Li D, Berger AE, et al. Survival and prognostic factors in hypertrophic cardiomyopathy: a meta-analysis[J].Sci Rep,2017,7:11957.
[13]Spirito P, Autore C, Rapezzi C, et al. Syncope and risk of sudden death in hypertrophic cardiomyopathy[J].Circulation,2009,119:1703-1710.
[14]Moak JP, Leifer ES, Tripodi D, et al. Long-term follow-up of children and adolescents diagnosed with hypertrophic cardiomyopathy: risk factors for adverse arrhythmic events[J].Pediatr cardiol,2011,32:1096-1105.
[15]Olivotto I, Gistri R, Petrone P, et al. Maximum left ventricular thickness and risk of sudden death in patients with hypertrophic cardiomyopathy[J]. J Am Coll Cardiol,2003,41:315-321.
[16]O'Mahony C, Jichi F, Monserrat L, et al. Inverted U-Shaped Relation Between the Risk of Sudden Cardiac Death and Maximal Left Ventricular Wall Thickness in Hypertrophic Cardiomyopathy[J].Circ Arrhythm Electrophysiol,2016,9:e003818.
[17]Norrish G, Ding T, Field E, et al. Relationship Between Maximal Left Ventricular Wall Thickness and Sudden Cardiac Death in Childhood Onset Hypertrophic Cardiomyopathy[J].Circulation Arrhythm Electrophysiol,2022,15:e010075.
[18]Harris KM, Spirito P, Maron MS, et al. Prevalence, clinical profile, and significance of left ventricular remodel-ing in the end-stage phase of hypertrophic cardiomyopathy[J].Circulation,2006,114:216-225.
[19]Rowin EJ, Maron BJ, Carrick RT, et al. Outcomes in Patients With Hypertrophic Cardiomyopathy and Left Ventricular Systolic Dysfunction[J]. J Am Coll Cardiol,2020,75:3033-3043.
[20]Rowin EJ, Maron BJ, Chokshi A, et al. Left ventricular apical aneurysm in hypertrophic cardiomyopathy as a risk factor for sudden death at any age[J]. Pacing Clin Electrophysiol,2018,41:1031-1033.
[21]Adamczak DM, Oko-Sarnowska Z. Sudden Cardiac Death in Hypertrophic Cardiomyopathy[J]. Cardiol Rev,2018,26:145-151.
[22]Rowin EJ, Maron BJ, Haas TS, et al. Hypertrophic Cardiomyopathy With Left Ventricular Apical Aneurysm: Implications for Risk Stratification and Management[J]. J Am Coll Cardiol,2017,69:761-773.
[23]Kamp NJ, Chery G, Kosinski AS, et al. Risk stratification using late gadolinium enhancement on cardiac magnetic resonance imaging in patients with hypertrophic cardiomyopathy: A systematic review and meta-analysis[J]. Prog Cardiovasc Dis,2021,66:10-16.
[24]Weng Z, Yao J, Chan RH, et al. Prognostic Value of LGE-CMR in HCM: A Meta-Analysis[J]. JACC Cardiovasc Imaging,2016,9:1392-1402.
[25]Amano Y, Yanagisawa F, Kitamura M, et al.Relationship of Nonseptal Late Gadolinium Enhancement to Ventricular Tachyarrhythmia in Hypertrophic Cardiomyopathy[J]. J Comput Assist Tomogr,41:768-771.
[26]Li X, Lai L, Luo R, et al. The Clinical Prognosis of Presence and Location of Late Gadolinium Enhancement by Cardiac Magnetic Resonance Imaging in Patients with Hypertrophic Cardiomyopathy: a Single-Center Cohort Study[J]. J Cardiovasc Transl Res,2021,14:1001-1016.
[27]Aquaro GD, Grigoratos C, Bracco A, et al. Late Gadolinium Enhancement-Dispersion Mapping: A New Magnetic Resonance Imaging Technique to Assess Prognosis in Patients With Hypertrophic Cardiomyopathy and Low-Intermediate 5-Year Risk of Sudden Death[J]. Circ Cardiovasc Imaging,2020,13:e010489-e010489.
[28]Shen H, Dong SY, Ren MS, et al. Ventricular arrhythmia and sudden cardiac death in hypertrophic cardiomyopathy: From bench to bedside[J]. Front Cardiovasc Med,2022,9:949294.
[29]Maron BJ, Maron MS, Semsarian C. Double or compound sarcomere mutations in hypertrophic cardiomyopathy: a potential link to sudden death in the absence of conventional risk factors[J].Heart rhythm,2012,9:57-63.
[30]Sadoul N, Prasad K, Elliott PM, et al.Prospective prognostic assessment of blood pressure response during exercise in patients with hypertrophic cardiomyopathy[J].Circulation,1997,96:2987-2991.
[31]Maron BJ, Rowin EJ, Casey SA, et al. Risk stratification and outcome of patients with hypertrophic cardiomyopathy≥60 years of age[J]. Circulation,2013,127:585-593.
[32]Elliott PM, Gimeno JR, Tomé MT, et al. Left ventricular outflow tract obstruction and sudden death risk in patients with hypertrophic cardiomyopathy[J]. Eur Heart J, 2006,27:1933-1941
[33]Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC)Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. Eur J Heart Fail,2016,18:891-975.
[34]Coats CJ, Gallagher MJ, Foley M, et al. Relation between serum N-terminal pro-brain natriuretic peptide and prognosis in patients with hypertrophic cardiomyopathy[J].Eur Heart J,2013,34:2529-2537.
[35]Sun XG, Hansen JE, Beshai JF, et al. Oscillatory breathing and exercise gas exchange abnormalities prognosticate early mortality and morbidity in heart failure[J]. J Am Coll Cardiol,2010,55:1814-1823.
[36]Coats CJ, Rantell K, Bartnik A, et al. Cardiopulmonary Exercise Testing and Prognosis in Hypertrophic Cardiomyopathy[J]. Circ Heart Fail,2015,8:1022-1031.
[37]Finocchiaro G, Haddad F, Knowles JW, et al. Cardiopul-monary responses and prognosis in hypertrophic cardiomyopathy: a potential role for comprehensive noninvasive hemodynamic assessment[J].JACC Heart fail,2015,3:408-418.
[38]Olivotto I, Oreziak A, Barriales-Villa R, et al. Mavacamten for treatment of symptomatic obstructive hypertrophic cardiomyopathy (EXPLORER-HCM): a randomised, double-blind, placebo-controlled, phase 3 trial[J].Lancet,2020,396:759-769.
[39]Maron BJ, Rowin EJ, Casey SA, et al. How Hypertrophic Cardiomyopathy Became a Contemporary Treatable Genetic Disease With Low Mortality: Shaped by 50 Years of Clinical Research and Practice[J].JAMA cardiol,2016,1:98-105.
[40]Desai MY, Smedira NG, Dhillon A, et al. Prediction of sudden death risk in obstructive hypertrophic cardiomyopathy: Potential for refinement of current criteria[J]. J Thorac Cardiovasc Surg,2018,156:750-759.
[41]Kuhn H, Lawrenz T, Lieder F, et al. Survival after transcoronary ablation of septal hypertrophy in hypertrophic obstructive cardiomyopathy (TASH): a 10 year experience[J]. Clin Res Cardiol,2008,97:234-243.
[42]Bytyçi I, Nistri S, Mörner S, et al. Alcohol Septal Ablation versus Septal Myectomy Treatment of Obstructive Hypertrophic Cardiomyopathy: A Systematic Review and Meta-Analysis[J].J Clin Med, 2020,9:3062.
[43]Maron MS, Rowin EJ, Wessler BS, et al. Enhanced American College of Cardiology/American Heart Association Strategy for Prevention of Sudden Cardiac Death in High-Risk Patients With Hypertrophic Cardiomyopathy[J].JAMA cardiol,2019,4:644-657.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言