Cell Metabolism:饮食导致的肥胖会让脂肪细胞出现什么变化?Cell子刊单细胞测序研究揭示其可塑性
2021-01-07 生物探索 生物探索
这项研究首次应用单细胞测序技术揭示了在饮食诱导的肥胖中附睾脂肪组织的可塑性。
随着时代的发展,高脂饮食及其造成的肥胖已经逐渐成为危害健康的一大杀手。肥胖不仅会引起多种代谢性疾病(如2型糖尿病),也是心血管疾病、癌症等多种疾病的重要易感因素。事实上,我们关注最多的还是脂肪细胞在其中的变化和作用,这也是进一步研究肥胖的基础。
2020年12月29日,《细胞—代谢》杂志在线发表了南丹麦大学研究人员题为“Plasticity of Epididymal Adipose Tissue in Response to Diet-Induced Obesity at Single-Nucleus Resolution”的合作研究。这项研究首次应用单细胞测序技术揭示了在饮食诱导的肥胖中附睾脂肪组织的可塑性。
研究人员使用高脂饮食(HFD)诱导小鼠肥胖,随后利用单细胞测序技术解析了其附睾白色脂肪组织(eWAT)包含的主要细胞类型。他们将巨噬细胞亚群分为血管周样巨噬细胞(PVM)、非血管周样巨噬细胞(NPVM)、脂相关巨噬细胞(LAM)和增值性脂相关巨噬细胞(LAM)。结果显示,巨噬细胞是eWAT中的主要免疫细胞,HFD诱导的肥胖导致LAM和p-LAM增加,而PVM和NPVM减少。
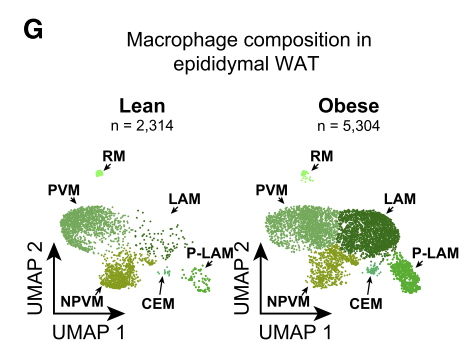
肥胖时eWAT中免疫细胞的组成
与此同时,研究人员还发现,肥胖引发间皮和内皮细胞群细胞因子水平增加,提示HFD诱导的肥胖导致了间皮和内皮亚群的炎症状态。并且,在eWAT中存在4种纤维成脂肪祖细胞,而高脂诱导的肥胖导致前脂肪细胞比例显着增加。也就是说,HFD诱导了纤维成脂肪祖细胞向前脂肪细胞表型转化。
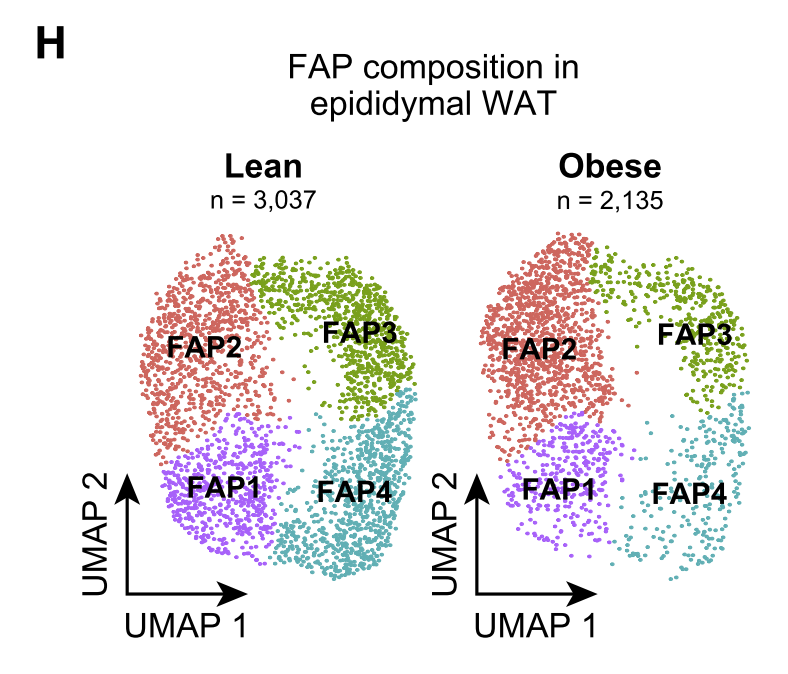
肥胖时纤维成脂肪祖细胞向前脂肪细胞表型转化
总而言之,研究人员认为肥胖时脂肪源性脂肪细胞(LGA)亚群的消失是脂肪细胞可塑性的结果,而不是凋亡或坏死造成的。同时,肥胖已被证明可诱导参与WAT巨噬细胞增殖,但其巨噬细胞特异性基因下调而脂质处理基因急剧增加。研究提供的这些数据为将来的脂肪细胞分化和脂肪组织可塑性研究奠定了基础。

示意图
原始出处:
Anitta Kinga Sárvári, et al. Plasticity of Epididymal Adipose Tissue in Response to Diet-Induced Obesity at Single-Nucleus Resolution. Cell metabolism, 2020.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








学习
60
#MET#
53
#Meta#
46
#CEL#
47
#Cell#
47
学习
98
#脂肪细胞#
59
#Metabolism#
50
#ABO#
57
学习了!
0