和黄医药与美国Epizyme将开展表观遗传学药物的开发与商业化
2021-08-09 JACKZHAO MedSci原创
https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0809/2021080900018_c.pdf

https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0809/2021080900018_c.pdf
8月9日,上午,香港长和旗下的生物医药公司和黄医药宣布,将与美国生物制药公司Epizyme开展战略合作,在大中华区进行用于治疗皮样肉瘤和滤泡性淋巴瘤的EZH2甲基转移酶抑制剂TAZVERIK®的研究、开发、生产以及商业化。此外,和黄医药并取得为期四年的认股权证,可认购Epizyme的股份。
根据公告显示,和黄医药将负责TAZVERIK®在大中华区的开发及商业化。Epizyme将收取2,500万美元的首期付款,并合资格额外收取不超过1.1亿美元的开发和监管里程碑付款(涵盖最多八个其他潜在适应症)以及额外收取不超过1.75亿美元的销售里程碑付款。
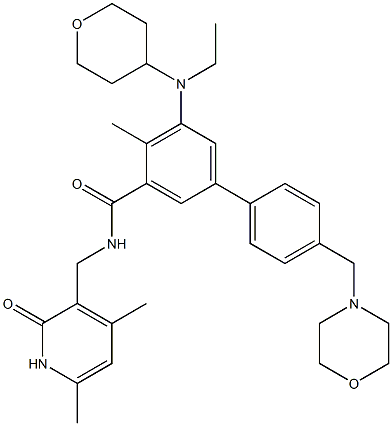
Tazemetostat分子结构式(来源:Chemical Book)
EZH2 是一种组蛋白甲基转移酶(「HMTs」),通过催化组蛋白 H3 赖氨酸 27(H3K27)的甲基化以控制各种基因表达,从而调节细胞的正常生理功能。多种癌症中,如滤泡性淋巴瘤和弥漫性大 B 细胞淋巴瘤均存在 EZH2 的失调,并与临床的不良预后和疗效相关。这两种肿瘤在 2020 年全球新发的非霍奇金淋巴瘤(NHL)病例中分别占约 17%和 32%,而该年 NHL 全球新发病例约为 544000 例 。此外, EZH2 失调还常见于乳腺癌、肺癌、结直肠癌、前列腺癌及胃癌等实体瘤中,它们在 2020 年全球的新发病例数超过约 100 万。
表观遗传学抑制剂 TAZVERIK®通过抑制 EZH2,调节参与细胞周期调控和终末分化基因的转录,从而抑制肿瘤细胞增殖。该作用机制与和黄医药管线中的多种抗肿瘤产品高度互补,联合使用具有协同增效的潜力,例如,在实体瘤中可探索与靶向血管内皮生长因子受体(VEGFR)药物呋喹替尼的联合疗法,或者与具有抗血管生成和免疫调节双重作用机制的药物索凡替尼的联合疗法。 在血液肿瘤领域,可与和黄医药产品线中的多个靶向 B细胞受体信号通路的抑制剂联合用药,包括强效、高选择性的 PI3Kδ 抑制剂 HMPL-689、Syk 抑制剂 HMPL523 和第三代 BTK 抑制剂 HMPL-7606;此外,与 IDH1/2 抑制剂 HMPL-306,ERK 抑制剂 HMPL-295,FGFR抑制剂 HMPL-453 以及 CD47 抗体 HMPL-A83 等产品的联合用药,均具有探索价值。 TAZVERIK®广泛的适用
性和良好的安全性可能有助于增强联合疗法的抗肿瘤疗效。
上皮样肉瘤是一种罕见的、生长缓慢的软组织肉瘤型,主要发生在年轻人中,好发于20~40岁青壮年。根据美国《国家综合癌症网络指南》,每年约有13000名患者被诊断患有软组织肉瘤,相应的死亡人数为5100。目前,主要的治疗方案有手术切除、化疗或放疗。据信上皮样肉瘤占所有软组织肉瘤的1%。上皮样肉瘤患者的五年总生存率取决于肿瘤分期,范围为25-60%。研究发现,超过90%的上皮样肉瘤患者具有基因突变,即INI-1功能丧失,使其可以接受新型EZH2抑制剂TAZVERIK的治疗。
2020 年 1 月 TAZVERIK®在美国获批上皮样肉瘤适应症,该获批基于一项 II 期临床研究中上皮样肉瘤队列的疗效和安全性数据。 (EZH-202 研究,clinicaltrials.gov 注册号:NCT02601950)。
其研究结果发表在《柳叶刀 ∙肿瘤学 》。接受 TAZVERIK®治疗的携带 EZH2 激活突变的 45 名滤泡性淋巴瘤患者中,中位年龄为 62 岁(范围:38-80);42%为男性;42%在一线治疗后出现早期进展(「POD24」);所有患者东部肿瘤协作组(「ECOG」)体能状态(「PS」)评分为 0 或 1。既往接受系统性治疗线数中位值为 2.0(范围:1-11);49%对利妥昔单抗耐药而且 49%对入组前最后一次治疗耐药。接受过至少 2 线系统治疗的 42 名患者中,ORR(95%置信区间)为 69%(53%,82%),其中 12%患者达到完全缓解,57%达到部分缓解。中位 DOR 为 10.9 个月。
接受 TAZVERIK®治疗的携带野生型 EZH2 的 54 名滤泡性淋巴瘤患者中,中位年龄为 61 岁(范围:36-87);63%为男性;59%为 POD24;91% ECOG PS 评分为 0 或 1。既往接受系统性治疗线数中位值为 3.0(范围:1-8);59%对利妥昔单抗耐药且 41%对入组前最后一次治疗耐药。接受过至少二线系统治疗的 53 名患者中,ORR(95%置信区间)为 34%(22%,48%),其中 4%患者达到完全缓解,30%达到部分缓解。中位 DOR为 13.0 个月。
不论相关性,接受 TAZVERIK®治疗的患者中 30%出现严重不良反应。接受 TAZVERIK®治疗的患者中发生率≥2%的严重不良反应为一般状况恶化、腹痛、肺炎、脓毒症,及贫血。最常见(≥20%)不良反应为疲劳、上呼吸道感染、肌肉骨胳疼痛、恶心及腹痛。试验中 8 名患者(8%)因不良反应终止治疗。研究中无死亡病例,且无黑框警告或禁忌症。滤泡性淋巴瘤患者中最常见(≥20%)的不良反应是疲劳、上呼吸道感染、肌肉骨骼疼痛、恶心和腹痛。
滤泡性淋巴瘤(FL)是一种低级别B细胞淋巴癌,是非霍奇金淋巴瘤(NHL)中常见的类型之一,占非霍奇金淋巴瘤(NHL)的10-20%,在西方国家占NHL患者的22%~35%,在中国所占比例略低于西方国家,占 NHL 患者的 8.1%~ 23.5%,我国发病率有逐年增加的趋势,发病年龄较国外低,地域分布上多见于沿海和经济发达地区。FL通常生长缓慢,对化疗敏感。然而,由于FL常反复复发,因此仍很难治愈,需要制定新的治疗策略。约20%的滤泡性淋巴瘤患者有EZH2(一种表观遗传调节因子)的激活突变。
2020 年 6 月 TAZVERIK®在美国获批复发性或难治性滤泡性淋巴瘤适应症,该获批基于一项 II 期临床研究中滤泡性淋巴瘤队列的疗效和安全性数据(E7438-G000-101 研究,clinicaltrials.gov 注册号:NCT01897571)。
该研究结果发表于《柳叶刀∙ 肿瘤学 》,接受治疗的所有 62 名患者中,ORR(95%置信区间)为 15%(7%,26%),其中 1.6%达到完全缓解,13%达到部分缓解。在试验中达到缓解的患者中,67%的缓解持续时间为 6 个月或更长。接受 TAZVERIK®治疗的患者中 37%出现严重不良反应。接受 TAZVERIK®治疗的患者中发生率≥3%的严重不良反应为出血、胸腔积液、皮肤感染、呼吸困难、疼痛,及呼吸窘迫。上皮样肉瘤患者中最常见(≥20%)的不良反应是疼痛、疲劳、恶心、食欲下降、呕吐和便秘。
此外,公告还显示,Epizyme将收取根据TAZVERIK®在大中华区的年度净销售额计算介于10%的中位数至20%的低数位之特许权使用费。此外,和黄医药取得为期四年的认股权证,以按每股股份11.50美元的价格购买金额不超过6,500万美元的Epizyme股份。
和黄医药首席执行官贺隽先生(Mr.ChristianHogg)表示:“我们认为TAZVERIK®的活性以及其控制某些基因表达的表观遗传学机制可与我们一系列的创新肿瘤学药物联合用药,具有高度互补性和潜在的协同效益。”“TAZVERIK®潜在的广泛适用范围和更佳的安全性,在用作联合疗法时可进一步抑制肿瘤的生长和转移。是次合作将加快探索EZH2抑制在多种肿瘤类型(包括恶性血液肿瘤和实体瘤)中的临床潜力。我们深信,Epizyme与和黄医药在实现这些机会方面具备独一无二的优势,从而迅速惠及更多的中国境内外的患者。”
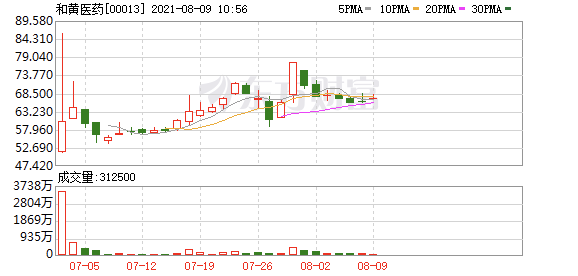
和黄医药近期表现,来源:东方财富
和黄医药近期公布的中期业绩显示,2021年上半年,总收入增长47%至1.574亿美元;肿瘤/免疫业务综合收入增长161%至4,290万美元。公司的中国肿瘤商业团队规模已扩大至约540名员工(2020年底:约390名),覆盖2,500多家肿瘤医院和逾29,000名肿瘤科医生。
和黄医药上周五收报66港元,今日早盘上涨2.58%,过去一个月升17%,较公司6月底上市股价40.1港元高近65%。
参考资料:
1.https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0809/2021080900018_c.pdf
2.https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30441-1/fulltext
3.Chinese Society of Lymphoma, Chinese Anti-cancer Association; Chinese Society of Hematology, Chinese Medical Association. Zhonghua Xue Ye Xue Za Zhi. 2020;41(7):537-544. doi:10.3760/cma.j.issn.0253-2727.2020.07.002
4.https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(20)30451-4/fulltext
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#和黄医药#
60
#遗传学#
60
#商业#
65
#医药#
46
#商业化#
41