百济神州宣布中国药监局接受zanubrutinib用于治疗复发/难治性套细胞淋巴瘤的新药申请
2018-08-27 百济神州 百济神州
百济神州创始人、首席执行官兼董事长欧雷强先生评论道:“我们对我们的团队感到自豪,同时也感谢中国的临床研究者及患者,是他们让zanubrutinib的首次监管申请成为可能。这是百济神州的第一个NDA,也是公司的一个重大里程碑。我们期待提交更多zanubrutinib以及在研抗PD-1抗体替雷利珠单抗的监管申请。” BCR/BTK信号通路 百济神州中国区总经理兼公司总裁吴晓滨博士表示:“基于z
百济神州创始人、首席执行官兼董事长欧雷强先生评论道:“我们对我们的团队感到自豪,同时也感谢中国的临床研究者及患者,是他们让zanubrutinib的首次监管申请成为可能。这是百济神州的第一个NDA,也是公司的一个重大里程碑。我们期待提交更多zanubrutinib以及在研抗PD-1抗体替雷利珠单抗的监管申请。”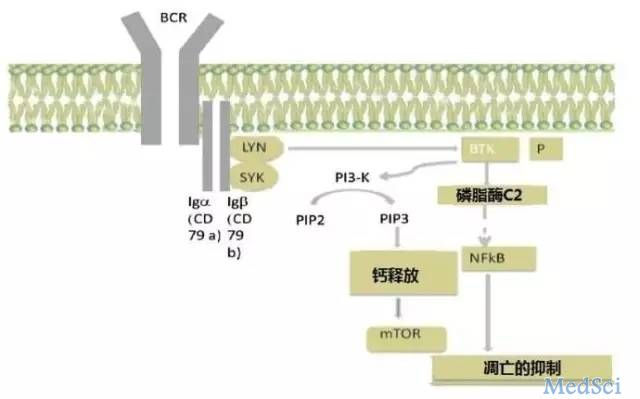
BCR/BTK信号通路
百济神州中国区总经理兼公司总裁吴晓滨博士表示:“基于zanubrutinib迄今在临床试验中观察到的缓解深度和持久度,我们相信zanubrutinib是一款具有潜在差异性的BTK抑制剂。我们希望zanubrutinib,如果获批,能作为中国MCL患者的一种有价值和重要的治疗选择。”
百济神州全球药政事务负责人闫小军补充道:“我们为CDA受理zanubrutinib用于治疗MCL患者的新药申请以及作为一类新药申请进行审理感到兴奋。这类新药申请专门针对第一次在中国进行全球监管评审的药物。我们期待与CDA在对zanubrutinib完成全面评估过程中合作。”
这项NDA是基于百济神州广泛的临床和非临床数据,包括针对86位复发或难治性中国MCL患者以每次160mg、每日两次剂量进行的单臂关键性2期临床试验结果。对这项试验疗效数据的独立评审结果显示总缓解率(ORR)为84%,包括59%的病人达到完全缓解。在中位随访时间为8.3个月的情况下,中位缓解持续时间尚未达到,因为研究中超过一半有缓解的患者仍对治疗有响应。安全性与先前公布的zanubrutinib临床数据一致。此项临床试验的完整数据计划在一场近期的医学会议上公布。
作为广泛的全球开发项目中的一部分,zanubrutinib目前正在多项临床试验中进行研究。Zanubrutinib最近也获得美国食品药品监督管理局(FDA)授予的快速通道资格,用于治疗华氏巨球蛋白血症(WM)患者。百济神州计划根据全球临床1期试验结果于2019年上半年向FDA提交zanubrutinib作为针对WM患者的潜在治疗方案的NDA。
除了全球临床1期试验外,zanubrutinib也在一项已完成病人入组的针对WM患者对比目前已获批治疗WM的BTK抑制剂伊布替尼的全球临床3期试验中进行评估。Zanubrutinib还在一项针对未经治疗的慢性淋巴细胞白血病(CLL)患者的全球临床3期试验,以及与GAZYVA®(奥比妥珠)联合治疗复发或难治性滤泡性淋巴瘤的关键性2期临床试验中进行评估。在中国,百济神州已经完成另外两项关键性2期临床试验的患者入组,分别用于治疗CLL和WM患者。百济神州正计划开展一项在复发/难治性CLL/小淋巴细胞淋巴瘤(SLL)患者中对比伊布替尼的临床3期试验。截至2018年8月,已有超过1500位患者入组zanubrutinib临床开发项目。
关于套细胞淋巴瘤
淋巴瘤是一组起源于B细胞、T细胞或NK细胞的多种恶性肿瘤。套细胞淋巴瘤(MCL)通常是侵袭性的非霍奇金淋巴瘤(NHL),起源于“套区”的B细胞。2013年,中国大陆的淋巴瘤在发病率为每10万人4.2例,死亡率为每10万人2.2例[i],在最常见癌症中排名第十一位,在癌症死亡主要原因中排名第十[ii]。套细胞淋巴瘤通常预后很差,中位生存期为三至四年,虽然偶尔患者病程呈惰性进展[iii]。套细胞淋巴瘤通常在疾病晚期被诊断发现。
[i] Chen W, Zheng R, Zhang S, Zeng H, Xia C, Zuo T, et al. Cancer incidence and mortality in China, 2013. Cancer Lett. 2017; 401:63–71
[ii] Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer Statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115–32
[iii] Philip J. Bierman, James O. Armitage, in Goldman's Cecil Medicine (Twenty Fourth Edition), 2012
关于zanubrutinib
Zanubrutinib(BGB-3111)是一款在研的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂,目前正在全球及中国进行广泛的关键性临床试验项目,作为单药和与其他疗法进行联合用药治疗多种淋巴瘤。
关于百济神州
百济神州是一家全球性的、商业阶段的、以研发为基础的生物科技公司,专注于分子靶向和免疫肿瘤疗法的研发。百济神州目前在中国大陆、美国、澳大利亚和瑞士拥有超过1300名员工,在研产品线包括新型口服小分子类和单克隆抗体类抗癌药物。百济神州目前也正在打造抗癌治疗的药物组合方案,旨在为癌症患者的生活带来持续、深远的影响。在新基公司的授权下,百济神州在华销售ABRAXANE®注射用紫杉醇(纳米白蛋白颗粒结合型)、瑞复美®(来那度胺胶囊)和维达莎®(注射用阿扎胞苷)[iv]。
[iv] ABRAXANE®、瑞复美®和维达莎®为新基医药公司的注册商标。
前瞻性声明
根据《1995年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)以及其他联邦证券法律要求,该新闻稿包含前瞻性声明,包括有关百济神州对zanubrutinib和tislelizumab相关的进展计划、预期的临床开发计划、药政注册里程碑等。由于各种重要因素的影响,实际结果可能与前瞻性声明有重大差异。这些因素包括了以下事项的风险:百济神州证明其候选药物功效和安全性的能力;候选药物的临床结果可能不支持进一步开发或上市审批;药政部门的行动可能会影响到临床试验的启动、时间表和进展以及产品上市审批;百济神州的上市产品及药物候选物(如能获批)获得商业成功的能力;百济神州对其技术和药物知识产权保护获得和维护的能力;百济神州依赖第三方进行药物开发、生产和其他服务的情况;百济神州有限的营运历史和获得进一步的营运资金以完成候选药物开发和商业化的能力;以及百济神州在最近季度报告的10-Q表格中“风险因素”章节里更全面讨论的各类风险;以及百济神州向美国证券交易委员会期后呈报中关于潜在风险、不确定性以及其他重要因素的讨论。本新闻稿中的所有信息仅及于新闻稿发布之日,除非法律要求,百济神州并无责任更新该些信息。
梅斯医学注:有关BTK抑制剂
依布替尼是全球最早上市的BTK抑制剂,2013年11月被FDA批准,目前已上市适应症包括慢性淋巴细胞白血病 、小淋巴细胞性淋巴瘤 、套细胞淋巴瘤 、Waldenström巨球蛋白血症。2018上半年,依布替尼的全球销售额为28.19亿美元。阿斯利康acalabrutinib 是全球第2个上市的BTK抑制剂。百济神州zanubrutinib有望成为全球第3个上市的BTK抑制剂。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#新药申请#
61
#细胞淋巴瘤#
75
#药监局#
84
#zanubrutinib#
84
#难治性#
73