2012年,基因编辑领域两大先驱Jennifer A. Doudna和Emmanulle Charpentier合作发布了基因编辑史上的里程碑论文,为世界带来了革命性的CRISPR-Cas9系统。8年来,这把“基因魔剪”以惊人的速度在农业、药物开发和医学等领域得到广泛应用,并衍生出一系列基因编辑工具,成为人类改写自然遗传密码的首选基因组编辑器。
然而,此类技术往往无法在高效替换DNA特定碱基的同时保证DNA双链不断裂,另外,脱靶效应也阻碍该技术在生命科学领域的进一步应用。
近日,基因编辑领域两位“宗师”David Liu及Jennifer A. Doudna合作,在《Science》首次揭开了一种“最有前途”的碱基编辑器的3D结构,为调整碱基编辑器、使之在应用过程中更加灵活和可控提供了路线图。
新版碱基编辑器“工作效率”提升1170倍
腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)和胸腺嘧啶(T)是DNA的基本构成单元,按照A-T、C-G的配对形式搭建起了DNA的双螺旋结构。
2016年,David Liu开发出首个单碱基编辑器,能够在不切割DNA的情况下,靶向并结合DNA,将C-G碱基对替换为T-A碱基对。一年后,该碱基编辑器得到进一步优化,可将A-T碱基对转换回G-C碱基对。在人类遗传病中,该技术有望纠正大约60%(超过15000种)的致病单碱基变异。
在DNA中没有脱氨基酶的情况下,大肠杆菌tRNA腺苷脱氨酶(TadA)能够与Cas9蛋白质融合进化成ABE7.10,催化脱氧腺苷的靶向脱氨。在此基础上,ABE7.10变体可被进一步改进成为截短版本的miniABEmax以及ABE8e,后者是最新版本的腺嘌呤碱基编辑器(ABE),能够编码单个TadA域(TadA-8e),并与八个测试的Cas效应器广泛兼容。
无论是ABE7.10还是miniABEmax,早期的腺嘌呤碱基编辑器(ABE)效率都很低。然而,最新的ABE8e却快到令人惊讶,对DNA的脱氨基速率比ABE7.10和miniABEmax分别高出590倍和1170倍。
活跃的脱氨酶蛋白是造成脱靶的“罪魁祸首”
尽管ABE8e能够在15分钟内完成近100%的预期基础编辑,但是这也意味着,ABE8e可能更容易针对无关的DNA片段进行编辑,造成脱靶效应。
为了解决这个问题,研究人员利用冷冻电子显微镜(Cryo-EM)成像技术,以3.2埃的分辨率解析了ABE8e结合DNA时的3D结构。其中,目标腺嘌呤被设计用来捕捉催化构象的模拟物所取代。
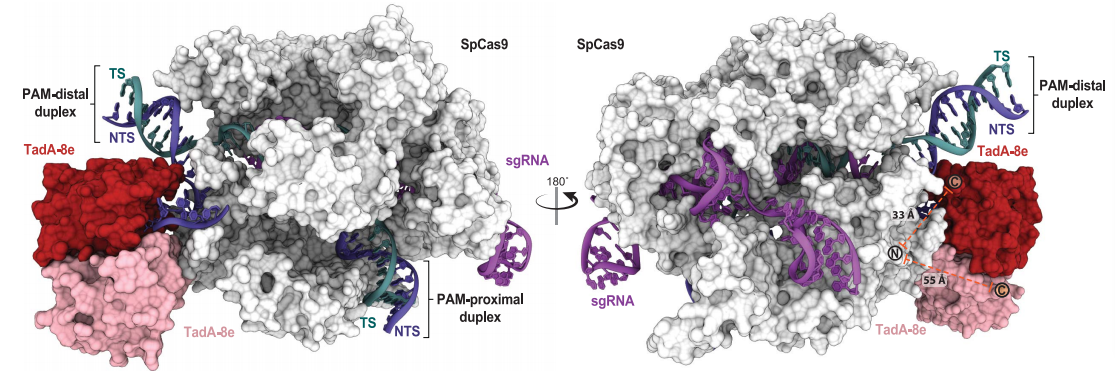
ABE8e捕获DNA时的Cryo-EM结构
研究人员观察到,ABE8e之所以具有更高的运行效率,是因为与此前版本的碱基编辑器相比,脱氨酶蛋白在两个点位上存在突变,这让蛋白质能够更紧密地抓取DNA,并更有效地将G替换为A。
该报告的共同第一作者、亚利桑那州立大学助理教授Audrone Lapinaite说:“这项研究让我们了解到,这一碱基编辑器实际上是以两个独立模块运行:一方面Cas9模块提供特异性,另一方面存在一个催化模块提供活性。这为我们提供了一种思考Cas9融合蛋白的方法,使我们知道了Cas9的哪个区域更适合融合其他蛋白。”
活性检测表明, ABE8e之所以容易产生更多的脱靶编辑,是因为与Cas9融合的脱氨酶蛋白始终处于活跃状态。在dCas9找到目标之前,会不断结合并释放成百上千个DNA片段。始终处于激活状态的脱氨酶就像一个失控的大炮,不等dCas9完全匹配到目标就已经对着碱基“开火”了。
加州大学伯克利分校的博士后研究员Gavin Knott博士说:“现在,我们不仅可以了解基因编辑器何时可以使用,什么时候不可以使用,还可以设计下一代基础编辑器,使它们更好,更适合临床。”
原始出处:
Audrone Lapinaite, et al. DNA capture by a CRISPR-Cas9–guided adenine base editor. Science 31 Jul 2020: Vol. 369, Issue 6503, pp. 566-571. DOI: 10.1126/science.abb1390.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#解析#
71
#CRISPR#
73
#SCIE#
71
机制研究离临床仍然有距离,不过与临床结合思考,仍然有帮助的,不能仅仅是纯临床思维,转化思维同样重要
96