Science:长非编码RNA MEG3可能是调控阿尔茨海默病神经元死亡关键靶点,为治疗AD提供新的希望
2023-09-24 Hanson临床科研 Hanson临床科研 发表于上海
说明MEG3可能具有广泛的调控效应。那么MEG3能否成为真正的AD靶点,就很难说了。至少MEG3并非是特异性靶向阿尔茨海默病神经元死亡。
阿尔茨海默病(AD)患者出现症状之前有一个漫长而无声的开始。
-
首先,斑块--粘性β-淀粉样蛋白团块--开始在大脑中聚集。
-
它们很快就会被称为小胶质细胞的免疫细胞包围,这些细胞试图蚕食它们,但最终失败了。
-
这些斑块的大小和数量不断增加,但数年甚至数十年都没有被注意到,直到它们导致另一种称为 tau的蛋白质积累到有毒水平并以缠结的形式散布在大脑周围。
-
最终神经元死亡。
尽管根据人类AD患者尸检结果,医学科学家给出了上述发病机制的推测,但作为探索AD干预手段的动物模型中却无法复制这一过程。
找到更接近人类AD大脑中发生机制的模型,将可能带来新的突破。
2023年9月15日,由多国/地区科学家联合完成发表于Science杂志的研究引起全球科学家的关注【1】。

研究者首先意识到,用了多年的动物模型无法模拟AD患者的三大标志性特征--淀粉样斑块、tau蛋白缠结和神经元死亡之间的关联。
制作新模型
所以,他们创建了一个新的模型,在AD小鼠模型的大脑中植入了健康的人类和小鼠神经元。
结果显示,人类神经元与人脑中的相应细胞一样退化,从而使研究者能够在大脑老化过程中研究它们,为AD的底层机制提供新的见解。
令人注目的是,只有人类神经元而非其啮齿类对应体现出了AD患者大脑中看到的特征,包括tau蛋白缠结和显著的神经元细胞损失。这暗示AD可能存在人类特异性因素,标准的小鼠模型无法复制这一点。
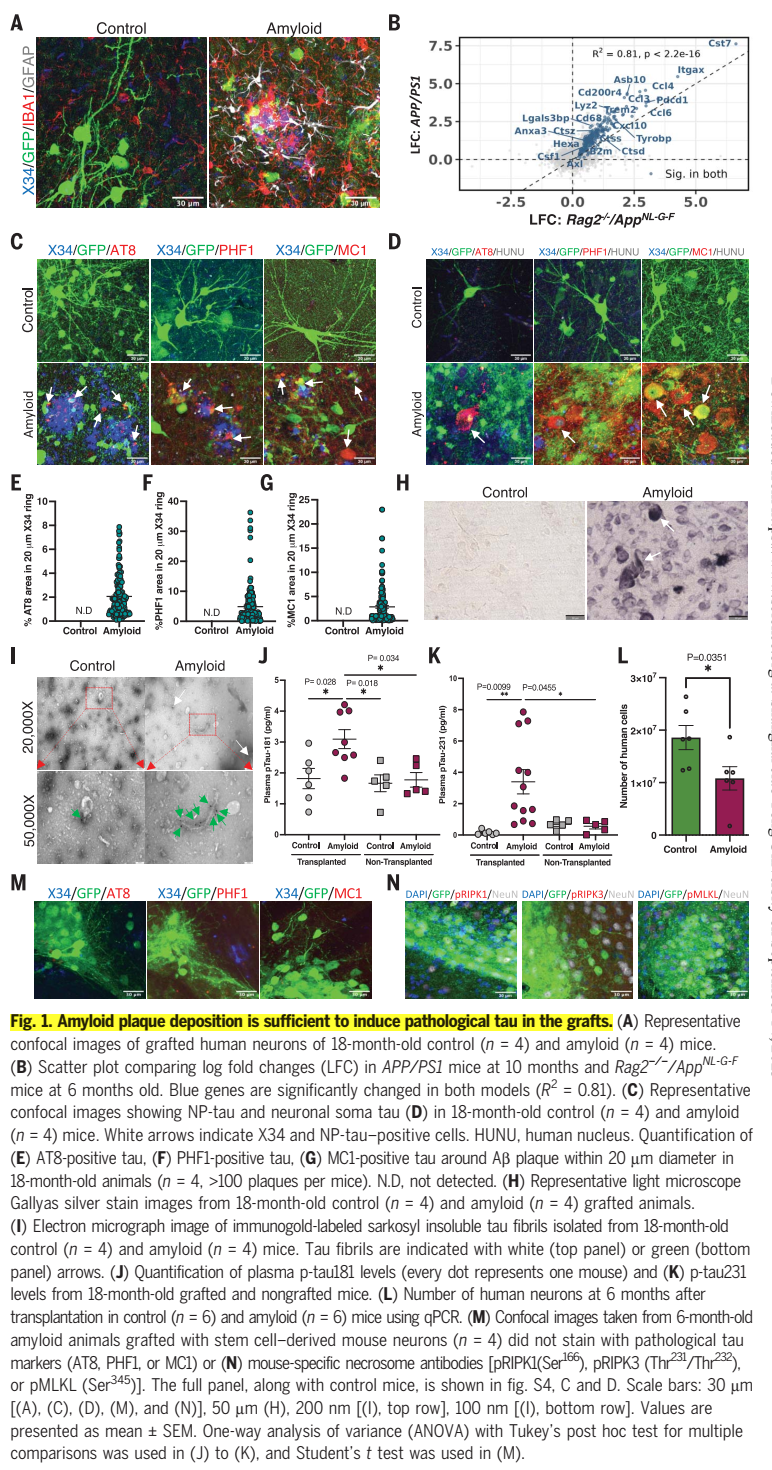
(新的模型成功了,为后续研究提供了最可靠的基石)
探寻导致大脑细胞损失的元凶
利用新模型,团队深入探究了A中神经元如何死亡。他们取得了关键的突破,发现了一条被称为神经的坏死性凋亡(necroptosis)的通路在模型中被激活,这是一种细胞程序性死亡形式,导致神经元死亡。
而且研究进一步发现,在人类神经元中,一个名为MEG3的分子水平显著增加,就像AD患者一样。
令人震惊的是,仅MEG3的存在就足以在实验室设置中触发人类神经元的necroptosis通路。
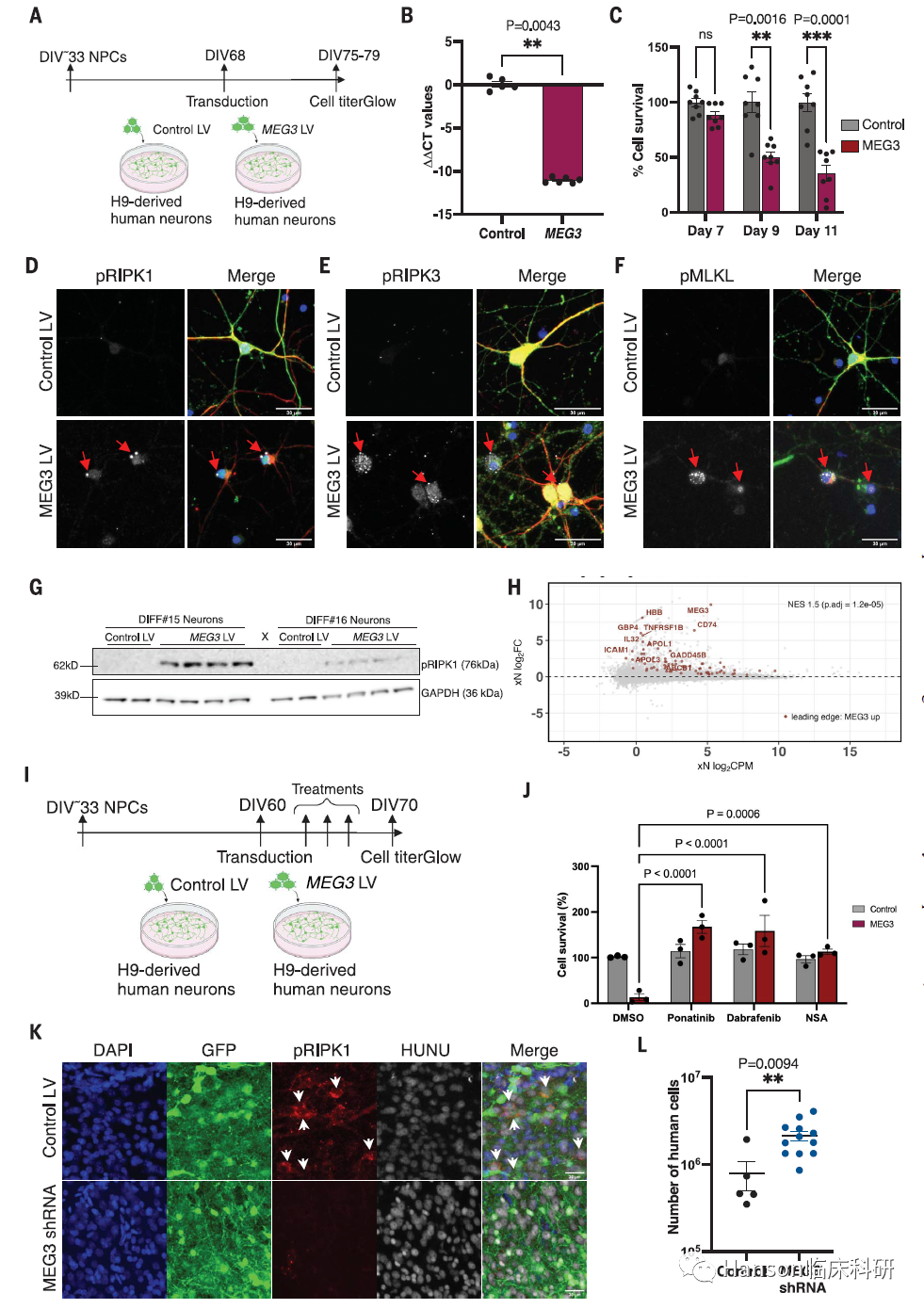
研究还发现,通过减少MEG3并阻止necroptosis,研究人员可以阻止细胞死亡。

编者按:
本研究的临床意义:
我们仍然需要更多的研究来理解MEG3是如何触发necroptosis的,但这一发现无疑是理解阿尔茨海默病如何导致大脑神经元损失的重要进展。
通过这项研究,科学家不仅开创了理解AD的新途径,而且为未来可能的疗法开辟了新的可能性。
研究的通讯作者De Strooper B指出:
“虽然还有很多需要探索的地方,但我们的发现为针对阿尔茨海默病的潜在疗法打开了有希望的道路,这将与传统的针对Aβ和tau的方法并行。”
本研究的科研启发:
-
这项研究之所以备受关注,是因为在动物模型的应用上做了突破,并由此会带动其他学者在阿尔茨海默病研究中的新进展。
-
其次,本研究也在AD发病中提出了necroptosis机制。
De Strooper也提示:“necroptosis已经是癌症和ALS药物开发的一个活跃领域。”,相互借鉴有助于新的突破。
关于MEG3
MEG3是一种印记基因,属于人类染色体14q32.3上的印记DLK1-MEG3位点。 在小鼠中,它被称为基因陷阱位点 2 (Gtl2),位于 12 号染色体的远端。 MEG3 是第一个被定义为肿瘤抑制基因的 lncRNA 基因,编码约 1.7 kb 的长非编码 RNA。 MEG3 有 10 个外显子和通过选择性剪接产生的大约 12 种不同亚型,其中一些亚型可能是组织或细胞类型特异性的。 MEG3 的所有 12 种亚型均带有共同的外显子 1-3 和 8-10,并且使用一个或多个外显子 4 至 7,中间有不同的组合。 在正常组织中,MEG3 在大脑和垂体中具有较高的表达水平,但垂体肿瘤和其他人类癌细胞系显示其表达缺失。 HeLa、MCF7 和 H4 癌细胞系中的异位 MEG3 表达抑制增殖。 MEG3 调节 p53 依赖性和非依赖性途径来抑制肿瘤生长。
此外,MEG3 与 p53 启动子的结合导致 p53 蛋白水平显着积累,从而诱导 p53 靶基因的表达。 在癌症中,MEG3 表达缺失与启动子高甲基化和基因缺失相关。 在神经胶质瘤和胃癌中使用去甲基化剂 5-Aza-CdR 治疗可逆转 MEG3 表达并调节 p53 水平以抑制细胞增殖。
此外,5-Aza-CdR 治疗可显着增加 MEG3 表达,从而负向调节 Wnt/β-catenin 通路,抑制视网膜母细胞瘤和神经胶质瘤的增殖。
另据报道,MEG3 通过降低丙酮酸激酶同工酶 M2 (PKM2) 来抑制细胞周期调节因子 cyclin D1、癌基因 C-Myc 和 β-catenin 活性,并增加肝癌中的 PTEN。 MEG3 通过下调 Bcl-2 表达、诱导 BAX 水平和 caspase-3 活性将前列腺癌细胞阻滞在 G0/G1 阶段,而宫颈癌细胞则通过 CDK1 途径将细胞周期阻滞在 G2/M 阶段。 MEG3 通过与富含 GA 序列的染色质结合来调节 TGF-β 调节基因。 MEG3是一种独特的lncRNA,通过RNA-DNA杂交体与同源基因组区域结合并调节靶基因表达,为开发新型治疗策略提供了新的机会之窗。
另外,MEG3还发现在大脑缺血,诸多肿瘤等中都起到作用,说明MEG3可能具有广泛的调控效应。那么MEG3能否成为真正的AD靶点,就很难说了。至少MEG3并非是特异性靶向阿尔茨海默病神经元死亡。
有关阿尔茨海默病神经元死亡的机制仍然路漫漫。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#MEG3#是一种#印记基因#,属于人类染色体14q32.3上的印记DLK1-MEG3位点。 在小鼠中,它被称为基因陷阱位点 2 (Gtl2),位于 12 号染色体的远端。 MEG3 是第一个被定义为肿瘤抑制基因的 lncRNA 基因,编码约 1.7 kb 的#长非编码 RNA#。 在正常组织中,MEG3 在大脑和垂体中具有较高的表达水平,但垂体肿瘤和其他人类癌细胞系显示其表达缺失。 HeLa、MCF7 和 H4 癌细胞系中的异位 MEG3 表达抑制增殖。 MEG3 调节 p53 依赖性和非依赖性途径来抑制#肿瘤#生长。 此外,MEG3 与 p53 启动子的结合导致 #p53# 蛋白水平显着积累,从而诱导 p53 靶基因的表达。 在#癌症#中,MEG3 表达缺失与启动子高#甲基化#和基因缺失相关。 在#神经胶质瘤#和#胃癌#中使用去甲基化剂 5-Aza-CdR 治疗可逆转 MEG3 表达并调节 p53 水平以抑制细胞增殖。 这里说能调节#阿尔茨海默病#神经元死亡(#程序性坏死#),有点难以相信。当然,p53确实与神经元死亡有关
128