Cell reports:科学家解析PKC精细结构为药物开发提供新靶点
2015-08-18 佚名 生物谷
蛋白激酶C(PKC)是通过磷酸化调节其他蛋白活性的一类蛋白激酶。这种简单的生化过程对于决定细胞存亡至关重要。如果PKC活性发生异常,会导致许多疾病的发生。在一项发表在国际学术期刊cell reports上的最新研究中,来自美国加州大学圣地亚哥分校的研究人员对PKC的精细结构进行了进一步解析,为调节PKC的活性提供了新的靶点。研究人员指出,通过理解PKC如何保持结构紧闭,我们可以寻找新的方法使其开放
蛋白激酶C(PKC)是通过磷酸化调节其他蛋白活性的一类蛋白激酶。这种简单的生化过程对于决定细胞存亡至关重要。如果PKC活性发生异常,会导致许多疾病的发生。
在一项发表在国际学术期刊cell reports上的最新研究中,来自美国加州大学圣地亚哥分校的研究人员对PKC的精细结构进行了进一步解析,为调节PKC的活性提供了新的靶点。
研究人员指出,通过理解PKC如何保持结构紧闭,我们可以寻找新的方法使其开放保持活性,如果可以做到这一点就可以促进肿瘤细胞死亡,这对于开发肿瘤治疗策略非常重要。除此之外,如何在神经退行性疾病中保持神经元存活也需要对PKC的结构有深入了解。
在之前的一项研究中,另一个研究小组解析了PKC的大部分结构并对PKC不同结构如何聚集在一起进行了出色的推测,但事实表明这一发现与PKC的工作机制并不能很好匹配。
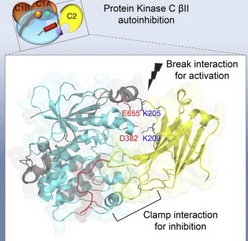
在这项研究中,研究人员利用X线晶体照相技术进行了结构分析,在此基础上进行进一步推测,对PKC的不同部分如何结合在一起进行了深入分析。最终得出一个与之前不同的PKC结构,并利用一种复杂的细胞成像技术对PKC的不同部分是否能够恰当整合在一起进行了检测。
结果表明PKC的钙离子结合结构域能够与自身尾巴以及催化结构域发生相互作用,锁定酶的活性,使其保持失活状态。当钙离子与PKC结合,钙离子结合结构域与细胞膜搭桥,PKC就会激活发挥酶的催化活性。
综上所述,这项研究利用结构生物学的方法对PKC的结构进行了精细解析,这对于开发小分子药物开启或关闭PKC的活性用于治疗多种疾病具有重要意义。
原文出处:
Corina E. Antal1, Julia A et al.Intramolecular C2 Domain-Mediated Autoinhibition of Protein Kinase C βII.cell reports.2015
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Cell#
30
#CEL#
53
#解析#
51
#新靶点#
42
#药物开发#
39