Nature Nanotechnology:类器官中形态发生素的空间-时间控制:纳米DNA微珠开启精准生物工程新时代
2024-09-11 生物探索 生物探索 发表于上海
该研究展示了DNA微珠技术的广泛适应性及其在推动类器官更接近体内组织仿生方面的潜力。
引言
类器官(Organoids)是近年来在基础研究和个性化医疗中迅速发展的体外模型系统,它们可以模拟体内组织的某些特征。然而,尽管类器官在多种器官系统中的应用不断增加,但由于缺乏精确的生化信号调控,它们在成熟度和功能性上仍与真实组织存在差距。为了解决这一问题,9月9日Nature Nanotechnology的研究报道“DNA microbeads for spatio-temporally controlled morphogen release within organoids”,提出了一种利用纳米工程化的DNA微珠(DNA microbeads)来实现类器官内部形态发生素(Morphogen)梯度的空间-时间精确控制。通过在鱼类胚胎和视网膜类器官(retinal organoids, RO)中引入DNA微珠,并结合可非侵入性光照解构技术,该方法成功实现了视网膜色素上皮(retinal pigmented epithelium, RPE)的形成,同时保持了神经视网膜细胞类型的多样性。
视网膜类器官特别适用于这种研究,因为它们可以在小型鱼类如青鳉鱼(Medaka)中快速发育,且能够通过简单的基因改造获得转基因报告系统。尽管这些类器官能够在一定程度上模拟体内视网膜的发育过程,但其细胞类型的多样性和空间组织结构仍不完全与体内一致。传统的方法,如利用微流控设备或水凝胶中的生化信号,难以在类器官内部实现精确的形态发生素梯度。该研究通过将可调节刚度的DNA微珠微注射至类器官中,实现在发育的任何阶段内生成可控的形态发生素梯度,从而为类器官的组织发育提供精确的生化信号。这一技术不仅可以提高类器官的复杂性,还为其他组织类器官系统的组织仿生提供了新途径。
通过这种方式,该研究展示了DNA微珠技术的广泛适应性及其在推动类器官更接近体内组织仿生方面的潜力。

类器官(organoids)是近年来在生物医学领域中崭露头角的体外模型系统,它们通过三维培养技术模拟器官发育过程。这一技术为研究人类发育、生物学机制及疾病模型提供了新的平台。然而,类器官的应用在很大程度上受限于其发育复杂性和功能性的不足。为了能够更好地模拟体内组织,研究人员亟需能够在类器官内实现精确的生化信号调控的方法。
传统的类器官培养技术往往缺乏对于形态发生素(morphogen)浓度梯度的精确调控。形态发生素是决定细胞命运和组织模式形成的重要信号分子,它们通过空间梯度和时间变化影响细胞行为。在体内组织中,形态发生素的浓度和时空分布受到严格控制,而在体外类器官系统中,现有的方法无法实现类似的精度和复杂性。因此,该研究提出了一种基于纳米工程化DNA微珠的策略,旨在通过光控技术(light-triggered technology)实现对形态发生素的可控释放,克服现有类器官模型的局限。
研究人员设计了一种纳米工程化的DNA微珠,能够携带形态发生素,并通过紫外线照射触发形态发生素的释放。这些DNA微珠通过微注射技术被引入类器官内部,在不同的发育阶段中提供局部的生化信号。DNA微珠的硬度可以根据实验需求进行调整,从而适应类器官内不同环境的力学需求。
在视网膜类器官(retinal organoids, RO)实验中,研究人员成功将DNA微珠注射到类器官中,并通过紫外线触发形态发生素的释放,形成了自类器官内部向外的浓度梯度。通过这一技术,研究人员能够在不破坏类器官结构的情况下,精确地控制形态发生素的分布,进而调控细胞分化和组织模式的形成。
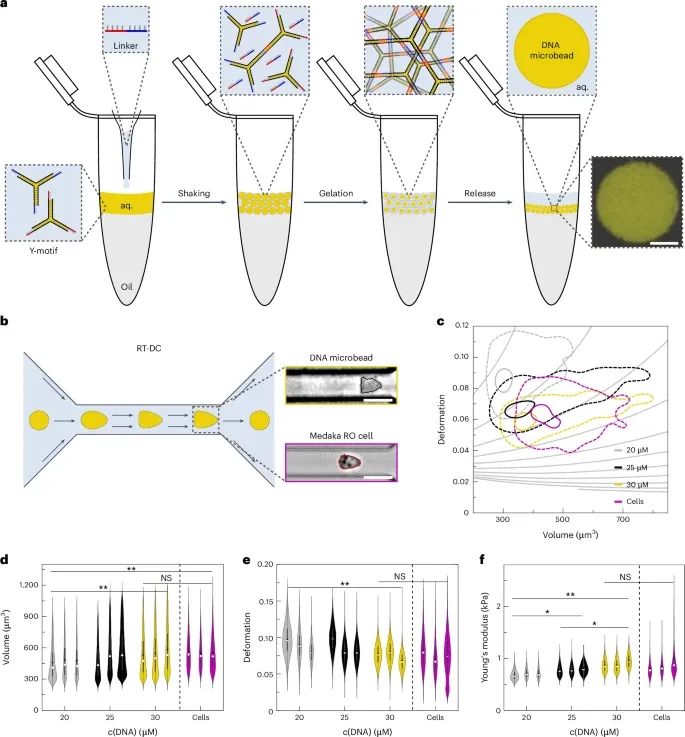
DNA微珠的生产过程及其与视网膜类器官(RO)细胞刚度相适应的结果(Credit: Nature Nanotechnology)
研究人员首先设计了DNA微珠的生产工艺,这些微珠通过自组装形成DNA水凝胶,并能够在不需要复杂设备的情况下通过简单操作生成。图a展示了DNA微珠的生产流程,包括水油乳化后通过自组装形成DNA微珠的步骤,并通过共聚焦显微镜验证了微珠的结构。
图b显示了DNA微珠的刚度与视网膜类器官细胞的匹配过程。研究人员使用实时变形细胞计量法(RT-DC)来分析DNA微珠和RO细胞的力学性质。实验结果表明,通过调整DNA结构中的Y-模体浓度,可以调节微珠的刚度,最终发现30µM的DNA微珠与RO细胞在体积和变形率上非常相似。
图c-f进一步展示了不同浓度的DNA微珠的体积、变形率和杨氏模量(Young's modulus)与RO细胞的对比。结果显示,当Y-模体浓度为30µM时,DNA微珠与RO细胞的刚度几乎完全一致。这表明,DNA微珠在力学性能上能够很好地与类器官细胞匹配,使其在后续的实验中具备了进行微注射的适用性。
DNA微珠的设计与应用
在该研究中,研究团队首先制备了具有可调硬度的DNA微珠,这些微珠通过DNA序列的自组装形成,能够承载形态发生素等生物分子。为了实现形态发生素的精确释放,研究人员将光敏化合物引入DNA微珠结构中,使其在紫外线照射下分解并释放携带的形态发生素。在视网膜类器官的培养实验中,研究人员通过光控技术触发形态发生素的释放,并通过荧光标记追踪其在类器官中的扩散路径和梯度形成。
研究表明,形态发生素在类器官中的扩散并非均匀分布,而是呈现出与体内组织类似的梯度特性。这一发现为未来类器官研究中更复杂的组织结构模拟提供了新的思路。
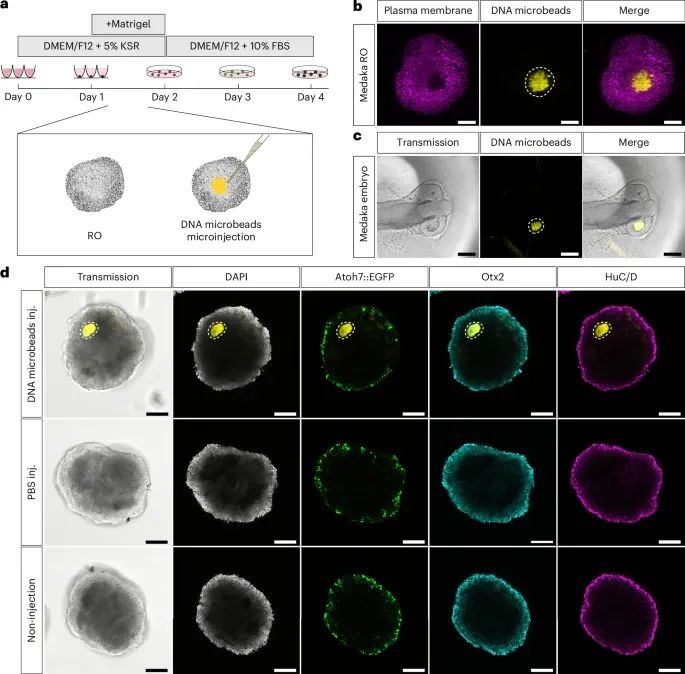
DNA微珠在体外和体内青鳉鱼(medaka)视网膜中的递送和整合情况(Credit: Nature Nanotechnology)
研究人员通过微注射技术将DNA微珠引入发育中的视网膜类器官(RO)和青鳉鱼胚胎的视网膜中,并评估了这些微珠在组织中的整合和稳定性。
图a描述了实验流程,展示了视网膜类器官的生成过程以及在第1天晚期将DNA微珠微注射到类器官中的时间点。
图b使用光片荧光显微镜观察到,注射后的DNA微珠能够无缝整合到类器官的组织环境中,并且在培养基和其他条件变化下依然保持稳定。
图c进一步展示了DNA微珠在青鳉鱼胚胎视网膜中的整合,显示出在发育中的青鳉鱼胚胎中,DNA微珠能够稳定存在并随着视网膜的发育逐渐降解。
图d展示了微注射后的视网膜类器官在第4天的细胞类型分布。使用抗体染色方法,研究人员确认DNA微珠的存在并未影响视网膜类器官中常见的分化视网膜细胞类型的正常分布和发育模式。这表明,DNA微珠的注射和整合不会对类器官的正常发育产生显著影响。
在实验过程中,研究人员利用小型视网膜类器官模型进行了详细的时间分辨荧光显微成像实验,观察了Wnt替代物(Wnt-surrogate)的扩散过程。结果表明,Wnt替代物的扩散速度显著慢于对照组的荧光标记分子,且呈现局部聚集的特点。研究发现,当DNA微珠在类器官内靠近边缘位置时,Wnt替代物的扩散仅限于类器官的一侧,进一步证明了该技术能够实现空间上的精确控制。
此外,研究团队还通过数学建模模拟了Wnt替代物在类器官中的扩散和降解过程。模型结果与实验观测数据高度吻合,表明Wnt替代物的扩散动力学可以通过DNA微珠技术精确控制。这一成果为将来在类器官系统中进行精确生化信号调控提供了理论支持和技术基础。
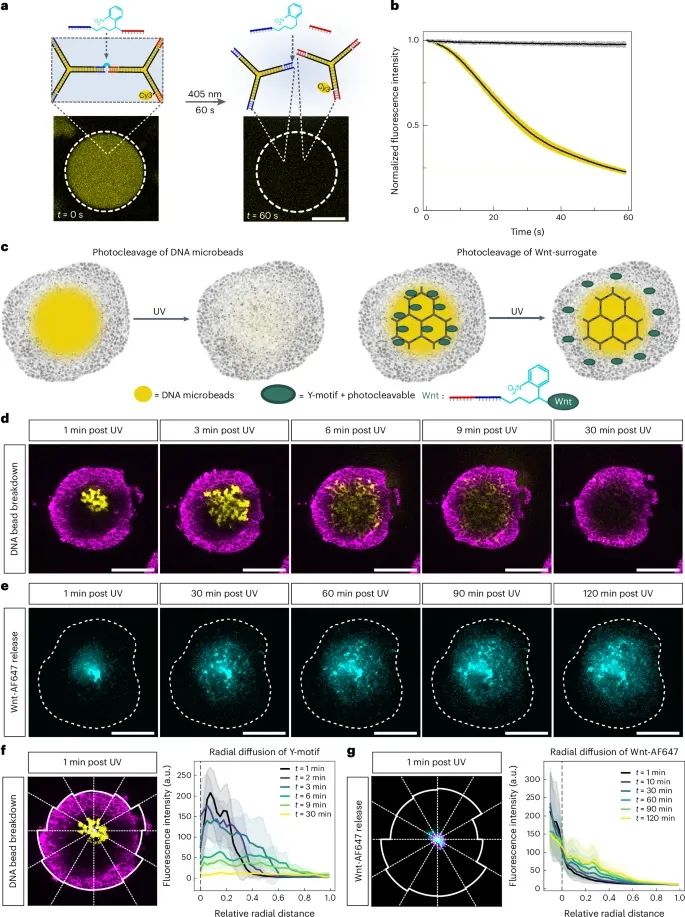
通过光照非侵入性地移除视网膜类器官(RO)中的DNA微珠,同时实现从类器官内部向外部释放Wnt替代物(Wnt-surrogate)以形成浓度梯度(Credit: Nature Nanotechnology)
图a显示了包含光敏解离基团(photocleavable group)的DNA微珠结构,通过405 nm的光照可以快速引发微珠的分解。实验结果显示,经过60秒的紫外光照,DNA微珠的荧光信号显著减弱,表明微珠已经被成功分解。
图b进一步量化了这一过程,展示了不同时间点DNA微珠的荧光强度变化,证明了光照能够有效触发DNA微珠的分解。
图c展示了DNA微珠的设计,说明光照不仅可以分解微珠,还可以控制Wnt替代物的释放。通过光照触发,Wnt替代物从DNA微珠中释放,而微珠本身不立即分解。这一过程被应用于视网膜类器官中。
图d和e分别展示了DNA微珠的分解过程以及Wnt替代物的释放过程。结果显示,Wnt替代物以从类器官内部向外部扩散的方式形成了浓度梯度,而DNA微珠则在光照后迅速分解。
图f和g量化了Wnt替代物和DNA微珠的扩散模式。实验结果表明,Wnt替代物在类器官中呈现出局部扩散的特点,形成了从内向外的梯度,而DNA微珠则表现出更均匀的扩散。这一现象证明了通过光控释放Wnt替代物,研究人员能够在类器官内部实现精确的空间调控,进而影响细胞的分化和组织模式的形成。
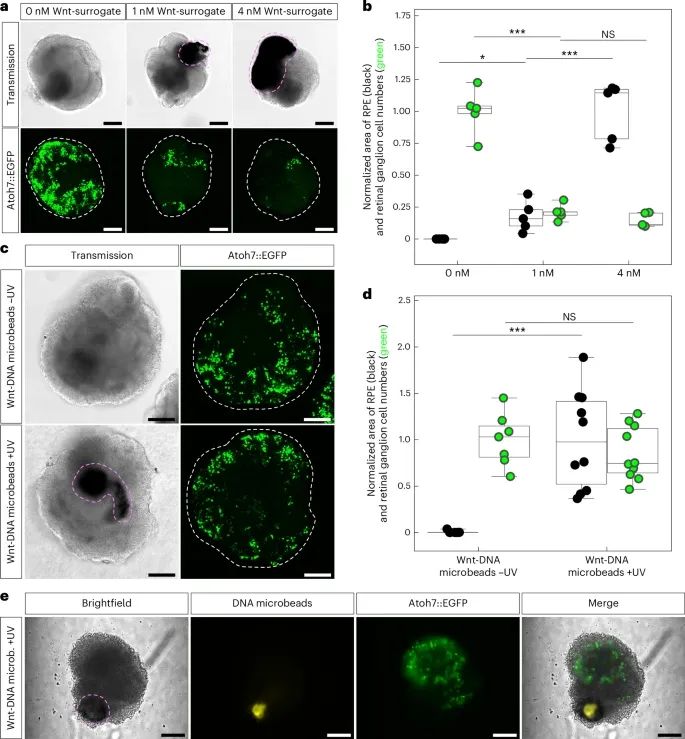
通过DNA微珠控制Wnt替代物(Wnt-surrogate)的释放,能够在类器官(RO)内部形成梯度,从而促使类器官发育出更加接近体内视网膜的细胞类型多样性(Credit: Nature Nanotechnology)
图a显示了不同浓度的Wnt替代物在视网膜类器官培养过程中对视网膜色素上皮(RPE)和视网膜神经节细胞的影响。结果表明,当在培养基中添加1 nM或4 nM的Wnt替代物时,类器官中的RPE区域明显增大,但同时神经节细胞数量减少,这意味着外源性Wnt替代物会抑制神经视网膜的分化。
图b对这一结果进行了量化,显示随着Wnt替代物浓度的增加,RPE的面积增加,而视网膜神经节细胞数量则减少。
图c展示了通过微注射DNA微珠并在类器官内部触发Wnt替代物的释放后,能够诱导RPE的形成,同时不抑制神经节细胞的分化。这与在培养基中直接添加Wnt替代物的方法形成对比,后者会导致外层细胞更多暴露于Wnt替代物,从而抑制神经细胞的分化。
图d对实验进行了量化,表明通过微珠释放的Wnt替代物可以在保持神经视网膜细胞类型的同时,局部诱导RPE形成。
图e展示了Wnt替代物的局部释放对类器官一侧的影响,表明该技术可以实现对特定区域的精确控制,使RPE只在DNA微珠附近形成。这一结果证明了通过DNA微珠技术,研究人员可以在类器官内部实现形态发生素的局部释放,从而促进更加接近体内组织的细胞类型多样性。
DNA微珠技术的潜在应用
该研究不仅证明了DNA微珠技术在类器官内实现形态发生素精确释放的可行性,还展示了这一技术在其他组织类器官中的广泛应用潜力。例如,研究人员设计了可以双重释放货物的DNA微珠,通过加入胆固醇基团(cholesterol group),使得在形态发生素释放的同时DNA微珠也能够被移除。这一技术的可扩展性为类器官系统中更多复杂分子的递送提供了新的可能。
DNA微珠技术还具有跨学科应用的潜力。例如,在神经类器官(如大脑类器官)或其他复杂组织中,利用该技术可以模拟更多精细的组织模式,并有望应用于疾病模型的建立和个性化医疗研究。此外,该技术的光控释放机制为体外系统中的动态调控提供了新的手段,可以更好地模拟体内组织在不同时间点的发育变化。
随着类器官模型在疾病研究和药物筛选中的广泛应用,如何提高其功能性和结构复杂性成为了当前研究的重点。DNA微珠技术通过在类器官中实现形态发生素的空间-时间梯度控制,为类器官模型的发展提供了一个全新的工具。这一技术不仅能够提高类器官的生物仿真度,还为未来个性化医疗中的类器官应用打下了坚实的基础。
总结而言,该研究展示了DNA微珠技术在类器官中的广泛应用潜力,为类器官内复杂信号通路的研究提供了新的可能性。通过这一技术,研究人员可以更好地模拟体内组织的发育过程,推动类器官模型在基础研究和临床应用中的进一步发展。
参考文献
Afting C, Walther T, Drozdowski OM, Schlagheck C, Schwarz US, Wittbrodt J, Göpfrich K. DNA microbeads for spatio-temporally controlled morphogen release within organoids. Nat Nanotechnol. 2024 Sep 9. doi: 10.1038/s41565-024-01779-y. Epub ahead of print. PMID: 39251862.
https://www.nature.com/articles/s41565-024-01779-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#类器官# #DNA微珠技术#
80