张力:2019年肺癌免疫治疗年终盘点
2020-01-05 方文峰,张力 肿瘤综合治疗电子杂志
方文峰,张力(中山大学肿瘤防治中心 内科,广州 510060) 【摘要】 免疫治疗的蓬勃发展为驱动基因阴性的患者带来了希望,肺癌的治疗格局正在经历革命性变革。笔者通过梳理2019年肺癌免疫治疗的研究报道,总结为下述6方面:①长生存:驱动基因阴性的非小细胞肺癌患者接受免疫单药二线治疗的5年生存率约为15%,一线治疗的5年生存率为23.2%,其中高表达程序性死亡蛋白配
方文峰,张力(中山大学肿瘤防治中心 内科,广州 510060)
【摘要】 免疫治疗的蓬勃发展为驱动基因阴性的患者带来了希望,肺癌的治疗格局正在经历革命性变革。笔者通过梳理2019年肺癌免疫治疗的研究报道,总结为下述6方面:①长生存:驱动基因阴性的非小细胞肺癌患者接受免疫单药二线治疗的5年生存率约为15%,一线治疗的5年生存率为23.2%,其中高表达程序性死亡蛋白配体1(PD-L1)的患者5年生存率可达29.6%。②去化疗:帕博利珠单抗和阿特珠单抗为PD-L1高表达患者带来去化疗的机会,而纳武利尤单抗联合伊匹单抗为PD-L1阳性患者带来了去化疗的机会。③中国人群:KEYNOTE-042研究和KEYNOTE-407研究的中国人群数据证明了中国人群的疗效和安全性与全球数据一致,并且HR数值上优于全球数据。④中国研究:信迪利单抗和卡瑞利珠单抗等中国声音正在逐渐改变着中国肺癌患者的治疗格局。⑤早期拓展:免疫治疗向早期的拓展为更多患者争取治愈的机会。⑥精准化:PD-L1是目前唯一获批的伴随诊断标志物,肿瘤突变负荷的分析仍是“雾里看花”,如何更精准地筛选出优势人群是未来研究的方向。
【关键词】 免疫治疗;长生存;去化疗;中国人群;中国研究;早期拓展;精准化
肺癌是全球死亡率最高的癌症,每年约160万人死于肺癌[1]。在中国,肺癌也是最常见且严重威胁人类健康的恶性肿瘤,据最新数据统计,中国肺癌粗发病率为57.26/10万,死亡率为45.87/10万[2]。过去十年间,随着科学技术的不断进步,肺癌的治疗正在朝着精准化的方向发展。而随着免疫治疗研究的不断深入,以及越来越多的程序性死亡蛋白1(programmed cell death protein 1,PD-1)/程序性死亡蛋白配体1(programmed death-ligand 1,PD-L1)抑制剂在中国获批上市,肺癌的治疗格局正在经历革命性的变革,越来越多的患者看到了长期生存的希望。2019年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)、世界肺癌大会(World Conference on Lung Cancer,WCLC)、中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)、欧洲临床肿瘤协会(European Society for Medical Oncology,ESMO)肺癌领域的大会相继结束,大会针对肺癌领域均有不同角度的亮点报告,笔者采用长生存、去化疗、中国人群、中国研究、早期拓展、精准化这六个关键词总结了目前免疫治疗呈现的特点,为大家梳理了2019年肺癌免疫治疗的进展
1 长生存肿瘤治疗的目的即为延长生存期,提高患者生活质量。因此,长生存一直都是肿瘤科医生致力于追求的目标。
CheckMate 017/057是第一项报道PD-1抑制剂在经治晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)中5年总生存(overall survival,OS)的3期研究。2019年WCLC报道了CheckMate 017/057研究的联合分析数据[3],结果显示纳武利尤单抗较多西他赛5年OS率增加4倍以上(13%∶3%)。纳武利尤单抗未出现新的毒性,耐受性良好。这与2018年美国癌症研究协会(Americ an Association for Cancer Research,AACR)报道的纳武利尤单抗在1期研究中的5年OS率数据接近。
除了Nivolumab带来了5年OS率的数据外,2019年ASCO报道的KEYNOTE-001研究[4]同时分析了帕博利珠单抗对于初/经治局部晚期或转移性NSCLC患者的疗效与安全性。在免疫治疗(immunotherapy,IO)之前,根据美国国立癌症研究所“监测、流行病学和结果数据库”(Surveillance Epidemiology and End Results,SEER)显示经治NSCLC患者的5年OS率仅为4.9%,而KEYNOTE-001研究显示经治NSCLC患者经帕博利珠单抗单药治疗后5年OS率达到15.5%,这与2017年AACR报道的CM003研究的5年OS率(16%)接近,可以认为二线接受免疫治疗单药的患者5年OS率为传统化疗方案的3倍。而KEYNOTE-001研究中初治晚期NSCLC患者经免疫治疗后5年OS率达到23.2%,其中PD-L1肿瘤比例评分(tumor proportion score,TPS)≥50%的患者5年OS率达到29.6%,接近1/3的晚期NSCLC PD-L1高表达的患者一线接受免疫治疗后OS可超过5年,这一结果是令人振奋的,且在长期随访中未发现新发的远期毒性,安全性好。
免疫联合化疗虽然没有长达5年的随访时间,但越来越多的3期临床研究会进行PFS2的分析来探索crossover对OS的影响和一线治疗对二线治疗的影响。2019 ASCO报道的KEYNOTE-189研究的PFS2结果显示:帕博利珠单抗联合化疗组对比化疗组中位PFS2分别为17个月(95%CI:15.1~19.4)和9个月(95%CI:7.6~10.4),中位PFS延长了8个月,HR为0.49(95%CI:0.40~0.59),降低了50%的进展风险[5]。2019 ESMO报道的KEYNOTE-407研究在报道最终分析的同时也进行了PFS2的分析,结果显示:帕博利珠单抗联合化疗组对比化疗组中位PFS2分别为13.8个月(95%CI:12.2~15.9)和9.1个月(95%CI:8.2~10.2),中位PFS延长了4.7个月,HR为0.59(95%CI:0.49~0.72),降低了40%的进展风险[6]。两项研究结果提示即使允许crossover,一线使用免疫联合化疗对比化疗仍然能够为患者带来显著获益,且对二线治疗可能具有促进作用。
2 去化疗临床医生不仅希望延长患者生存时间,同时还希望提高患者生存质量。免疫治疗给患者提供了“chemo-free”的机会。
2019年欧洲肺癌大会(European Lung Cancer Congress,ELCC)年会上Mork等[7]带来了KEYNOTE-042研究的最终分析,在PD-L1 TPS≥1%的晚期NSCLC患者中,比较了一线帕博利珠单抗单药疗法和化疗的疗效。研究的主要终点为PD-L1 TPS≥50%、≥20%和≥1%患者的OS。截至2018年9月4日,在TPS≥50%患者中,帕博利珠单抗单药组和化疗组患者的OS具有显著差异,中位OS分别为20.0个月和12.2个月(HR=0.70,95%CI:0.58~0.86);在TPS≥20%患者中,两组OS比较差异仍具有统计学意义,中位OS分别为18.0个月和13.0个月(HR=0.77,95%CI:0.65~0.91);在TPS≥1%患者中,两组OS比较差异仍具有统计学意义,中位OS分别为16.4个月和12.1个月(HR=0.82,95%CI:0.71~0.93)。在探索性亚组分析中,TPS 1%~49%患者中两组OS相似,帕博利珠单抗单药组和化疗组患者的中位OS分别为13.4个月和12.1个月(HR=0.82,95%CI:0.77~1.09)。
自2016年KEYNOTE-024研究结果公布后,3年间除KEYNOTE系列再无免疫单药研究的阳性结果公布,因此,2019年EMSO报道的IMpower 110研究(LBA78)一经公布即引发热议。IMpower 110研究[8]是一项3期、开放标签的随机对照研究,比较阿特珠单抗单药对比铂类(顺铂或卡铂)联合培美曲塞或吉西他滨用于治疗经PD-L1筛选的初治Ⅳ期NSCLC患者,此次报道的是中期OS分析。结果显示,对于高表达的TC3/IC3患者,阿特珠单抗单药一线治疗较标准化疗有显著的OS获益(20.2个月∶13.1个月,HR=0.82,95%CI:0.40~0.89)。此次中期分析TC2/3或IC2/3 WT和TC1/2/3或IC1/2/3 WT组的OS未达到统计学预设,后续将对这部分患者进行最终的OS分析。综合而言,阿特珠单抗为PD-L1高表达的NSCLC患者提供了新的一线治疗选择。
除免疫单药的进展外,2019 ESMO公布了双免疫CheckMate227 part1的最终结果[9],研究达到主要研究终点,PD-L1≥1%的患者,纳武利尤单抗+伊匹单抗对比化疗的中位OS分别为17.1个月和14.9个月,HR=0.79,P=0.007。次要研究终点:PD-L1<1%的患者,纳武利尤单抗+伊匹单抗、纳武利尤单抗+化疗、化疗的中位OS分别为17.2个月、15.2个月、12.2个月。因此,对于PD-L1表达阳性的患者,除已经获批的免疫联合化疗的方案外,患者似乎有了去化疗的可能性。
靶向治疗的进展使临床医生意识到人种的差异可能是治疗效果产生差异的原因。对于免疫治疗而言,中国人群的获益是否与全球研究保持一致一直是大家关注的问题。而大型3期研究——KEYNOTE-042和KEYNOTE-407研究也先后报道了其中国人群的数据。
KEYNOTE-042研究中国人群数据[10]共纳入262例患者(全球研究92例、中国拓展研究170例),主要是为了评估中国人群的疗效和全球数据的一致性。疗效分析结果汇总见表1,KEYNOTE-042研究中国人群的疗效和安全性结果于全球数据一致,相较含铂化疗方案,帕博利珠单抗一线治疗初治局部晚期期或转移性NSCLC,在所有的PD-L1 TPS分组中(PD-L1 TPS ≥50%,≥20%和≥1%)均可改善OS。这些结果均支持帕博利珠单抗在PD-L1有表达(TPS≥1%)的局部晚期或转移性中国NSCLC患者中一线单药使用。
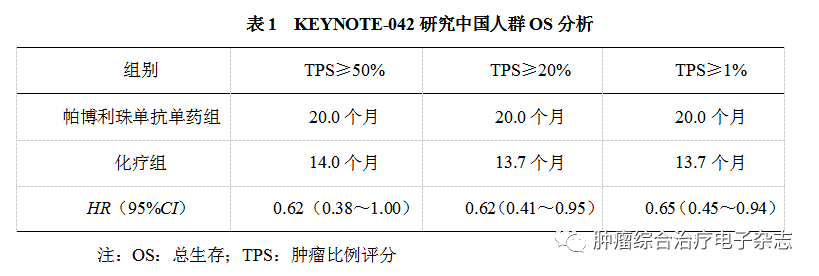
KEYNOTE-407中国扩展研究[11]评价了包括参加全球研究的中国患者(15例)和中国扩展队列(110例)的治疗结果。中国患者的疗效和安全性结局与KEYNOTE-407全球研究的相应结果一致,在未接受治疗的中国晚期鳞状NSCLC患者中,帕博利珠单抗联合化疗相对于单纯化疗改善了OS(17.3个月∶12.6个月,HR=0.44),PFS(8.3个月∶4.2个月,HR=0.32)和缓解率。研究结果支持将帕博利珠单抗联合卡铂/紫杉醇化疗作为中国未接受治疗的晚期鳞状NSCLC患者的一项新的标准治疗选择。
4 中国研究中国不再满足于参与全球研究,越来越多的由中国发起的全球研究来解决临床未被解答的问题,在世界舞台上展示了中国声音。2019年WCLC有2项中国报道的国产PD-1抑制剂的临床研究引人关注。
一项是韩宝惠教授报道的信迪利单抗联合安罗替尼一线治疗晚期NSCLC的多队列1期研究[12],主要研究终点是客观反应率(objective response rate,ORR)和安全性。结果显示:22例患者中,ORR为72.7%,疾病控制率(disease control rate,DCR)为100%。6个月PFS率为93.8%,且安全性可。未来期待进一步的大型确证性研究进一步证实该方案的疗效。
另一项是周彩存教授报道的卡瑞利珠单抗联合化疗一线治疗人类表皮生长因子受体(human epidermal growth factor receptor,EGFR)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阴性晚期非鳞NSCLC患者的随机3期研究[13]。研究设计与KEYNOTE-189研究较为相似,化疗方案同样选择了卡铂+培美曲塞。主要研究终点是:处于盲态的独立影像学委员会(blinded, independent central radiology review,BICR)评估的意向性治疗(intention to treat,ITT)人群和PD-L1阳性人群的PFS。研究达到了重要研究终点,BICR评估的ITT人群的中位PFS分别为11.3个月∶8.3个月,HR=0.61(0.46~0.80),P=0.0002。PD-L1阳性人群的中位PFS分别为15.2个月∶9.9个月,HR=0.58(0.40~0.85),P=0.0023。次要研究终点OS:NR∶20.9月(P=0.0272),ORR:60.0%∶39.1%(P<0.0001)。
虽然信迪利单抗和卡瑞利珠单抗尚未在中国获批肺癌适应证,但是越来越多的中国声音正在逐渐改变着中国肺癌患者的治疗格局。
5 早期拓展越来越多的研究数据和临床实践表明:免疫治疗一线使用较二线使用好,体力状态好的患者使用免疫治疗获益更明显。2018年PACIFIC研究将大家的视线从晚期或转移性NSCLC带到了局部晚期患者,而研究的脚步一路向前探索,2019年ASCO/WCLC/ESMO年会先后就新辅助/辅助的几项研究进行了数据更新。
根据图1中汇总的免疫新辅助治疗研究的结果来看,免疫新辅助疗法具有很好的主要病理缓解(major pathologic response,MPR),虽然MPR不是经验证的终点,但可加速药物批准。MPR率结果表明免疫治疗+化疗是最有潜力的治疗方案。免疫新辅助治疗的临床应用仍然有许多未知方面,如免疫治疗时机、新辅助治疗周期、免疫治疗持续时间等,确定个性化新辅助治疗的最佳生物标志物需要更多的研究。
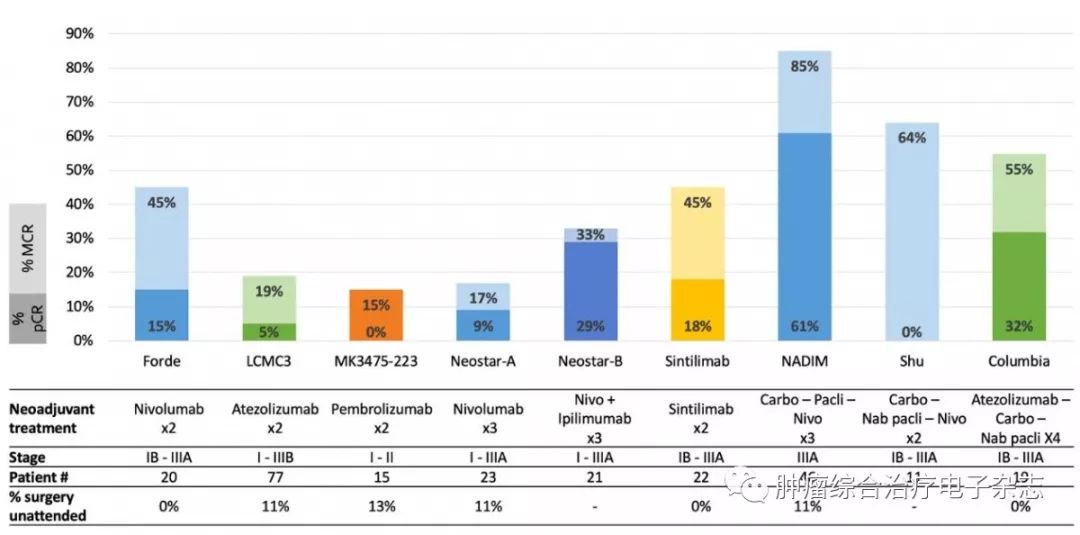
图1 新辅助免疫治疗的研究汇总[14]
值得期待的是已有4项大型Ⅲ期新辅助免疫治疗的临床研究正在进行中(表2),均为免疫联合化疗方案,我们期待这些数据的发布可以更好地指导临床实践。
表2 新辅助免疫治疗正在进行的Ⅲ期临床研究
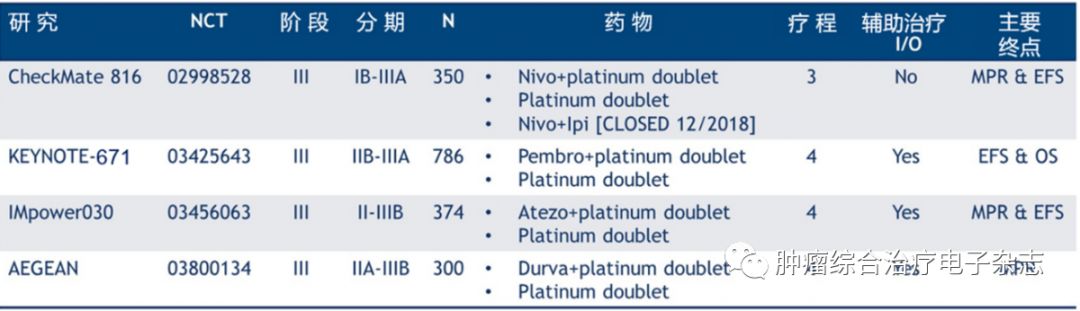
注:MPR:主要病理缓解;EFS:无事件生存期:OS:总生存;数据来源于https://clinicaltrials.gov/
6 精准化虽然免疫治疗不断有新的数据、新的药物涌现,但如何更精准地筛选获益人群一直是等待解决的问题,如前面提及的二线治疗15%的5年OS率有什么特征?如何在免疫治疗初期就筛选出这部分患者?如何预测耐药和免疫相关不良反应(immune-related adverse event,irAE)?
PD-L1虽然并非完美的生物标志物,但其是目前唯一获批的伴随诊断标志物。对于PD-L1的分析也更聚焦于不同表达水平的人群:对于PD-L1阴性人群,2019年WCLC报道了KN021G、KN189、KN407的合并分析[15],结果显示:在PD-L1表达阴性的既往未经治疗的晚期NSCLC患者中,与化疗相比,Pembrolizumab联合化疗在OS(HR=0.56)、PFS(HR=0.67)和ORR方面使患者有更多的临床获益。对PD-L1高表达人群,分析了EGFR-TKIs与程序性死亡蛋白1(programmed cell death protein 1,PD-1)抑制剂在该亚组患者中的疗效:即使在PD-L1高表达人群中,EGFR突变的人群对PD-1抑制剂的疗效仍有劣于EGFR野生型患者的趋势。在EGFR突变型患者中,PD-L1高表达者可从PD-1抑制剂中获益,而PD-L1低表达者未显示出临床获益。无论PD-L1表达情况,EGFR-TKIs在EGFR突变型患者中疗效并无显著差异。尽管PD-L1≥50%,但仍有相当一部分NSCLC患者无法从免疫检查点抑制剂(immune-checkpoint inhibitor,ICI)治疗中受益。2019年WCLC报道了一项研究,血浆microRNA分级(microRNA signature classifier,MSC)可以预测接受免疫治疗的PD-L1≥50%的NSCLC患者的原发性和继发性耐药[16],也是目前唯一能够识别出在PD-L1≥50%进展期NSCLC患者中对ICI无反应的生物标志物。
虽然肿瘤突变负荷(tumor mutation burden,TMB)尚未正式获批作为预测免疫疗效的伴随诊断,但是并未停止对于TMB与疗效相关性的探索。KEYNOTE-021、189、407研究的合并分析[1,17-19]提示:帕博利珠单抗联合含铂化疗一线治疗转移性NSCLC,组织TMB(tissue tumor mutation burden,tTMB)的临床应用价值可能有限。而KEYNOTE-010、042研究的合并分析[21,7]提示:帕博利珠单抗单药治疗PD-L1阳性晚期NSCLC患者,tTMB可能会对疗效预判有所帮助[6,21]。当然这些数据均来自临床研究的亚组分析,未来仍需大型前瞻性研究进一步验证这些结论。
免疫治疗能够使部分患者实现长生存,能够使部分患者免受化疗的不良反应,越来越多中国人群的数据和中国自主研发的药物在世界舞台发声,并且不断向早期拓展,向精准化发展,正在逐步改变和重塑NSCLC治疗的新格局。当然仍有一些问题等待进一步解答:如何精准筛选获益人群?能否预测耐药和irAE?如何通过新联合策略来提高疗效?我们期待未来免疫治疗能够解答这些问题,为更多的患者带来生的希望。
参考文献
[1]Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer[J]. New Engl J Med, 2018, 378(22):2078-2092.
[2]Chen W, Zheng R, Zeng H, et al. Epidemiology of lung cancer in China[J]. Thorac Cancer, 2015, 6(2):209-215.
[3]Borghaei H GS. Expanding the Therapeutic Landscape of Advanced NSCLC Targeting HER2[C]. Barcelona, World Conference on Lung Cancer, 2019.
[4]Garon E, Hellmann M, Carcereny E, et al. Five-year long-term overall survival for patients with advanced NSCLC treated with pembrolizumab: Results from KEYNOTE-001[J]. J Clin Oncol, 2019, 37:LBA9015-LBA9015.
[5]Gadgeel S. KEYNOTE-189: Updated OS and progression after the next line of therapy (PFS2) with pembrolizumab (pembro) plus chemo with pemetrexed and platinum vs placebo plus chemo for metastatic nonsquamous NSCLC[C]. Chicago, American Society of Clinical Oncology, 2019.
[6]Paz-Ares L, Vicente D, Tafreshi A, et al. Pembrolizumab (pembro)+chemotherapy (chemo) in metastatic squamous NSCLC: Final analysis and progression after the next line of therapy (PFS2) in KEYNOTE-407[J]. Ann Oncol, 2019, 30 Supplment_5:918-919.
[7]Mork T S K, Wu YL, Kudaba I, et al. Final analysis of the phase Ⅲ KEYNOTE-042 study: Pembrolizumab (Pembro) versus platinum-based chemotherapy (Chemo) as first-line therapy for patients (Pts) with PD-L1-positive locally advanced/metastatic NSCLC[J]. Ann Oncol, 2019, 30 (Supplement 2):ii38-ii68.
[8]Spigel D dMF. IMpower110: Interim overall survival (OS) analysis of a phase III study of atezolizumab (atezo) vs platinum-based chemotherapy (chemo) as first-line (1L) treatment (tx) in PD-L1-selected NSCLC[C]. Barcelona, European Lung Cancer Congress, 2019.
[9]Peters S. Nivolumab (nivo)+low-dose ipilimumab (ipi) vs platinum-doublet chemotherapy (chemo) asfirst-line (1L) treatment (tx) for advanced non-small cell lung cancer (NSCLC): CheckMate-227 part 1 final analysis[J]. Ann Oncol, 2019. [Epub ahead of print]
[10]Wu YL, Zhang L, Fan Y, et al. KEYNOTE-042 China study:first-line pembrolizumab vs chemotherapy in Chinese patients with advanced NSCLC with PD-L1 TPS≥1%[C]. Barcelona, World Conference on Lung Cancer, 2019.
[11]Cheng Y, Zhang L, Hu J, et al. Keynote-407 China Extension study: Pembrolizumab (pembro) plus chemotherapy in Chinese patients with metastatic squamous NSCLC[J/OL]. Ann Oncol, 2019, 30 Supplment_9. [2019-12-23]. https://academic.oup.com/annonc/article-abstract/30/Supplement_9/mdz446.019/5638842?redirectedFrom=fulltext.
[12]Han B. Efficacy and Safety of Sintilimab with Anlotinib as First-line Therapy for Advanced Non-small Cell Lung Cancer (NSCLC)[J]. Barcelona, World Conference on Lung Cancer, 2019.
[13]Zhou C. A Randomized Phase 3 Study of Camrelizumab plus Chemotherapy as 1-st Line Therapy for Advaced Non-Squamous Non-Small Cell Lung Cancer with negative EGFR and ALK[J]. Barcelona, World Conference on Lung Cancer, 2019.
[14]Forde PM, Chaft JE, Smith KN, et al. Neoadjuvant PD-1 Blockade in Resectable Lung Cancer[J]. N Engl J Med, 2018, 378(21):1976-1986.
[15]Borghaei H. Pembrolizumab Plus Chemotherapy For Advanced NSCLC Without Tumor PD-L1 Expression: Pooled Analysis of KN021G, KN189 and KN407[C]. Barcelona, World Conference on Lung Cancer, 2019.
[16]Fortunato O, Borzi C, Milione M, et al. Circulating mir-320a promotes immunosuppressive macrophages M2 phenotype associated with lung cancer risk[J]. J Int J Cancer, 2018, 144(11):2746-2761.
[17]Gadgeel SM, Stevenson JP, Langer CJ, et al. Pembrolizumab and platinum-based chemotherapy as first-line therapy for advanced non–small-cell lung cancer: Phase 1 cohorts from the KEYNOTE-021 study[J]. Lung Cancer, 2018, 125:273-281.
[18]Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: A randomised, phase 2 cohort of the open-label KEYNOTE-021 study[J]. Lancet Oncol, 2016, 17(11):1497-1508.
[19]Borghaei H, Langer CJ, Gadgeel S, et al. 24-Month Overall Survival from KEYNOTE-021 Cohort G: Pemetrexed and Carboplatin with or without Pembrolizumab as First-Line Therapy for Advanced Nonsquamous Non-Small Cell Lung Cancer[J]. J Thoracic Oncol, 2019, 14(1):124-129.
[20]Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial[J]. Lancet, 2016, 387(10027):1540-1550.
[21]Paz-Ares L, Luft A, Tafreshi A, et al. Phase 3 study of carboplatin-paclitaxel/nab-paclitaxel (Chemo) with or without pembrolizumab (Pembro) for patients (Pts) with metastatic squamous (Sq) non-small cell lung cancer (NSCLC)[J]. J Clin Oncol, 2018, 36:105.

张力教授
-
中山大学附属肿瘤医院内科主任,博导,肺癌首席专家
-
中国抗癌协会肿瘤康复与姑息治疗专业委员会候任主任委员
-
中国抗癌协会临床试验专业委员会副主任委员
-
中国临床肿瘤学会常务理事
-
中国临床肿瘤学会免疫治疗专家委员会候任主任委员
-
广东省抗癌协会肿瘤化疗专业委员会主任委员
-
广东省抗癌协会肺癌专业委员会副主任委员
-
广东省医学领军人才、“特支计划”杰出人才(南粤百杰)
-
国家重点研发计划“精准医学研究”肺癌的诊疗规范及应用方案的精准化研究项目负责人
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#张力#
44
#年终盘点#
64