STTT:暨南大学李晓江等团队发现Tau蛋白病促进脊髓依赖性产生有毒的β淀粉样蛋白
2023-09-24 iNature iNature 发表于上海
该研究首次证明了Tau蛋白病可以触发灵长类脊髓中的Aβ病理,并为Tau蛋白病的发病机制和治疗提供了新的见解。
Tau蛋白病以微管相关蛋白Tau的过度磷酸化和积累以及Aβ低聚物的积累为特征,构成了阿尔茨海默病的主要病理标志。然而,这两种病理变化在神经退行性疾病中的关系和因果作用仍有待确定,即使它们在几种与认知和运动障碍相关的神经退行性疾病中共同或独立发生。
2023年9月22日,暨南大学李晓江、Tu Zhuchi及Yan Sen共同通讯在Signal Transduction and Targeted Therapy在线发表题为“Tauopathy promotes spinal cord-dependent production of toxic amyloid-beta in transgenic monkeys”的研究论文,该研究发现在转基因猴子中,Tau蛋白病促进脊髓依赖性产生有毒的β淀粉样蛋白。该研究通过慢病毒感染猴子胚胎,建立了表达Tau (P301L)的转基因食蟹猴模型。这些猴子出现了年龄依赖性神经变性和运动功能障碍。此外,对成年猴和小鼠的大脑进行立体定向注射,通过AAV9感染表达Tau (P301L)。
重要的是,该研究发现胚胎转基因Tau表达或立体定向脑注射AAV-Tau导致的Tau病变选择性地促进了猴脊髓中Aβ低聚物的产生。这些Aβ低聚物被几种Aβ1-42抗体识别,并导致神经退行性变。然而,在Tau转基因猴子的其他脑区或注射AAV9-Tau (P301L)的小鼠脑中未观察到Aβ低聚物的产生,这表明Aβ低聚物的产生是物种和脑区域依赖的。该研究首次证明了Tau蛋白病可以触发灵长类脊髓中的Aβ病理,并为Tau蛋白病的发病机制和治疗提供了新的见解。

微管相关蛋白Tau由MAPT基因编码,在神经元轴突中高表达,参与轴突的微管组装和功能。在多种神经退行性疾病,包括阿尔茨海默病(AD)、进行性核上性麻痹(PSP)、皮质基底变性(CBD)、嗜银性谷物病(AGD)、皮克病(PD)以及遗传性额颞叶痴呆(FTDs)的大脑中,Tau蛋白的病理或遗传改变导致其过度磷酸化和细胞内积聚形成神经原纤维缠结(NFTs)。因此,人类Tau蛋白病变是一组异质性疾病的病理标志,这些疾病表现出从运动障碍到痴呆等不同的神经表型。
阿尔茨海默病的神经病理特征是Tau病变和由β-淀粉样蛋白(Aβ)聚集体组成的细胞外斑块。这两种病理标志的发展与临床疾病的严重程度密切相关,人们普遍认为Aβ积累导致疾病晚期的Tau病变。然而,长期以来人们也认识到Tau的消耗对Aβ介导的缺陷具有保护作用。尽管有这些有趣的发现,但Tau蛋白病是否可以作为触发Aβ相关神经病理的主要原因仍有待研究。
动物模型对于研究Tau蛋白病的发病机制至关重要。FTD中MAPT基因突变的发现,为建立转基因动物模型阐明Tau在神经退行性变中的作用带来了巨大的努力。转基因Tau动物模型,特别是啮齿类动物模型,显著地概括了Tau病,并为Tau病相关疾病的发病机制提供了重要的见解。然而,Tau蛋白在人脑中通过选择性剪接表达,导致6个含有3个重复(3r)或4个重复(4r)的亚型,而在成年啮齿动物大脑中只有4r Tau蛋白表达。众所周知,脑损伤也发生在非人类灵长类动物的老年大脑中,但在老年小动物(包括啮齿动物)的大脑中不存在。
灵长类动物的大脑,随着神经元数量的增加和大脑皮层的扩大,拥有更复杂的神经结构来决定认知能力。这些差异也会影响神经退行性疾病研究中使用的动物模型的病理和行为表型。不同动物物种的衰老过程也有很大差异。例如,啮齿动物的寿命通常不到3年,这可能不足以发生神经变性或其他重要的病理变化,而这些变化通常需要几十年才能在人类中发展。小动物的快速发育和加速衰老可能使它们的大脑或神经元细胞不易受到有毒蛋白质的影响,导致尽管存在大脑功能受损,但缺乏强大的神经退行性变。
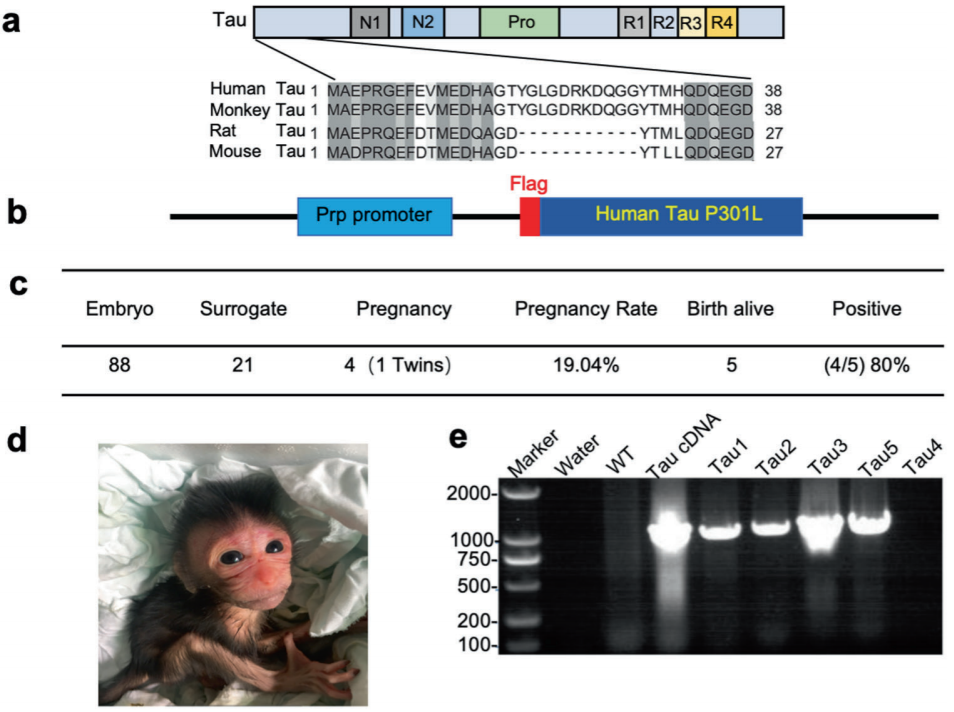
Tau- p301l转基因(Tau)猴的产生(图源自Signal Transduction and Targeted Therapy)
因此,利用非人类灵长类动物来研究人类Tau蛋白及其相关病理的作用是合乎逻辑和重要的,因为它们与人类大脑的结构和功能更相似。在早期研究中,作者采用CRISPR/Cas9靶向方法来产生转基因猴子,目的是模拟重要的脑部疾病。研究结果表明,猴子模型更准确地复制了在患者大脑中观察到的神经病理,并提供了可能无法从小动物身上获得的疾病发病机制的有价值的见解。例如,PINK1基因突变的猴子会导致帕金森病的早期发作,表现出神经变性,而PINK1基因敲除的小鼠则不会表现出这种变性。同样,CHD8基因突变的猴子表现出异常的胶质细胞生成,而这种现象在突变小鼠模型中是不存在的。CHD8基因是导致人类自闭症行为和大头畸形的原因。这些发现为使用非人类灵长类动物作为研究与AD相关的神经病理学和发病机制的基本模型提供了令人信服的证据。
该研究建立了非人类灵长类动物模型,通过胚胎慢病毒转导和AAV立体定向脑注射表达突变的人类Tau P301L (0N4R P301L)。该研究发现突变的Tau引发神经退行性变,并伴有典型的Tau病和运动功能缺陷。此外,转基因Tau选择性地促进Tau转基因猴和注射AAV-Tau (P301L)的成年猴脊髓中毒性Aβ低聚物的产生。该研究首次证明了Tau可以以脑区域依赖的方式引起内源性毒性Aβ的形成,并为Tau如何参与AD相关发病机制提供了致病的见解。
原文链接:
https://www.nature.com/articles/s41392-023-01601-6
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#tau蛋白病#以#微管相关蛋白#Tau的过度#磷酸化#和积累以及Aβ低聚物的积累为特征,构成了#阿尔茨海默病#的主要病理标志
84