衰老癌症模型的挑战和机遇
2024-10-26 小药说药 小药说药 发表于上海
本文强调癌症与衰老密切相关,指出当前癌症模型未充分考虑衰老影响,阐述需考虑的衰老特征及构建模型方向,如模拟突变、免疫衰老等,以改善老年癌症患者预后及开发治疗策略。
前言
年龄是癌症的主要危险因素之一,大多数癌症病例是在65岁以上的人群中诊断出来的,60%的新癌症诊断病例和70%的癌症死亡病例都发生在这一人群中。任何针对成年人的癌症研究都面临着组织和生物体老化的问题。
然而,目前的癌症的临床前研究大多是利用幼年动物进行的。因此,他们不能直接解决衰老对癌症发生、发展、异质性和治疗反应的各个方面的影响。65岁以上患者在临床试验中的代表性不足也说明了衰老与癌症研究之间的脱节。这是一个问题,因为老年人表现出可能影响药物疗效和毒性的合并症,而这些合并症在年轻人中无法完全体现。因此,在很大一部分癌症患者中,与肿瘤发生、治疗效果和耐药性相关的关键问题尚未完全解决。因此,构建和验证新的癌症模型,对于加速临床前发现和转化是非常必要的。
癌症模型开发中需要考虑的衰老特征
衰老是一个复杂的生物和生理过程,伴随着组织和器官系统的细胞和分子成分的显著变化。因此,模型系统的选择应取决于人们希望获得的衰老方面,例如生物学衰老、免疫衰老(局部与全身)、炎症、或微环境的衰老和老化。
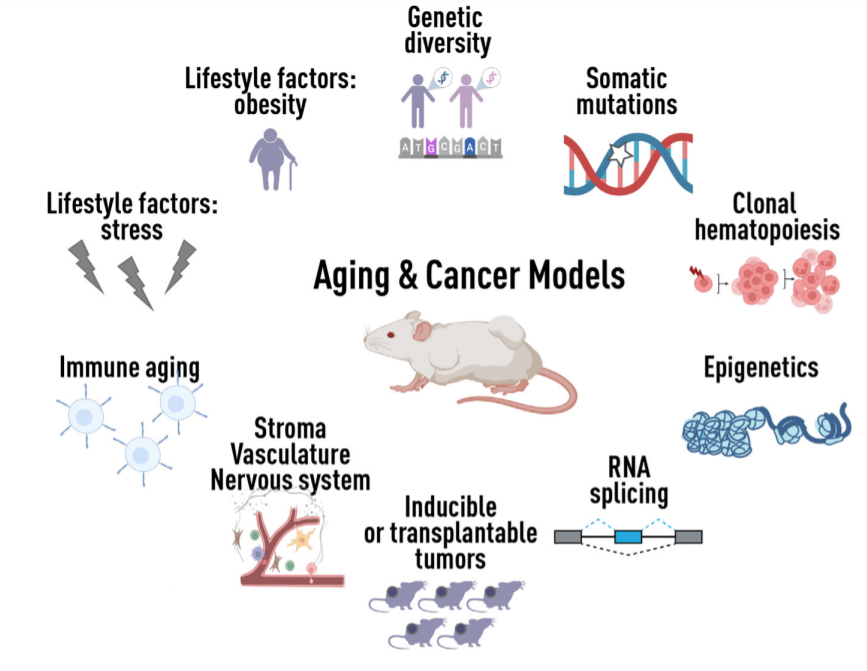
在细胞水平上,衰老的特征是线粒体功能障碍和代谢程序改变。在分子水平上,衰老组织表现出基因组变化,包括体细胞突变的积累,以及表观遗传学、转录和转录后重塑。在系统水平上,衰老通常伴随着认知功能障碍、肌肉和骨骼损失、激素和内分泌水平的功能变化、免疫功能障碍,以及慢性炎症。
衰老在癌症中的复杂作用需要在模型系统的背景下仔细解剖。众所周知,衰老诱导的远端转移微环境的变化促进休眠癌症细胞的有效活化。一个基本的未决问题是,衰老的这些生物学特征如何影响癌症起始、进展和治疗反应。此外,这些特征及其引发的衰老疾病并不是孤立存在的,而是结合存在的,它们可以相互影响,并且可以在个体内部和个体之间表现出异质性。
体内模型的设计不仅需要了解年龄的影响,还需要了解生物性别、激素信号、遗传遗传背景、免疫状态、饮食、身体活动、接触传染源、环境和炎症的影响。此外,需要更好地结合癌症患者中检测到的其他与衰老相关的共病可能产生的加性或协同效应。
模拟突变和基因改变
衰老的癌症模型应该使我们能够剖析哪些细胞和分子成分对癌症起源细胞、启动的癌前细胞的适合性以及肿瘤进展和转移的机制影响最大。大多数小鼠肿瘤模型,包括一些发现关键致癌基因或肿瘤抑制因子(如Trp53、Brca1、Her2)的经典模型,并不能准确反映或概括老年人或肿瘤发生的遗传多样性人群的细胞或分子环境。建立诱导模型,以组织特异性的方式激活老年动物的致癌基因或灭活肿瘤抑制因子,将能够监测这些变化是如何随着年龄改变上皮细胞、免疫系统和基质成分的。
衰老的癌症模型还应包含体细胞突变,体细胞突变会在生物体的生命周期内累积,并可能影响宿主的功能。这种现象最好通过克隆造血来说明,突变克隆具有适应性优势,有助于产生相当大比例的成熟血细胞。参与表观遗传调控的基因突变(DNMT3A、TET2、ASXL1)占人类突变驱动的克隆造血的大部分。这些突变在年轻人中很罕见,但在老年人中非常普遍,在70岁以上的人群中,有10%-20%的人拥有相当大的克隆。克隆性造血已被证明通过诱导额外的协同致白血病驱动因子突变,在体内转化为急性髓细胞白血病。即使在没有白血病转化的情况下,克隆性造血对髓细胞的影响也可能导致组织中的髓细胞功能障碍。
最后,多项研究描述了在表型正常的人类组织中,具有突变的细胞随着年龄的增长而积累,这些突变通常被归类为致癌细胞,其中一些甚至从出生起就存在。然而,这些往往不足以单独驱动肿瘤的发生。因此,需要能够测量携带肿瘤相关突变的细胞适应度的衰老相关变化的模型。
模拟免疫衰老
随着年龄的增长,免疫系统的下降反映在对传染病的易感性增加,对疫苗接种的反应较差,以及癌症、自身免疫性疾病和其他慢性病的发病率增加。衰老与先天免疫和适应性免疫的显著变化有关。例如,造血向骨髓生成倾斜,而淋巴生成随着年龄的增长而减少。在外周,T细胞经历了与年龄相关的主要变化,包括由于胸腺退化导致的幼稚T细胞减少,以及终末分化记忆T细胞和耗竭T细胞数量的增加。在髓细胞中也观察到类似的表型和功能改变,包括树突状细胞和巨噬细胞。
在一些常用于癌症研究的小鼠品系中也观察到了与年龄相关的免疫群体的类似变化。因此,依赖年轻近交系动物的癌症模型不能正确反映老年患者肿瘤发生的免疫微环境,但一些小鼠品系可能适合研究“免疫年龄”。事实上,人类和小鼠都不需要是老年人才能表现出免疫衰老表型。使用老年小鼠可能会混淆癌症研究的结果,而老年小鼠的发病率与小鼠寿命末期的发病率有关,从而需要开发由特定问题驱动的新模型。
此外,目前许多衰老癌症小鼠模型的另一个关键局限性是,它们被保存在无菌条件下,不会暴露于诸如饮食、致癌物、病毒、细菌或在人类一生中刺激免疫系统的疫苗等外部诱因。长期暴露于促炎性环境因素是加速衰老和癌症发展的一种可能机制。这一概念可以在小鼠模型中进行严格测试,例如,通过接种疫苗或暴露于炎症来慢性激活免疫系统。
模拟治疗反应
衰老癌症模型对于剖析衰老如何影响对不同癌症治疗的反应,以及确定治疗药物或其组合对老年动物更有效,并与减少副作用相关,将具有很高的价值。例如,虽然大多数癌症患者仍在接受化疗,但对老年患者的剂量、药代动力学和药效学仍知之甚少,因为大多数化合物在年轻患者的临床试验中进行测试。同样,免疫疗法对老年免疫系统患者的疗效仍不清楚。
此外,有必要对不同年龄段的疾病进行定义。例如,最近对人类癌症的分子特征分析表明,一些成人癌症在年轻人和老年人中看起来有很大的不同,例如三阴性乳腺癌。另一个例子是,年轻人与老年人黑色素瘤患者对VEGF靶向治疗的反应存在差异,后者几乎没有什么益处。不同癌症类型对治疗的年龄分层反应似乎不同,因此,测试年龄分层治疗的癌症模型将非常有用,并且具有临床相关性。
模拟宿主遗传多样性
衰老癌症模型另一个主要的挑战是如何在基因相同的近交系小鼠中稳健地模拟与年龄相关的癌症生物学复杂性和异质性。癌症是一种严重依赖遗传学的现象,在癌症研究中,衰老的生物复杂性将进一步需要人们解决模型系统中的遗传多样性问题。
杂交老鼠多样性组(HMDP)是一个强大的平台,可以模拟人类遗传多样性,并确定个体遗传变异如何导致衰老和癌症的复杂性。通过使用在肿瘤易感性方面表现出广泛表型变异的衰老、遗传多样性协作交叉(CC)/多样性远系(DO)小鼠,我们可能会对遗传背景如何影响衰老相关的细胞过程有新的见解,并有可能确定小鼠和人类之间的共同生化途径。例如,在一项研究中,DO小鼠可用于各种组织的表型、表观遗传学和转录组分析,该研究检查不同年龄(例如,12个月、18个月和24个月),同时进行全面的组织病理学评估,以确定肿瘤前或肿瘤病变。
基因型多样的小鼠可以进一步用于合并研究急慢性炎症或免疫刺激。分析与衰老相关的宿主和癌症行为变化,以及与人类可比较的多组学数据,将有助于我们选择最具代表性的人类多样性品系和模型来研究特定的癌症行为。
小结
鉴于癌症主要是老年人的疾病,更好地理解衰老和癌症之间的相互作用将有助于改善老年患者的癌症预后。因此,结合癌症和衰老小鼠模型的研究非常必要。未来扩展跨物种综合分析工具包将有助于我们识别并理想地解释这些差异。与年龄相关的癌症临床相关模型的成功开发将使我们能够更有效地测试治疗干预措施并最终制定预防策略。
参考文献:
1.Challenges and opportunities for modeling aging and cancer. Cancer Cell. 2023 Mar 22;S1535-6108(23)00079-X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















#癌症# #免疫衰老#
32