据世界卫生组织统计,全世界每年约有1500万人发生中风事件,其中500万人死亡,另有500万人会留下永久性严重残疾。当前用于缺血性中风的临床疗法限于快速溶栓或去除血管内血栓以恢复脑灌注,迫切需要开发新的神经保护方法,以作为主要手段快速脑再灌注的补充手段治疗中风。
2020年7月1日,来自美国匹兹堡大学的研究人员在《Science Advances》上发表了一项最新研究成果,其发现了一种新的可注射具有血脑屏障渗透性的神经保护治疗肽TAT-DP-2,能够减少梗塞面积并保护改善中风后的长期神经功能。
电压门控钾通道Kv2.1是已知的调节神经元凋亡的关键通道,其会在插入树突状细胞簇质膜后使神经元中的胞质钾流失,导致细胞凋亡,其同源通道Kv2.2的羧基末端(CT)的过表达可通过破坏Kv2.1表面簇,抑制促凋亡钾离子通道电流的增强,从而起到神经保护作用。
在这项研究中,研究人员鉴定了Kv2.2 CT中介导Kv2.1脱簇和神经保护作用的DP-2关键序列并对其进行了验证,发现随之生成的具有细胞渗透性的转录反式激活因子(TAT)连接的DP-2(TAT-DP-2)化合物,能够诱导Kv2.1表面簇的明显分散,且可长达24小时。
由于囊泡相关膜蛋白相关蛋白A(VAPA)可将Kv2.1募集到簇中,研究人员检测了DP-2与VAPA结合的能力,发现两者之间不能结合。在评估TAT-DP-2是否能在体外破坏Kv2.1-VAPA的相互作用时,研究人员发现,该肽虽然不会直接结合VAPA,但其单独可以有效破坏Kv2.1-VAPA的结合。
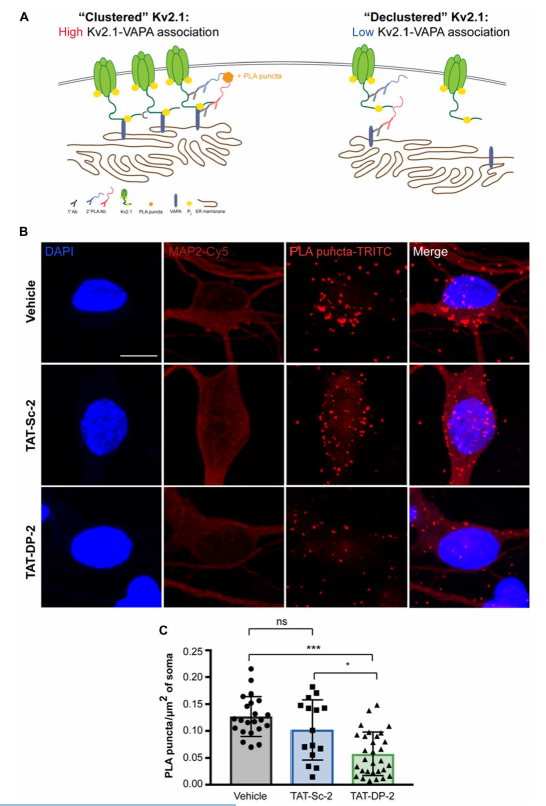
TAT-DP-2取代了皮质神经元中Kv2.1-VAPA的结合
研究人员利用双电极电压钳实时监测TAT-DP-2处理前后Kv2.1介导的钾电流在时间上的变化,发现TAT-DP-2诱导的Kv2.1脱簇可通过破坏神经元的膜插入来有效抑制神经元中促凋亡钾电流的增强。同时,通过体外测试发现TAT-DP-2在皮层神经元中具有保护神经的作用。
随后,研究人员对小鼠进行TAT-DP-2的腹膜内注射,结果显示该药物可有效递送至脑血管和脑实质,且能够在体内有效介导Kv2.1表面簇的快速分散。
于是,研究人员使用产生高度可复制梗塞的缺血性脑卒中及单侧大脑中动脉闭塞(MCAo)小鼠模型,进行MCAo治疗及再灌注,在再灌注开始后1和6小时进行TAT-DP-2给药处理,发现TAT-DP-2在小鼠体内具有强大的神经保护作用,不仅可以减少脑梗塞病变的大小,还可以在脑卒中的临床模型中保留脑血管损伤后的长期神经功能。

小鼠腹腔注射TAT-DP-2可减少脑梗死体积
该报告的第一作者Anthony Schulien表示,“在临床实践中,没有任何药物能够阻止中风后细胞死亡的发生,这些实验为药物靶向提供了一定的早期证据,我们希望有一天能将这些成果应用到临床患者的治疗中。”
原始出处:
Anthony J. Schulien, et al. Targeted disruption of Kv2.1-VAPA association provides neuroprotection against ischemic stroke in mice by declustering Kv2.1 channels. Science Advances 01 Jul 2020: Vol. 6, no. 27, eaaz8110. DOI: 10.1126/sciadv.aaz8110.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#新药物#
71
#脑梗塞#
79
#神经功能#
68
#脑梗#
97
#中风患者#
65
这是基础研究,与临床差异太大,就不大,可能会应用到临床的。
120
中风是俗称,应该称为缺血性卒中吧
98