Bioact Mater 徐安定/逯丹/麦鸿成团队聚焦缺氧神经元小细胞外囊泡取得新突破
2023-07-24 论道心血管 论道心血管 发表于上海
该研究利用体外缺氧复灌原代神经元释放的缺氧sEVs为研究对象,通过蛋白组学和转录组学全面系统地阐述缺氧神经元sEVs的特征和组分,并深入分析其在调节缺血性卒中细胞间互作的潜在作用和机制。
缺血性卒中具有高发病率、高致死致残率等特点,其致病机制错综复杂,临床上防治困难,严重危害我国居民健康。阐明致病机理,对缺血神经多靶点保护、减轻“缺血瀑布”反应是未来研究神经保护药物的关键。近些年研究发现,小细胞外囊泡(small extracellular vesicles, sEVs)具有细胞主动分泌、携带蛋白质和核酸信息、在细胞之间进行信息传递的特性,不仅参与了多种疾病的发生发展进程,还因其能透过血脑屏障、免疫原性低、稳定性高等特点逐步被用于中枢神经系统疾病的诊断和治疗。
2023年7月16日,暨南大学附属第一医院徐安定/逯丹教授团队于国际期刊Bioactive Materials (影响因子18.9)在线发表题目为“FUS-mediated HypEVs: Neuroprotective effects against ischemic stroke”的长篇研究性论文,该研究利用体外缺氧复灌原代神经元释放的缺氧sEVs为研究对象,通过蛋白组学和转录组学全面系统地阐述缺氧神经元sEVs的特征和组分,并深入分析其在调节缺血性卒中细胞间互作的潜在作用和机制。

该研究发现,缺氧复灌可刺激促进原代神经元sEVs释放,并导致大量RNA结合蛋白进入到sEVs,其中以RNA结合蛋白FUS的表达最为显著。在体内外摄取实验中,结果显示,缺氧sEVs比常氧sEVs更容易被神经元摄取利用;与此同时,富含FUS的缺氧神经元sEVs可以通过细胞间通讯调控脑梗死凋亡水平,改善梗死周边区神经突触蛋白的表达,保护神经突起复杂性,从而减小脑梗死体积,减轻缺血性卒中损伤。
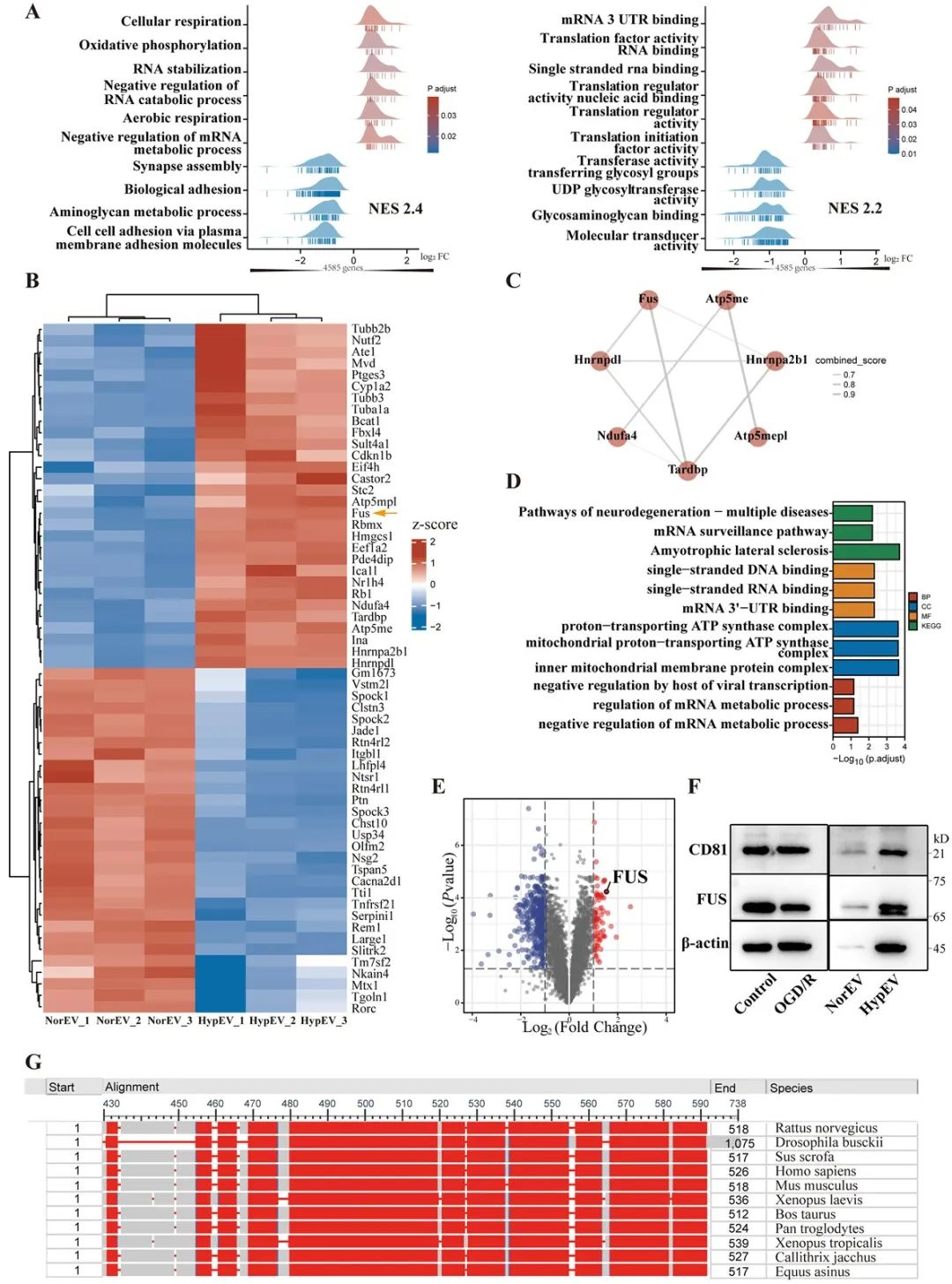
研究者进一步调控缺氧sEVs中FUS蛋白的表达,结果显示,FUS是神经元缺氧sEVs发挥神经保护作用的必不可少的条件。此外,FUS介导线粒体mRNA经缺氧sEVs的转运,在降低缺血性卒中线粒体相关凋亡中起着关键作用。
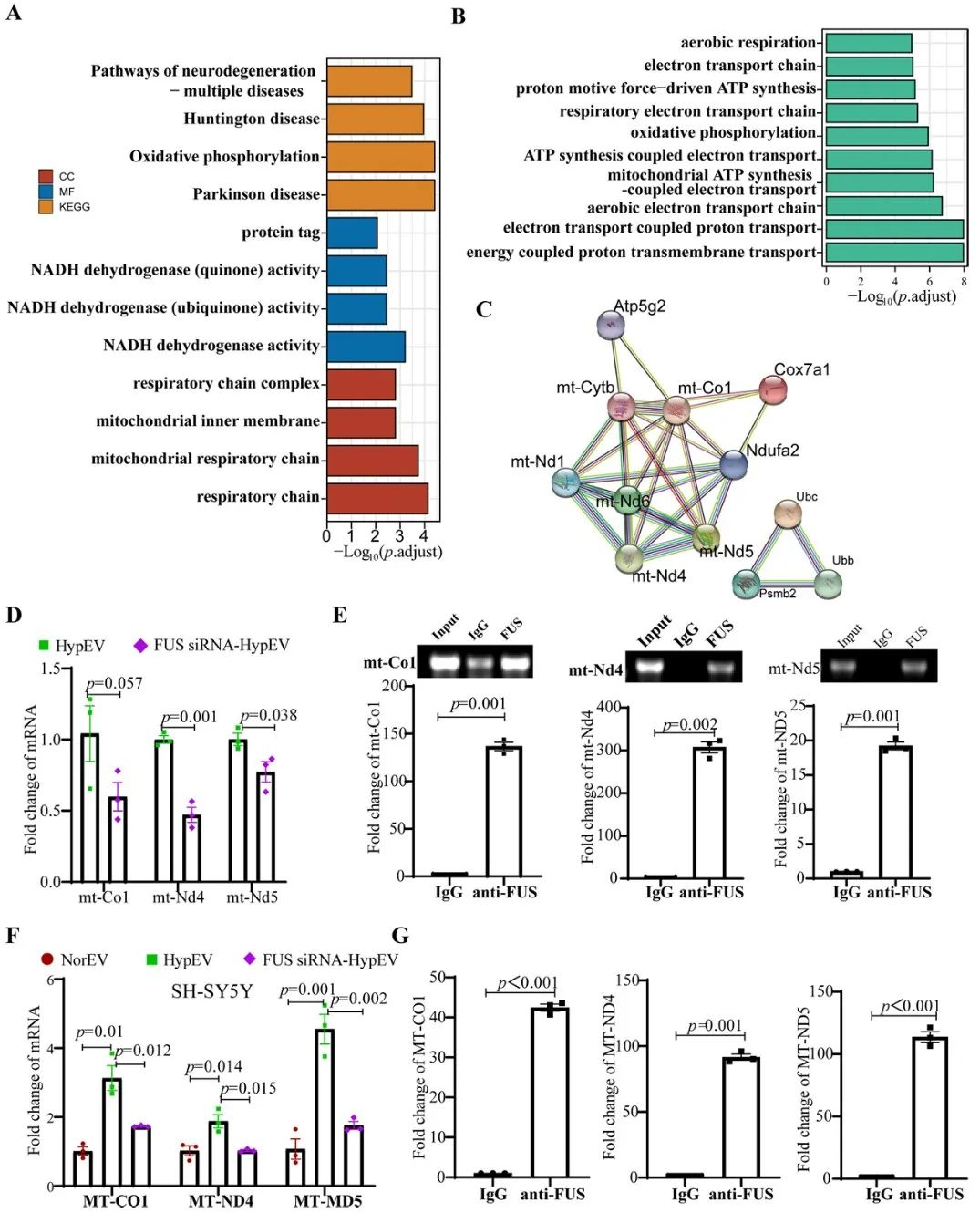
综上,该研究的相关成果为sEVs参与脑卒中缺血再灌注损伤病理生理过程提供更多的理论支撑,系统地论证了原代神经元中RNA结合蛋白经缺氧sEVs转运mRNA的过程。结合sEVs具备的归巢现象和摄取优势,为后期脑靶向治疗提供新的观点,推动了外泌体RNA结合蛋白负载核酸进行基因治疗的应用基础研究。
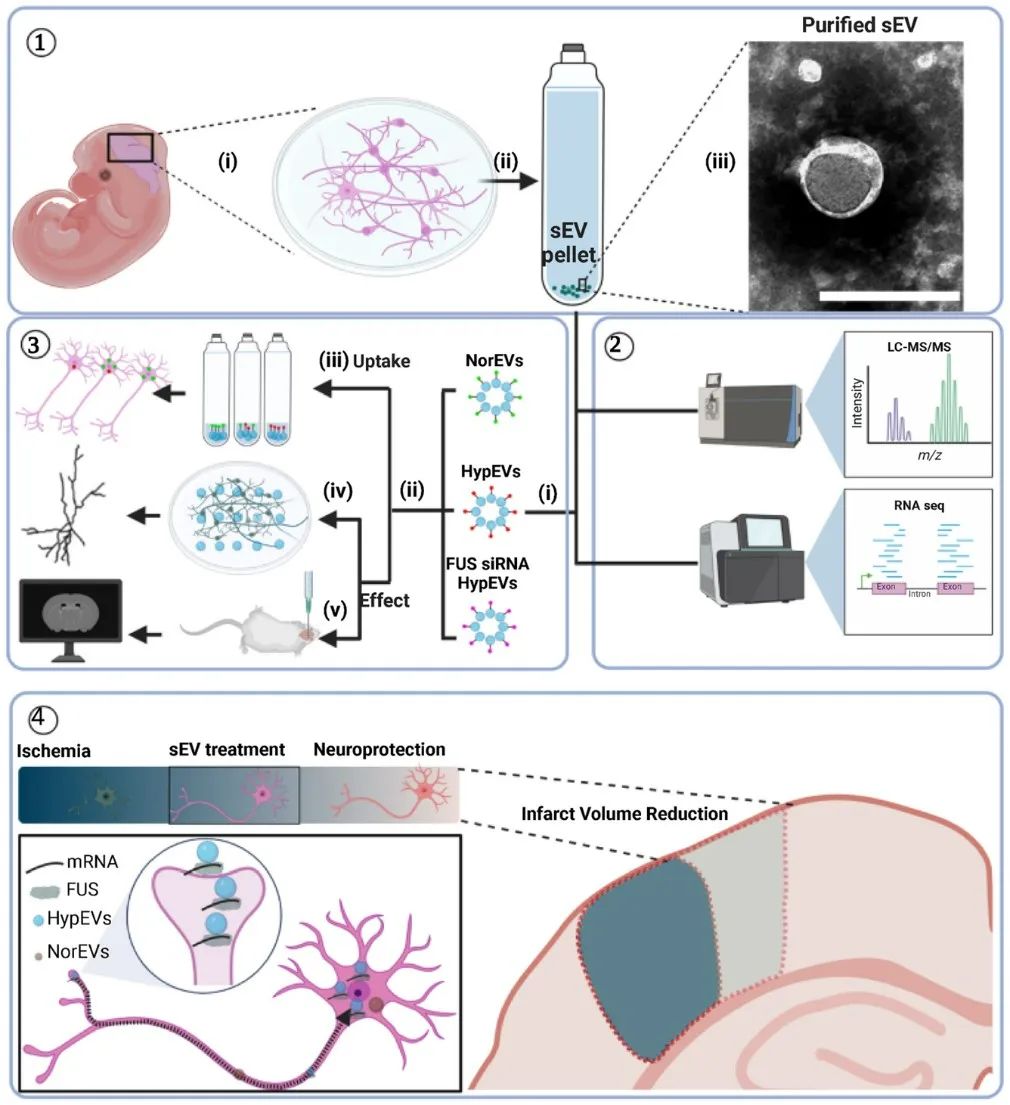
暨南大学附属第一医院为该研究的第一完成单位,吴有盛博士后、黄小雄博士研究生、谭泽锋副主任医师(佛山市第一人民医院)为本论文共同第一作者,逯丹副研究员、徐安定教授、麦鸿成博士后(合作单位: 德国亥姆霍兹国家研究中心)为本论文通讯作者。
论文链接:
https://www.sciencedirect.com/science/article/pii/S2452199X23002141
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







