J Hepatology: 肝脏的新冠病毒感染直接导致肝损害
2020-06-02 Doc. Zhu 免疫细胞研究bioworld
2019冠状病毒病(COVID-19)由严重急性呼吸系统综合征(SARS-CoV-2)引起,已在全球蔓延,造成持续大流行。从遗传学上讲,对下呼吸道样本的深度测序表明,该病毒与人类严重急性呼吸道综合征(
背景:
2019冠状病毒病(COVID-19)由严重急性呼吸系统综合征(SARS-CoV-2)引起,已在全球蔓延,造成持续大流行。从遗传学上讲,对下呼吸道样本的深度测序表明,该病毒与人类严重急性呼吸道综合征(SARS)和中东呼吸综合征(MERS)相关的冠状病毒不同。COVID-19常见的临床表现为体温升高、干咳、呼吸困难,抗生素治疗3天后无明显改善,白细胞减少,肺浸润。然而,在这些患者中广泛观察到的最显著的附加特征是肝酶异常,据报道高达50%的COVID-19患者存在这种异常,并引起了临床上极大的关注,尽管SARS-CoV-2被认为是一种肺病毒。由SARS-CoV-2感染引起的肝细胞病变是否导致肝损害尚不清楚。
简介:
2020年5月10日,来自解放军总医院第五医学中心病理与肝病科的Jingmin Zhao教授课题组在Journal of Hepatology(IF: 18.946)杂志上发表题为“SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19”的文章。超微结构和组织学证据都表明肝细胞具有典型的病毒感染病变。该研究表明肝内SARS-CoV-2感染是COVID-19患者肝损害的重要原因。因此,需要监测肝脏病毒清除情况和COVID-19的长期预后。

主要结果:
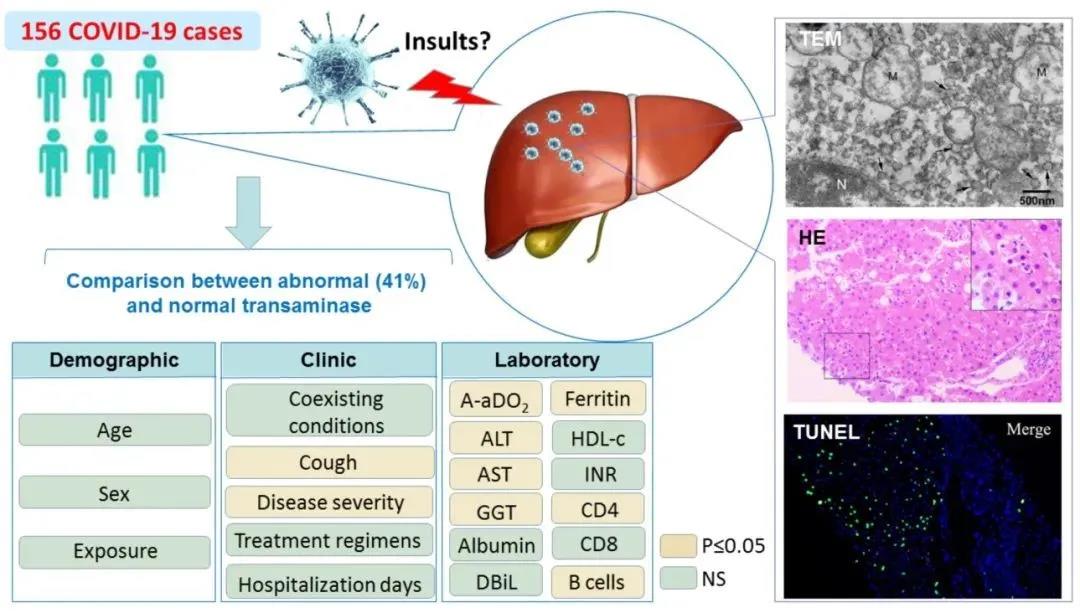
COVID-19患者肝脏转氨酶异常的特点。
本次研究共纳入156例COVID-19患者,其中重症54例,非重症102例,其中肝酶(其中ALT升高是最常见的异常)异常64例(41.0%)。共有96例(61.5%)患者有湖北地区(流行)史或与确诊的COVID-19患者有密切接触史,两组患者的接触史无显著差异。除了COVID-19患者肝酶升高的咳嗽比例更大(73.4% vs. 56.5%,P=0.031)之外,两组患者的初始症状患病率也相似。重要的是,作者发现肝脏转氨酶异常与疾病严重程度(P=0.007)和较高的放射学评分(P=0.007)相关。其中,54例(55.6%)重症患者中有30例出现肝酶升高,102例(23.5%)非重症患者中有24例出现肝酶升高。另外,26.9%的患者接受了免疫球蛋白治疗。转氨酶异常组与正常组治疗方案无明显差异。156例患者中,总死亡率为2.6% (n=4),3例(4.7%)患者发生肝酶异常(2例为ARDS, 1例为脓毒性休克),1例(1.1%)患者肝酶正常(脓毒性休克)。
在动脉血气检查中,相比较肝酶正常的患者,肝酶异常的患者的肺泡-动脉氧张力差(A-aDO2)中位数显著增高(202.0 vs. 27.6,P=0.022)。在肝脏检测升高和正常的患者中,肝酶检测ALT值中位数分别为50.0 U/L和19.0 U/L (P<0.001),AST分别为45.5 U/L和24.0 U/L (P<0.001)。与正常转氨酶患者相比,转氨酶升高的患者GGT水平较高,ALP水平相近。除肝酶外,其他常见的参数异常如白蛋白降低、DBiL升高、铁蛋白(ferritin, FER)升高在肝酶升高的患者中更常见(P=0.017、P=0.058、P=0.027)。
肝脏组织学和免疫组化结果
病例1为一名50岁男子,入院前一周出现轻度首发症状(第8天)。在整个病程中,他的转氨酶升高,丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的峰值分别为70 U/L和111 U/L。肺组织学检查显示弥漫性肺泡损伤(DAD),肺细胞脱屑明显,透明膜形成,提示严重急性肺损伤。肝活检显示大量聚集或分散的凋亡肝细胞,以核浓缩或形成凋亡体为特征。显著的双核或偶见多核合胞肝细胞。未发现明显的病毒包涵体。有中度微泡性和轻度大泡性脂肪变性。其他病理表现包括轻度到中度的局灶性小叶炎,浸润的主要是淋巴细胞和少数中性粒细胞。门管区轻度炎症伴淋巴细胞浸润偶见。未见嗜酸性粒细胞浸润、胆汁淤积、肉芽肿、纤维蛋白沉积、小叶中央坏死或界面性肝炎。
免疫组化显示CD68+细胞主要分布于肝窦,提示Kupffer细胞活化。CD4+细胞很少出现,少数CD8+细胞散在肝小叶和门脉区域。肝细胞和浸润的单核细胞中均有部分Ki-67阳性细胞。细胞核呈绿色荧光的TUNEL阳性细胞提示凋亡细胞。与对照组相比,COVID-19患者肝脏中凋亡肝细胞数量明显丰富。电镜观察发现在肝细胞胞浆中有大量具有刺状结构的典型冠状病毒颗粒,大多数病毒颗粒无膜小泡存在。病毒颗粒呈圆形,形态稍呈多形性,表面增厚,大小在60~120nm之间,表明具有冠状结构。有趣的是,SARS-CoV-2感染的肝细胞表现出明显的线粒体肿胀,伴有不明显的嵴或高电子密度物质,强烈提示SARS-CoV-2直接引起细胞病变。肝细胞中可见中等密度脂肪,糖原颗粒明显减少。

图1 病例1的尸检标本活检
病例2为一79岁女性,因反复发热、乏力、头晕、肌痛、咳嗽入院。病人于第28天死于感染性休克。她的肝酶在最后几天逐渐升高,ALT和AST峰值分别为76U/L和236 U/L。肝活检病理组织学与病例1相似,多灶性或较少的凋亡小体。可见大量双核或偶见多核细胞,核仁明显,染色质聚集。观察到中度微泡性和轻度大泡性脂肪变性。门静脉部炎症较轻。未发现小叶中央坏死、管/管状胆汁淤积、静脉、交界性肝炎或噬血细胞现象。
免疫组化显示大量较大的CD68+细胞主要见于窦状窦,小叶内可见散在的CD4+和CD8+细胞,肝细胞和库普弗细胞中有部分Ki67阳性细胞。与病例1相比,TUNEL法显示大量凋亡肝细胞。透射电镜显示,在肝细胞胞浆中有大量大小在70~120nm的冠状病毒颗粒,没有膜结合的小泡。大部分病毒颗粒是完整的,但也有少数碎片状病毒颗粒可见。观察到高密度的脂滴,细胞损伤模式包括肝细胞糖原颗粒减少和微绒毛脱落导致的小管损伤,提示SARS-CoV-2感染引起的细胞病变。
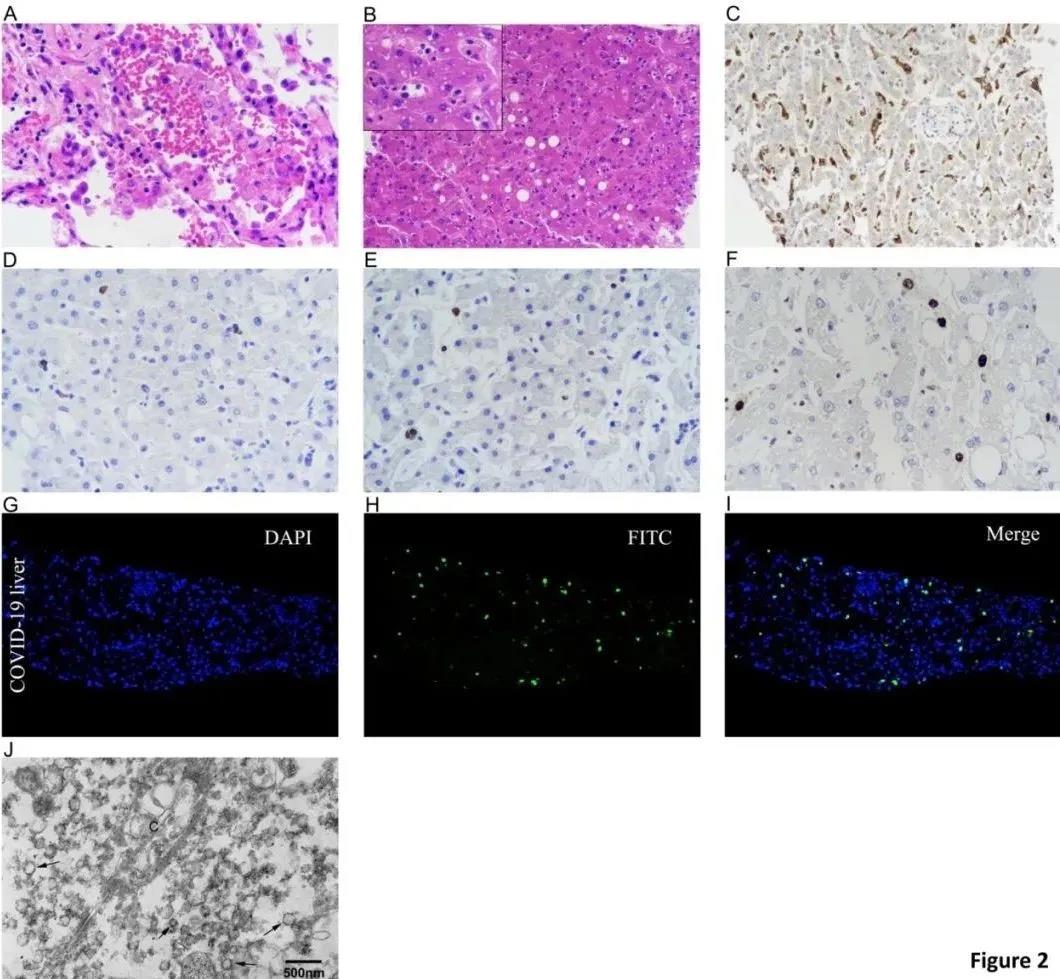
图2 病例2的尸检标本活检
结论:
在本研究中,作者明确了COVID-19患者肝脏转氨酶异常的临床和实验室特点,首次报道了SARS-CoV-2能够感染肝脏,并引起明显的肝损害。从这个角度来看,需要监测肝脏病毒清除情况和COVID-19的长期预后。在不同的COVID-19人群中,SARS-COV-2感染如何以及在何种程度上涉及肝酶异常仍需要进一步研究。
原始出处:
Wang Y, Liu S, Liu H, Li W, Lin F, Jiang L, Li X, Xu P, Zhang L, Zhao L et al. SARS-CoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19. J Hepatol 2020.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#J Hepatology#点击进入话题查看更多相关文章 或评论时插入话题加入讨论
135
#肝损害#
120
#EPA#
82
新冠肺炎,疫情何时才能消失
104