真实世界71%的原发性脑肿瘤患者可推荐分子匹配靶向治疗,疾病控制率达50%
2024-09-17 苏州绘真医学 苏州绘真医学 发表于上海
本研究为分子指导治疗方法对一部分脑癌患者的疗效提供了真实世界证据,强调了在这些实体中进行生物标志物分层试验的必要性,并为未来的研究项目提供信息,以进一步完善这些患者的个性化治疗策略。
尽管在分子分析和原发性脑肿瘤分类方面取得了重大进展,但对于大多数患者来说,个性化治疗仍然有限。在这里,研究者在德国弗莱堡分子肿瘤委员会中探讨了在真实世界环境中对成年原发性脑癌患者进行个体分子分析的可行性和生物标志物指导治疗的疗效。研究者分析了102名患有21种脑肿瘤类型的患者的基因图谱、个性化治疗建议和临床结果。细胞周期、BRAF和mTOR通路的变异最常促使个性化治疗建议。71%的患者被推荐采用基于分子变异的治疗方法,完成分子诊断的患者中有32%的患者实施了推荐的疗法。靶向治疗后的疾病控制率为50%,总体反应率为30%,31%的患者无进展生存期2/1(PFS2/PFS1)比率至少为 1.3。这项研究强调了脑癌中分子指导治疗的疗效以及生物标志物分层试验的必要性。
研究背景
生物标志物指导的治疗彻底改变了癌症患者的临床管理。除了药物开发取得重大进展外,创新的下一代测序技术(NGS)还可以实时识别具有可靶向基因变异的患者,并实现新的分子分层临床试验。这一重大技术进步大大提高了中枢神经系统(CNS)肿瘤的基因表征和分类,CNS肿瘤是一组高度异质性的癌症类型,涵盖120多种不同的实体。然而,与非小细胞肺癌或黑色素瘤等其他实体癌相比,尽管进行了大量的临床前研究工作,但对于CNS肿瘤来说,靶向和生物标志物知情的治疗选择仍然非常有限,目前的全身治疗策略仍然很大程度上依赖于常规化疗。III期INDIGO试验证明了双重IDH1/2抑制剂vorasidenib对IDH突变型胶质瘤的疗效,美国FDA已批准其上市,并强调了该领域对分子分析和精准医疗的需求。然而,大多数评估生物标志物分层疗法的临床试验仍然不适用于脑肿瘤患者,而且由于血脑屏障的存在,很大一部分靶向药物在中枢神经系统区室中无法达到足够的浓度。因此,许多已在脑外恶性肿瘤中成功测试的疗法可能对脑癌患者无效,尽管这些肿瘤具有相似的变异。
对于接受常规疗法后病情进展的脑癌患者,分子肿瘤委员会(MTB)可能提供临床试验之外的生物标志物指导和个性化治疗的一条可行途径。德国弗莱堡综合癌症中心(MTB-FR)的MTB已经建立了标准化工作流程,用于对肿瘤组织进行全面的特异性实体分子诊断、对基因组图谱以及常规临床参数进行跨学科评估和分析,以及在前瞻性观察研究(DRKS00025847)中招募的癌症患者提供基于生物标志物的治疗建议。
在此,研究者报告了2018年至2023年期间参加MTB-FR前瞻性观察研究的102名患有21种不同原发性脑肿瘤实体的患者按照个性化治疗建议进行的个体分子检测结果和临床结果。
研究结果
研究队列和患者特征:
2018年9月至2023年10月期间,102名原发性脑肿瘤患者被纳入MTB-FR观察性研究并接受评估(图1a)。87名患者(85%)成功进行了肿瘤分子分析,并随后在MTB-FR内以多学科方式进行了讨论,7名患者的肿瘤样本不足以进行分子分析,7名患者在分子检测之前或期间死亡,1 名患者肿瘤测序无法成功完成(图1a)。62名患者(71%)被推荐接受基于生物标志物的疗法,20名患者(32 %)在随后的病情进展和医疗保险批准药物后最终接受了推荐的靶向治疗(图1a)。其余42名患者,由于癌症进展后体能状态不佳和最佳支持治疗决定、失访(LFU)、医疗保险拒绝药物承保或对标准疗法的意外延长反应,未实施推荐治疗(图1a)。参加 MTB-FR 后的中位随访时间为829天(范围:220-2131天)。
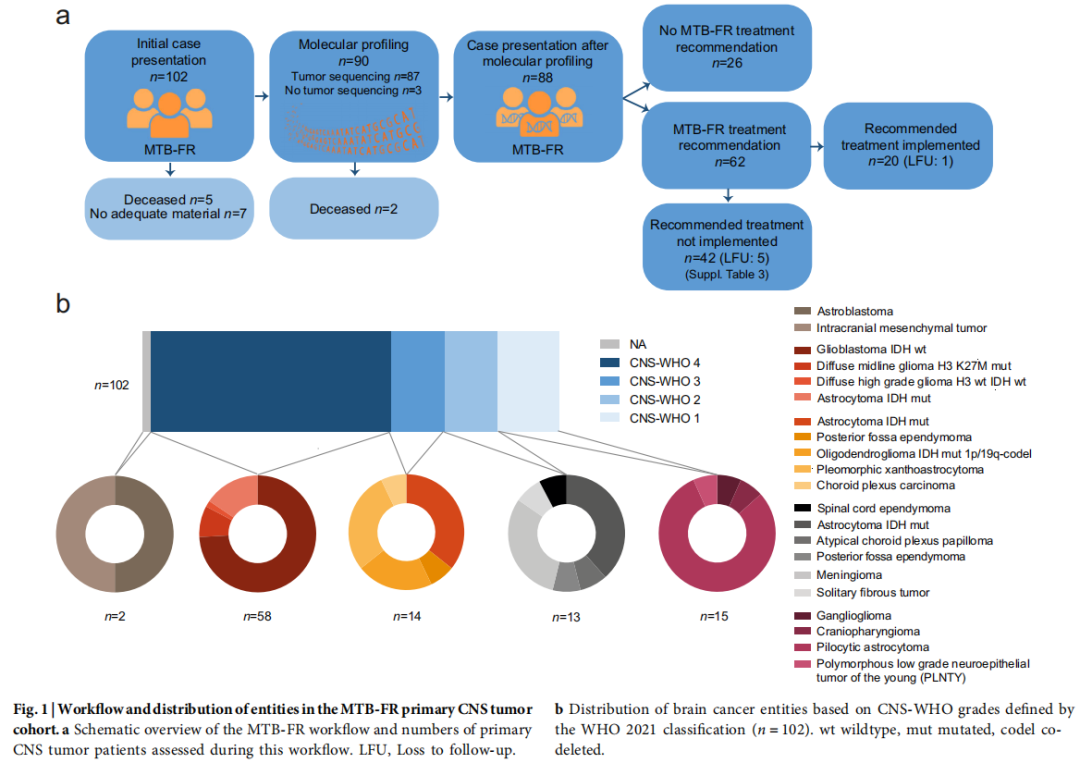
图1
表1概述了本研究中所有患者的临床特征。在MTB-FR中首次病例展示时,患者的中位年龄为46.5岁(范围:20-81岁),卡氏评分(KPS)中位数为90%(范围:50%-100%,表1)。患者在入组前接受过中位2线先前治疗(范围:0-8)(表1)。本研究队列具有高度异质性,有21种不同的脑肿瘤实体,涵盖从1到4的所有CNS-WHO等级(图1b)。大多数病例为CNS-WHO 4级肿瘤(57%),其中胶质母细胞瘤是最常见的癌症类型(43名患者,42%),其次是CNS-WHO 1级肿瘤(15名患者,15%)、CNS-WHO 3级肿瘤(14名患者,14%)和CNS-WHO 2级肿瘤(13名患者,13%)。患者在确诊后中位16个月(范围:0.6-399个月)纳入MTB-FR观察性研究,其中在首次发现肿瘤后CNS-WHO 4级患者中位9.5个月入组,CNS-WHO 3级患者为69.4个月,CNS-WHO 2级患者为48.8个月,CNS-WHO 1级患者为27.6个月。从最初病例出现到治疗建议的中位时间为80天。
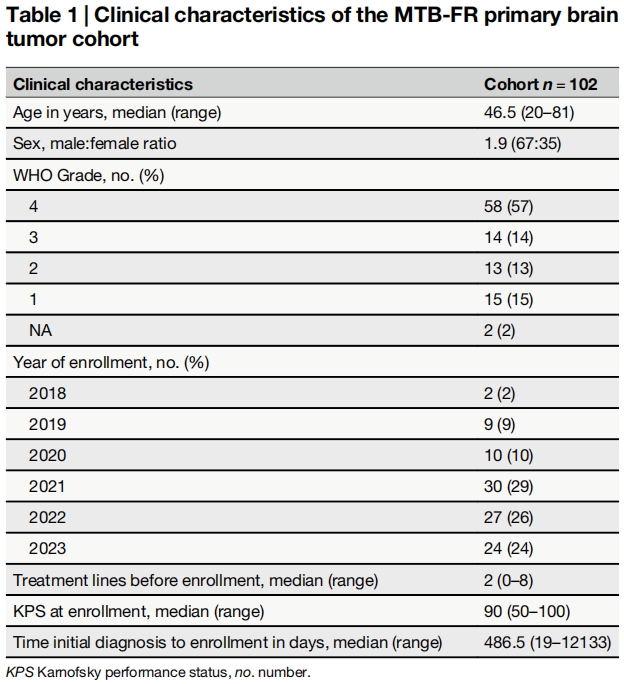
表1
分子分析:
90名患者(88%)接受了肿瘤分子分析,分析样本来自FFPE组织(97%)或新鲜冷冻标本(3%)。56%的病例使用了初次诊断时的肿瘤样本;44%的病例使用了复发或进展时间点的组织。肿瘤标本是通过切除术(81%)或脑肿瘤病变立体定向活检(19%)获得的。肿瘤细胞含量中值为70%,范围为10-95%。
研究者对12例患者(13%)进行了全外显子组测序(WES),包括胚系分析,同时通过靶向NGS检测对75例患者(83%)的肿瘤进行了基因分型,采用涵盖至少500个基因的大型测序panel(57例患者,63%)或涵盖少于500个基因的小panel/qPCR方法(18例患者,20%)。此外,大多数病例进行了超出标准诊断程序的免疫组织化学检查,涵盖程序性细胞死亡配体-1(PD-L1)、HER2、生长抑素受体、PTEN和磷酸化ERK,以确定其他靶点或验证测序结果。对于一部分患者,甲基化组分析(29%)和RNA测序(14%)被添加到诊断组合中。
研究者展示并讨论了采用不同技术的87例病例的肿瘤测序结果(图1a)。图2描述了分子谱,包括单核苷酸变异(SNV)、拷贝数变异(CNV)、基因融合、肿瘤突变负荷(TMB)和PD-L1评分(CPS/TPS)。最常检测到的变异基因是TP53(n = 30)、PTEN(n = 20)、IDH1(n = 15)、NOTCH1(n = 13)、NF1(n = 12)、EGFR(n = 11)、KMT2D(n = 11)、ATRX(n = 10)和BRAF(n = 10)基因,与先前报道的原发性脑肿瘤突变谱基本一致。在3名患者中观察到BRAF融合,其中KIAA1549为伴侣基因,这些患者均被诊断为毛细胞星形细胞瘤。值得注意的是,检测到两个NTRK融合,一个发生在患有胶质母细胞瘤的患者中,另一个发生在毛细胞星形细胞瘤中。此外,发现三分之一的CNS-WHO 4级肿瘤(n = 19)存在EGFR扩增,分别在4名患者中检测到FGFR增加或PTEN缺失。一部分患者可以进行TMB检测,但没有基于该指标的建议,因为其在脑癌实体中的预测价值仍不清楚。
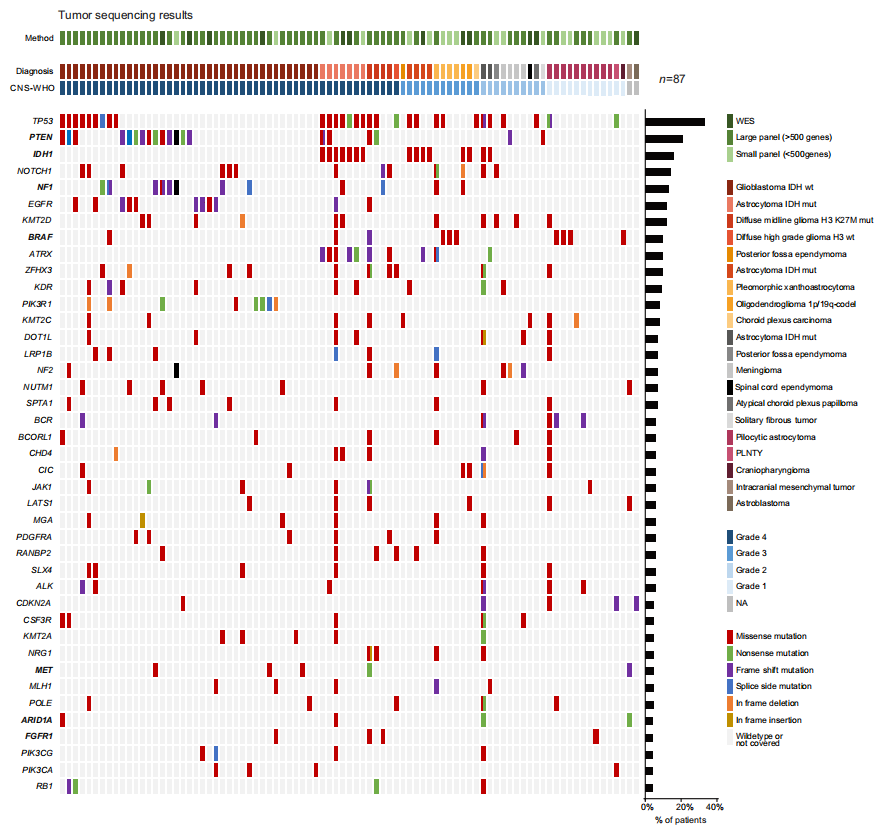

图2
在4例病例中,研究者扩展的分子谱分析导致初始诊断被修改。在一例病例中,检测到IDH1 D375N突变导致从巨细胞胶质母细胞瘤重新分类为星形细胞瘤CNS-WHO 4级。在另一例患者中,由于CNV谱,诊断从胶质母细胞瘤更改为多形性黄色星形细胞瘤。在2例病例中,实体特异性融合的识别提示将CNS-WHO 2级脑膜瘤重新分类为颅内间叶肿瘤(ATF1::ESWR1融合),将胶质母细胞瘤重新分类为年轻人的多形性低级别神经上皮肿瘤(PLNTY,FGFR2::CTNNA3融合)。
分子指导治疗建议和临床结果:
根据肿瘤分子图谱,为62例患者(71%)提供了治疗建议,包括广泛的靶向和个性化治疗方案(图3a)。不同CNS-WHO等级的患者的建议率有所不同。68%的CNS-WHO 4级患者、83%的CNS-WHO 3级患者、45%的CNS-WHO 2级患者和91%的CNS-WHO 1级患者得到了治疗建议。这些建议根据国家制定的“NCT证据水平”(方法)进行分类。对于有多项治疗建议的患者(n = 19),根据这些证据水平对 建议进行优先排序。治疗方法主要涉及9种生物过程和通路,大多数与细胞周期(n = 21)、BRAF(n = 12)和mTOR信号通路(n = 10,图3b)有关。
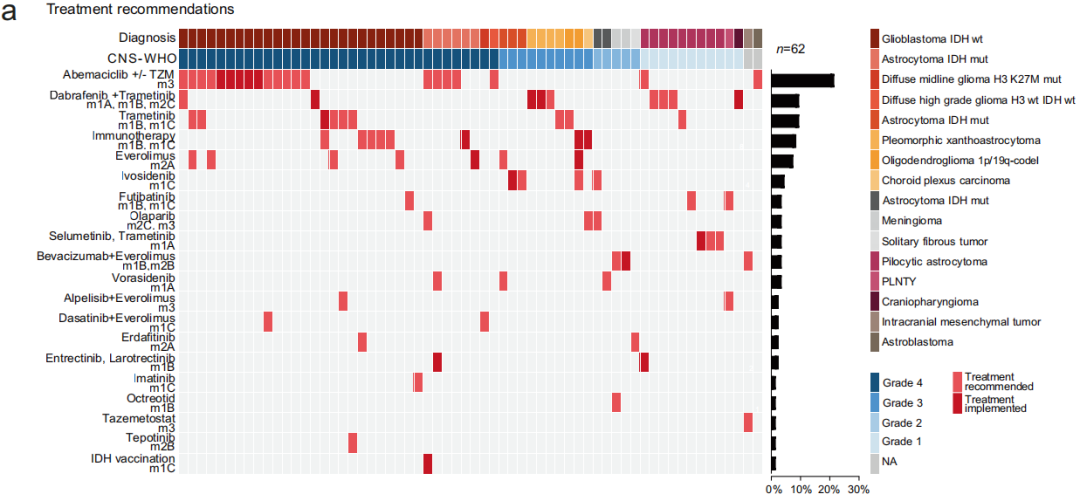
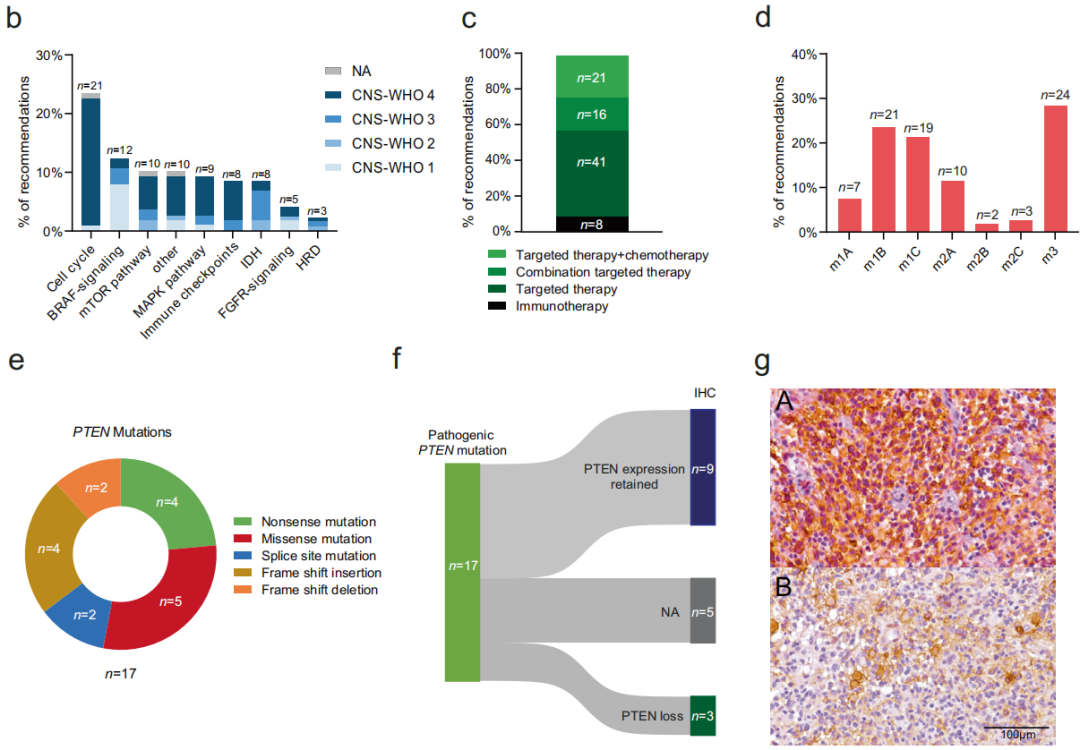

图3
总体而言,研究者建议41名患者采用单药靶向治疗,16名患者采用联合靶向药物治疗,8名患者采用免疫检查点抑制剂,21名患者采用靶向治疗和烷化剂化疗(替莫唑胺,图3a、c)。根据国家NCT证据水平,大多数建议基于最强的证据级别m1(总计n = 47,54%),来自前瞻性研究或荟萃分析(m1A,n = 7)、回顾性队列或病例对照研究(m1B,n = 21),或来自同一实体中的病例报告和小病例系列(m1C,n = 19),其次是基于临床前研究的证据级别m3建议(n = 24,28%,图3d)。只有17%的建议(n = 15)仅由来自不同实体的研究的证据支持(m2,图3d)。
在本队列中,PTEN突变是第二常见的变异,发生在17例患者中(图2和3e)。所有这些突变在OnkoKB或Clinvar数据库中均被归类为致病或可能致病,表明该肿瘤抑制基因的功能缺失。然而,在推荐生物标志物指导mTOR抑制剂治疗之前,验证了PTEN在蛋白质水平上的缺失,对12例患者进行了免疫组织化学分析,仅3名患者(25%,图3f、g)证实了PTEN蛋白缺失。值得注意的是,导致PTEN缺失的所有基因变异都是剪接区中的突变。
治疗建议的实施:
图4a概述了按CNS-WHO等级排序的已实施的生物标志物指导疗法和建议实施后的结果。截至数据截止,共有20名患者按照MTB-FR建议接受治疗,实施率为32%。该实施率在各个CNS-WHO等级中保持相对稳定,CNS-WHO 4级肿瘤的实施率为32%,CNS-WHO 3级和2级肿瘤的实施率为40%,CNS-WHO 1级肿瘤的实施率为27%。未实施治疗的原因包括病情快速进展导致体能状态不佳或死亡(48%)、LFU(14%)、病情稳定后继续标准疗法(31%)以及患者拒绝靶向治疗或医疗保险不承担药物费用(5%)。在实施靶向治疗的20名患者中,共接受了21种疗法,包括CDK4/6抑制剂(n = 4)、BRAF/MEK抑制剂(n = 4 )、mTOR抑制剂(n = 3)、免疫疗法(n = 3)、NTRK抑制剂(n = 2)、MEK抑制剂(n = 2)、IDH抑制剂(n = 1)、IDH疫苗接种(n = 1)以及VEGF与mTOR抑制剂联合治疗(n = 1)(图4a)。
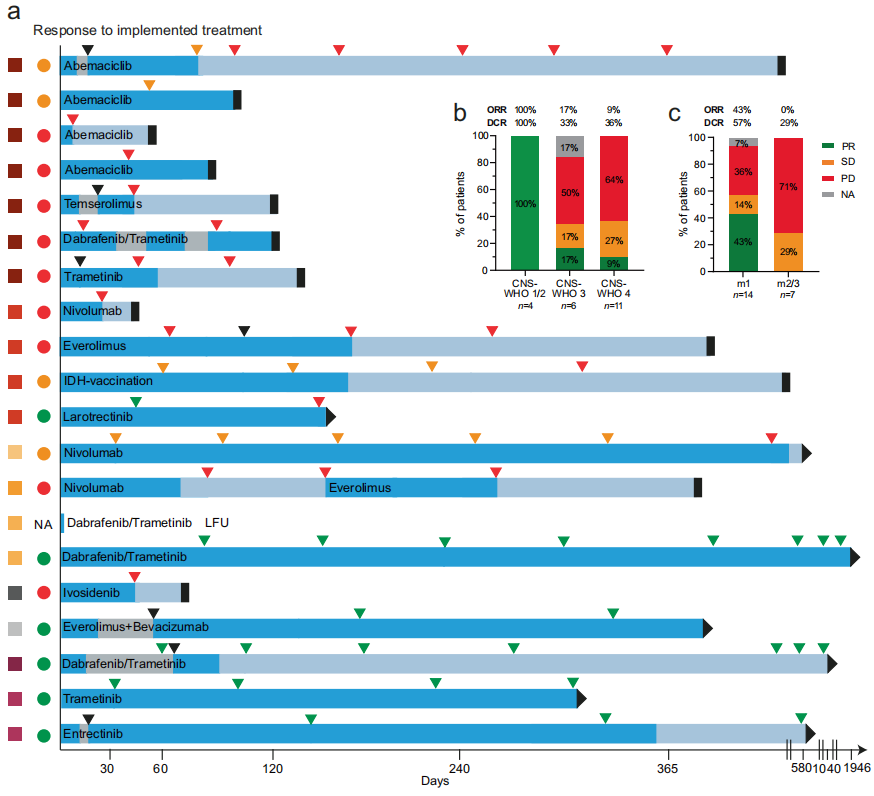

图4
接受推荐疗法的患者的中位随访时间为181天(范围:0-1946天)。在最终分析时,这些患者中有36%仍然存活,16%继续接受推荐药物治疗(图4a)。他们之前接受过大量治疗,中位数为3种治疗方案。实施推荐治疗后,总疾病控制率(DCR)为50%,总反应率(ORR)为30%,其中4名患者病情稳定(SD),6名患者部分缓解(PR)。值得注意的是,不同CNS-WHO级别和NCT证据级别的DCR和ORR存在显著差异。CNS-WHO 1级或2级肿瘤患者的DCR和ORR为100%,而CNS-WHO 3级和4级肿瘤患者的DCR和ORR分别降至33%/36%和17%/9%(图4b)。同样,根据m1证据水平接受治疗的患者的DCR为57%,ORR为43%,而根据m2/3证据水平的建议治疗的患者DCR为29%,ORR为0%(图4c)。
接受治疗后,患者的中位无进展生存期(PFS)为104天(范围:9-1946天),随访期间发生了15起事件(图4a)。21种疗法中有16种(76%)符合PFS2/PFS1比率评估标准,20种疗法符合Neuro-MCBS分析标准,它们是生物标志物指导治疗疗效的替代标志物。PFS 2/1比率的计算方法如下:按照MTB-FR推荐的疗法进行的PFS(PFS 2)/按照之前治疗方法进行的PFS(PFS 1)。PFS2 /PFS1比率范围为0.16至15.7。在所有可评估患者中,5名患者(31%)的 PFS2/PFS1 比率至少为1.3,8名患者(50%)的比率≥1.0。20种疗法中有6种(30%)达到了 Neuro-MCBS 1级,4种疗法达到了2级(20%),3种疗法达到了3级(15%)Neuro-MCBS。7种疗法的评分为 0(35%),表明没有临床益处。在CNS-WHO 1/2级肿瘤患者中,获得Neuro-MCBS 1级或2级的疗法比例最高(100%),但只有37%的 CNS-WHO 3/4级肿瘤患者被归类为Neuro-MCBS 1/2级。同样,61%基于NCT证据水平m1的疗法获得 Neuro-MCBS 1/2 级,遵循m2/3建议的只有29%。
治疗实施后的中位总生存期(OS)为657天。相比之下,未接受推荐疗法的患者的中位OS仅为264天,表明生物标志物指导的治疗对原发性脑肿瘤有潜在有益作用的趋势(p = 0.086)。在MTB-FR入组时,这两组患者的关键临床特征没有差异。
三分之一的患者在推荐的靶向治疗期间出现不良事件,需要减少剂量或暂时停止治疗(图4a)。这些不良事件包括血细胞减少症(n = 2)、皮疹(n = 2)、感染并发症(n = 1)、肝酶升高(n = 1)、高血糖(n = 1)、神经毒性(n = 1)、肌肉骨骼不适(n = 1)和肾上腺危象(n = 1)。两名患者因毒性而永久停止治疗(图4a)。
最后,在单独的分析中,研究者将本研究的关键结果参数与之前发表的评估脑癌患者靶向治疗方案的论文进行了比较。尽管研究设计存在一些差异,但所有相关特征,如推荐率、治疗实施率和治疗反应,与这些研究大致相似。
讨 论
原发性脑癌分子表征的作用和生物标志物指导治疗的可及性之间存在着很大的差异。虽然前者已经进入临床常规和世卫组织分类指南,但分子分层治疗的选择在中枢神经系统肿瘤中仍然很大程度上有限。根据III期 INDIGO试验的结果,vorasidenib获批用于治疗IDH突变的胶质瘤,这凸显了对脑癌进行靶向治疗选择的必要性。诸如N2M2 I/II期或INSIGhT II 期研究等开创性的伞状试验代表着朝着这个方向迈出的重要一步,这两项研究均探索了分子指导治疗策略对未发生MGMT启动子高甲基化的胶质母细胞瘤选定患者的疗效。然而,大多数脑癌患者获得目前靶向治疗的机会仍然有限,因为相当一部分中枢神经系统肿瘤患者仍然不符合大多数实体肿瘤伞式试验的资格,而且对于除胶质母细胞瘤以外的大多数脑癌,还缺乏生物标志物知情试验。
学术机构的MTB结合了医生、分子病理学家、癌症生物学家、遗传学家和生物信息学家的专业知识,在对癌症患者进行广泛的分子检测后提供个性化和生物标志物指导的治疗,而无需保留标准治疗方案。研究者在此介绍了2018年至2023年期间参加MTB-FR观察性研究的102名成年中枢神经系统肿瘤患者的临床特征、全面分子分析结果和结果。MTB-FR是德国巴登-符腾堡州四个“个性化医疗中心(ZPM)”之一。研究者通过成功分析最初在MTB-FR就诊的85%的患者,证明了在这种真实世界中对多种脑癌实体进行分子分析是可行的。在分子诊断完成之前,合适肿瘤标本的可用性和患者死亡限制了研究者工作流程的可行性。此外,研究者发现71%的患者获得了一项或多项基于生物标志物的治疗建议,并且这些建议已在相当一部分患者(32%)中实施。一半以上的建议(54%)被归类为NCT证据级别m1,表明MTB-FR致力于选择具有最佳预期疗效的疗法。然而,推荐的疗法无法在相当一部分患者(68%)中实施,主要是由于快速进展导致体能状态不佳或死亡,这表明脑癌患者可能受益于早期入组和启动MTB-FR工作流程。未实施的另一个主要原因是标准治疗的意外反应延长。在这些患者中,研究者推荐的治疗方案可能会在未来实施,这可能会进一步提高实施率。
本研究的一项主要结果是,在这组接受过大量治疗的患者中实施个性化的超适应症疗法,使相当一部分患者获得了持久的临床反应或疾病控制。然而,研究者注意到,治疗反应因肿瘤实体不同而存在显著差异,也取决于推荐的疗法是基于强证据水平还是弱证据水平。低级别脑肿瘤(CNS-WHO 1/2级)患者和根据证据水平m1接受治疗的患者表现出最高的DCR/ORR和PFS2/PFS1比率,CNS-WHO 3级或4级肿瘤患者和接受m2/3类别治疗的患者临床获益明显较低。事实上,只有2名患有侵袭性CNS-WHO 3级或4级肿瘤的患者在接受拉罗替尼和达拉非尼/曲美替尼靶向治疗后出现部分反应,这两项治疗均是在检测到NTRK融合和BRAF V600E突变后根据证据水平m1实施的。这些发现通常表明,在这种临床背景下,患者倾向于从早期试验或病例报告中记录的同一癌症实体的疗效治疗中获得最大益处,以及从其他癌症类型的既定治疗方式(如NTRK抑制剂或BRAF/MEK抑制剂)中获得最大益处。这一观点反映了先前评估原发性脑肿瘤靶向疗法的研究的类似观察结果。相比之下,依赖临床前研究证据的靶向治疗方法显然效果较差,这表明需要改进和优化这些药物的患者选择,以及设计未来创新的生物标志物知情临床试验。
尽管在这些分析中考虑的脑癌实体存在一些差异,但在推荐率和对推荐疗法的反应方面,本研究的关键特征在很大程度上与该领域其他已发表的研究相当。例如,本研究的实施率为 32%,PFS 2/1比率高于1.3的患者占比31%,与其他脑癌研究中报告的大致相似。此外,本研究结果也与探讨其他实体癌分子分层疗法的文献一致。例如,在针对罕见和晚期实体肿瘤基因变异的大型研究中,生物标志物指导治疗的实施率分别为31.8%和 23.6%,35.7%和33%的患者PFS 2/1比率高于1.3,这与本研究结果相似。
本研究的一个显著结果是,大量已识别的PTEN突变在不同数据库中被归类为致病或可能致病。然而,这些病例中只有一小部分通过免疫组织化学检测显示PTEN缺失,表明对mTOR信号通路没有影响。为了进一步探索mTOR信号通路的激活,其他研究结合了磷酸化-mTOR或磷酸化-S6的免疫组织化学分析。到目前为止,研究者还没有将这些生物标志物纳入MTB-FR的项目组合中,可能会错过适合接受mTOR抑制剂的患者。
本研究存在一些局限性,还有各种障碍需要克服。首先,一个固有的局限性是本研究的样本量相对较小和单中心性质,以及患者群体、肿瘤实体和应用疗法的异质性,这妨碍了对临床结果的解释。研究者使用了PFS2/PFS1比率和Neuro-MCBS等指标来估计靶向治疗策略的疗效。然而,尽管PFS2/PFS1比率在这种情况下被广泛使用,但应用了不同的阈值,为其可解释性带来了一些不确定性。Neuro-MCBS是最近开发的,特别是针对神经肿瘤患者;然而,它需要在前瞻性临床试验中进一步验证以证明其价值。此外,由于技术的进步,在本观察性研究期间,这种真实世界环境中可用的测序方法的格局发生了变化,引入了一些用于肿瘤基因分析的技术的异质性。多年来,基因组覆盖率不断提高,这带来了早期panels可能错过一些治疗相关靶点的风险。然而,由于原发性脑肿瘤中绝大多数可靶向的变异都可以通过相当小的panels捕获,测序技术的进步可能对推荐率的影响很小。最后,对数秩分析显示实施治疗的患者与未接受靶向治疗的患者相比具有生存优势,必须谨慎解读,因为后者群体的一般状况在治疗推荐时可能下降得更多。
总的来说,本研究为分子指导治疗方法对一部分脑癌患者的疗效提供了真实世界证据,强调了在这些实体中进行生物标志物分层试验的必要性,并为未来的研究项目提供信息,以进一步完善这些患者的个性化治疗策略。
参考文献:
Kuehn, J.C., Metzger, P., Neidert, N. et al. Comprehensive genetic profiling and molecularly guided treatment for patients with primary CNS tumors. npj Precis. Onc. 8, 180 (2024). https://doi.org/10.1038/s41698-024-00674-y
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#原发性脑肿瘤# #生物标志物分层试验#
59