自身免疫性痴呆(Autoimmune dementia)|疑难探究
2023-09-24 神经科学论坛 神经科学论坛 发表于上海
痴呆症是指一种获得性的个体内部认知衰退综合征,最终会干扰个体管理工作或家庭日常事务的能力。
论坛导读:痴呆症是指一种获得性的个体内部认知衰退综合征,最终会干扰个体管理工作或家庭日常事务的能力。随着自身免疫性和副肿瘤性脑炎(AE)患者诊断和治疗经验的增加,越来越明显的是,痴呆可能是免疫介导的中枢神经系统损伤的亚急性或慢性并发症。进行性记忆和思维问题可能是潜在自身免疫或副肿瘤疾病的第一(或唯一)迹象。因此,需要常规考虑痴呆患者不良事件的诊断,并评估从不良事件中恢复的患者有无临床意义的认知障碍。
世界卫生组织(WHO)将痴呆定义为一种综合征,通常是慢性和进行性的,其认知功能退化超过正常衰老的预期。该综合征可影响记忆、思维、定向、理解、计算、学习、能力、语言和判断、情绪控制、社会行为和动机,但无意识损害。最近更新的精神障碍诊断和统计手册第五版(DSM-V)标准使用术语主要神经认知障碍来描述这种综合征。
血管性痴呆(VD)是继阿尔茨海默病(AD)之后导致认知障碍的第二大原因。VD不是一种特定的疾病学实体,而是一种综合征,包括由脑供血受损引起的多种疾病。系统性自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎、血管炎和抗磷脂综合征(APS)可与痴呆相关。VD通常与传统心血管危险因素的存在有关,但它也可能与影响脑血管、神经元细胞或两者的许多疾病有关。对血管性痴呆的鉴别诊断要有兴趣,要准确地识别和治疗血管性痴呆,以保持患者的生活质量。
脑病(encephalopathy)一词,严格来说,定义为影响大脑功能的疾病过程。当炎性病因(可以是自身免疫性的或传染性的)起作用时,就使用脑炎这个术语。虽然意识的严重改变在历史上与脑病/脑炎有关,并且确实发生在这些患者中的许多人身上,例如新发作的难治性癫痫持续状态(NORSE)或复杂的边缘脑炎,但人们也认识到自身免疫性痴呆(Autoimmune dementia),许多患有自身免疫性脑炎/脑病的患者不会有意识的改变,而是患有亚急性/快速进行性痴呆综合征,在这种情况下,他们会去门诊诊所进行评估,而不是急性去医院。此外,一些特征性痴呆综合征,如路易体病,被认为具有显著的觉醒波动,这使得区分痴呆的神经退行性和自身免疫性病因更加困难。
亚急性痴呆综合征,例如抗富含亮氨酸神经胶质瘤灭活-1 (LGI1)脑炎/痴呆,可能表现为快速进行性痴呆而没有意识改变或急性到医院伴有严重脑病和意识障碍。多达三分之一的自身免疫性病因痴呆患者最初被诊断为不可逆神经退行性痴呆或朊病毒疾病,这凸显了区分这些综合征的困难。
自身免疫性脑炎(Autoimmune encephalitis,AIE)包括一组抗体介导的炎性脑病。这些抗体与神经元结构的细胞外表位结合导致大脑功能障碍。AIE的诊断标准有助于选择患者进行抗体检测。这些标准的特征是认知亚急性恶化、精神状态改变或精神症状。这些症状应伴有癫痫发作、中枢神经系统局灶性受累的新发现或脑脊液(嗜酸性粒细胞增多症)或脑部MRI的炎症变化。抗富含亮氨酸的神经胶质瘤灭活1 (LGI1)、抗NMDA受体(NMDAR)、抗γ-氨基丁酸B受体(GABABR)或抗接触蛋白相关蛋白样2 (CASPR2)抗体是引起AIE的最常见抗体,在所有这些AIE亚型中,认知能力经常受到影响。
自身免疫性痴呆的早期前驱期可能由非特异性或非神经症状组成。伴有或不伴有腹泻的严重体重减轻(中位数为10-20kg)发作可能先于脑病/痴呆,已有二肽氨基肽酶样蛋白6 (DPPX)和偶尔胶质纤维酸性蛋白(GFAP)自身抗体的报告,后者通常先于病毒前驱症状或疫苗接种。在自身免疫性疾病中,认知能力下降的发作通常是急性到亚急性的,并且随着记忆域受到不成比例的影响而迅速恶化。
一项研究将自身免疫性痴呆患者与其他原因引起的痴呆患者进行比较发现,亚急性发作、病程波动、震颤和头痛是更可能提示自身免疫性原因的症状。边缘性脑炎会导致意识丧失。认知/行为症状出现后,病程早期出现癫痫发作是自身免疫性病因学的一个线索,在神经退行性痴呆中很少见,通常发生在晚期。
面臂肌张力障碍性癫痫发作是抗LGI1脑炎的独特和特征性表现,可被误认为肌阵挛或非癫痫现象,因此,有多达一半的这些发作的患者最初被诊断为患有克雅病(CJD)或精神疾病。其标志性特征包括面部、手臂或两者短暂的张力障碍性姿势发作,腿部有时也会受到影响。患者通常保持意识,并可能抱怨物品从手中掉落。发作频繁(典型的是每小时多次),并且可以左右交替。阵发性眩晕发作也被认为与抗LGI1脑炎有关。
精神病症状是自身免疫性脑炎的另一个常见特征,尤其是抗NMDAR抗体。其他介绍已被报道,包括一例模仿额颞叶痴呆;亚急性发病、快速进展和无家族史将有助于区分自身免疫性病因和神经退行性病因。睡眠障碍越来越受到重视;嗜睡和睡眠呼吸障碍是免疫球蛋白样细胞粘附分子IgLON家族成员(IgLON5)抗体的一个主要特征,它具有慢性表现,并可能伴有延髓障碍和步态功能障碍,有时模仿进行性核上性麻痹。伴有失眠、多汗和外周神经过度兴奋(疼痛性痉挛和肌束震颤)的快速进展性痴呆应怀疑与接触蛋白相关蛋白2 (CASPR2)抗体有关的莫尔文综合征。虽然孤立性帕金森综合征并不常见,但已发现一种进行性脑脊髓炎、强直和肌阵挛(PERM)的临床综合征,通常伴有过度惊骇,并与GAD65或甘氨酸受体抗体相关。可能遇到的其他运动障碍包括自身免疫性/副肿瘤性舞蹈病[例如,塌陷蛋白反应介质蛋白5(CRM P5)/抗CV2],颌张力障碍[抗神经元核抗体2型(ANNA-2)/抗Ri],以及口面部运动障碍(抗NMDAR脑炎)。
据报道,CASPR2抗体可导致间歇性共济失调,而许多其他抗体可导致进行性共济失调合并自身免疫性痴呆(表1)。眼阵挛-肌阵挛、颌张力障碍和喉痉挛可能与ANNA-2/抗Ri抗体有关。伴有视盘水肿(GFAP-IgG)或视网膜病变(Cr mp5-IgG/抗CV2)的自身免疫性痴呆可出现视觉功能障碍。
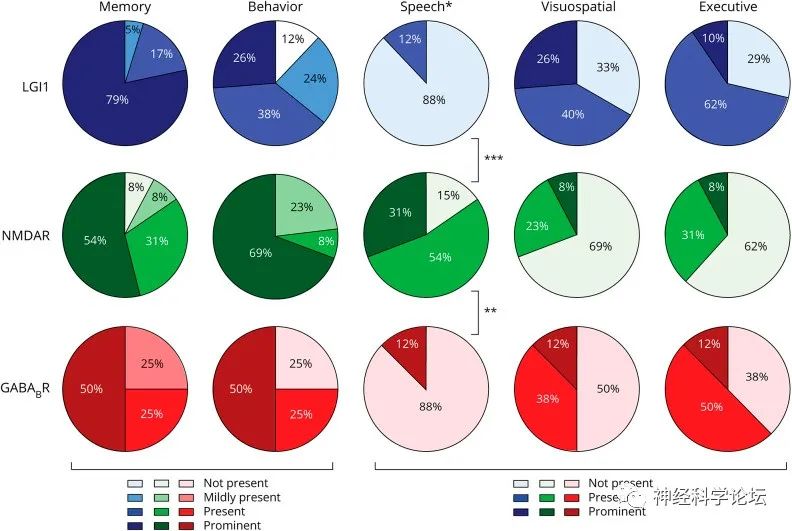
自身免疫性脑炎中的认知域(Neurol Neuroimmunol Neuroinflamm. 2021 Aug 2;8(5):e1039.)
自身免疫性痴呆和脑病比其他导致认知能力下降的原因更不常见,如神经退行性疾病。一项评估年轻患者(17-45岁)痴呆病因的研究发现,神经退行性痴呆是最常见的病因(31.1%),其次是自身免疫或炎症病因(21.3%)。最近的一项研究发现,在巴西,免疫介导的疾病占快速进展性痴呆症的46%,而在传染病占主导地位的印度,这一比例较低,为18%。在西班牙的另一项研究中,自身免疫/副肿瘤原因仅占4%。随着神经退行性病因变得更加常见,自身免疫性痴呆在所有痴呆中所占比例在老年时较低,但某些抗体在老年个体中确实具有优势(例如,抗LGI1自身抗体)。在并非继发于朊病毒疾病的快速进展性痴呆患者中,自身免疫是三级转诊中心9-13%病例的原因。因此,尽管认识到自身免疫是痴呆的一个原因是至关重要的,但重要的是要知道它不像其他病因那样常见,诊断应谨慎。然而,一些流行病学研究是基于旧的数据,在这些队列中自身免疫性痴呆可能被诊断不足。自身免疫性痴呆的性别差异是公认的,并取决于伴随的自身抗体。例如,抗NMDAR脑炎在女性中占优势,而抗LGI1脑炎在男性中更常见。
AIE可以模仿痴呆。在病程中,尤其是出现危险信号时,应考虑更频繁、更快速地进行抗体检测。年龄在45岁或以上的AIE患者的危险信号是快速进行性认知下降、辅助检查异常(脑脊液或MRI上的炎症变化)、病程早期容易漏诊的轻微癫痫发作和疾病晚期的显著癫痫发作。病程早期的广泛脑萎缩支持神经变性,而MRI-DWI的异常更提示RPD患者患有CJD。在AIE,当怀疑痴呆时经常需要的CSF标记物(包括t-tau、p-tau、Aβ42和14-3-3)可以是阳性的。然而,医生应该意识到脑脊液和脑MRI的辅助检查在AIE是完全正常的,当有疑问时需要进行抗体检查。
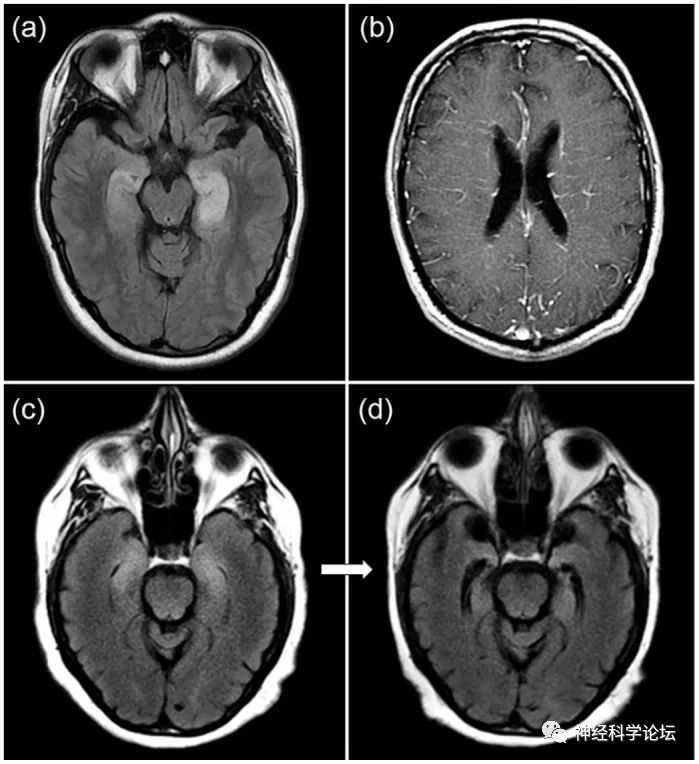
自身免疫性痴呆的MRI病例。(a)与GAD65自身抗体相关的自身免疫性边缘性脑炎患者的内侧颞叶出现双侧T2高信号。(b)GFAP自身抗体患者出现放射状血管周强化。(c)双侧内侧颞叶T2高信号,与边缘性脑炎一致,发生在使用免疫检查点抑制剂后,伴随1个月后随访MRI检测到未分类的神经自身抗体,显示双侧颞叶萎缩(d)。(Ther Adv Neurol Disord. 2021 Mar 19;14)
磁共振成像(MRI)有助于诊断痴呆和脑病的自身免疫性病因,并排除认知障碍的其他原因。单侧或双侧颞叶内侧的液体衰减反转恢复(FLAIR)或T2高信号伴或不伴钆增强是边缘性脑炎的特征,但也可见于癫痫和单纯疱疹病毒(HSV)脑炎。在一些面臂肌张力障碍性癫痫发作和抗LGI1脑炎患者中可见到基底神经节T1和T2高信号;基底神经节T2高信号可能与多种其他抗体相关,包括抗NMDAR、抗Ma2或抗CRMP5。抗Ma2抗体也可能累及间脑,尤其是在第三脑室表面周围。基底神经节和丘脑内的信号异常,特别是当伴有限制性扩散时,被认为是非自身免疫性痴呆/脑病,如CJD或Wernicke脑病。γ-氨基丁酸A型受体(GABAAR)抗体可能具有多个皮质和皮质下T2高信号。放射状血管周强化是GFAP IgG的典型表现。
Susac综合征是一种免疫介导的血管疾病,可显示胼胝体中心的“雪球”和“辐条”型病变,或沿着内囊形成“珍珠串”征的点状限制性扩散。在中枢神经系统(CNS)血管炎或淀粉样β蛋白相关的脉管炎中,可能会出现由梯度回波或磁敏感加权成像变暗显示的受限扩散和微出血,通常伴有软脑膜强化,应在适当的情况下考虑。中枢神经系统血管炎被认为发生在与淋巴瘤相关的副肿瘤环境中。大多数神经退行性疾病伴有萎缩;无信号异常的中度至重度萎缩应怀疑为非自身免疫性痴呆。
当评估患有认知障碍的患者时,最重要的方面之一是区分可逆和不可逆的原因。免疫介导的脑功能障碍的表现可以从急性脑炎和癫痫持续状态到潜在的认知障碍。因此,考虑到对免疫疗法良好反应的可能性,神经科医生在评估新发痴呆患者时考虑自身免疫原因是至关重要的。抗体生物标志物发现的重大进展使我们能够更好地识别这些免疫介导的认知障碍。这些疾病最初被认为是一种自发性自身免疫现象或癌症相关的免疫反应(副肿瘤性疾病)。现在认识到,自身免疫性痴呆可以发生在其他新的情况下,如疱疹病毒性脑炎后,移植后,或用免疫检查点抑制剂(ICI)治疗癌症后。不断扩大的自身免疫性痴呆的临床范围强调了所有神经学家认识和理解这些疾病的必要性。
自身免疫性痴呆是复杂的疾病,可导致免疫介导的认知缺陷,并具有混乱的命名。临床表现从急性边缘性脑炎到类似神经退行性痴呆的亚急性或慢性认知障碍不等。它可能作为副肿瘤现象或自发性自身免疫现象出现。自身免疫的个人/家族史、炎性脊髓液、自身免疫的血清学证据(神经或非器官特异性)或近中颞磁共振成像异常的存在是诊断的线索。床边认知评估和/或详细的神经心理学测试是有用的。
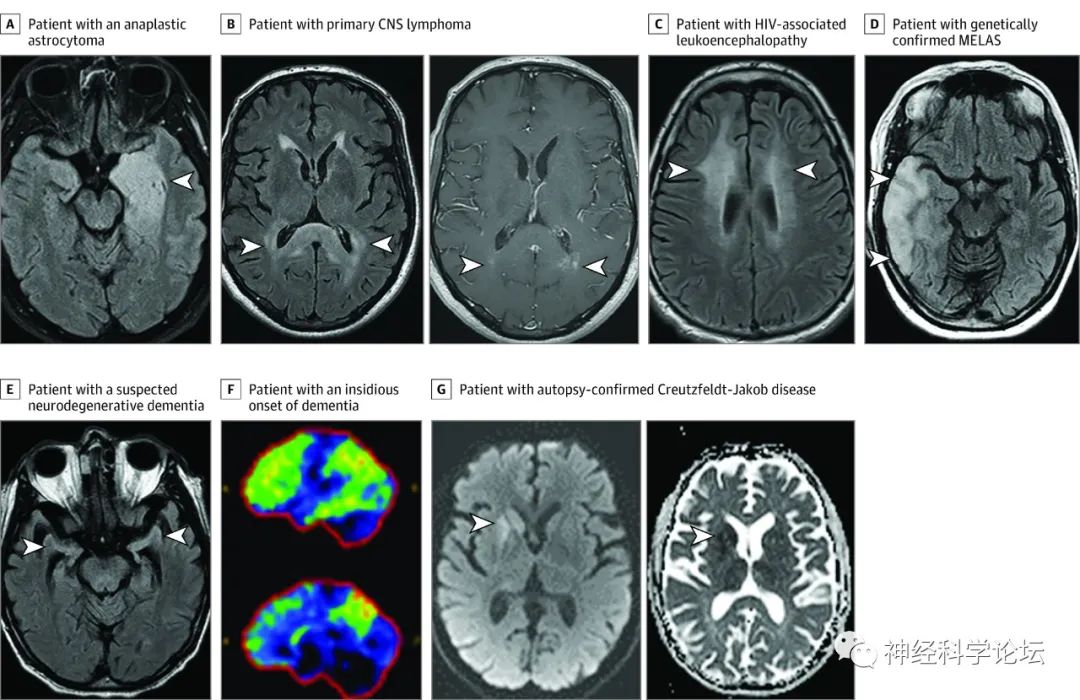
被误诊为自身免疫性脑炎的影像病例:T2-FLAIR图像显示间变性星形细胞瘤患者左侧内侧颞叶T2高信号和肿胀(箭头)。回顾受影响区域的丰满/扩大,可能提示一些肿块效应。轴位T2-FLAIR成像显示原发性中枢神经系统(CNS)淋巴瘤患者双侧脾T2高信号(B,左图,箭头)伴多灶性点状强化(B,右图,箭头)。轴位T2-FLAIR图像显示一名HIV相关白质脑病患者皮质下白质双侧汇合的T2高信号。轴位T2-FLAIR图像显示一名遗传性线粒体脑肌病、乳酸性酸中毒和卒中样发作(MELAS)患者右侧颞叶皮质肿胀和T2高信号(D,箭头)。轴位T2-FLAIR图像显示一名疑似神经退行性痴呆患者双侧海马不成比例萎缩(E,箭头),其特征可能与阿尔茨海默病和路易体痴呆相一致。18F-氟脱氧葡萄糖正电子发射断层扫描显示葡萄糖摄取减少(正常,深蓝色/黑色;轻度还原,绿色;中度还原,黄色;严重减少,红色)在额颞顶区、楔前叶和后扣带回(F ),最可能是潜在的阿尔茨海默病,该患者患有隐匿性痴呆,脑脊液磷酸-Tau蛋白升高和脑脊液淀粉样蛋白-β 42低也提示该诊断。轴向扩散加权高信号(G,左图)和表观扩散系数低信号(G,右图)与一例尸检证实为克-雅病的患者的右侧尾状核和壳核的限制性扩散一致。(JAMA Neurol. 2023 Jan 1;80(1))
在过去二十年中发现的神经特异性自身抗体可以结合细胞表面的抗原(例如,N-甲基-d-天冬氨酸受体自身抗体),并且可能是致病的,针对抗体清除剂的治疗通常是成功的,而结合细胞内抗原的抗体(例如1型抗神经元核自身抗体(ANNA1或抗Hu))是T细胞介导的过程的标志,并且用T细胞清除免疫疗法治疗,具有可变的反应。癌症的检测和治疗(如果有的话)是必不可少的。大剂量皮质类固醇是大多数患者的初始治疗,当诊断不确定时,可以作为诊断试验。
当评估自身免疫性脑炎时,应考虑广泛的鉴别诊断,误诊发生在许多场合,包括专科中心。在这项研究中,提示替代诊断的危险信号包括隐匿性起病、非特异性血清抗体阳性和不符合自身免疫性脑炎诊断标准。自身免疫性脑炎误诊导致不必要的免疫治疗和正确诊断的延迟治疗的发病率。诊断AIE具有挑战性,因为患者可能表现出不太明显的脑炎症状。病程可以模拟神经退行性痴呆综合征。通常预期快速进展,但也有描述缓慢进展,导致误诊或治疗延迟,导致更差的结果。尚不清楚AIE有多像痴呆综合征。对于可能患有痴呆症的患者,临床线索对于医生来说是必不可少的,以避免误诊和无意中阻止患者接受免疫治疗。免疫治疗后重复认知测试有助于记录客观改善。对于有复发风险的患者,建议采用维持性免疫疗法。预后是可变的,但伴有细胞内抗原抗体的副肿瘤性ADE预后更差。该领域仍在发展,未来的研究将为诊断和治疗提供指导。
参考文献
Flanagan EP, et al. Autoimmune Encephalitis Misdiagnosis in Adults. JAMA Neurol. 2023 Jan 1;80(1):30-39. doi: 10.1001/jamaneurol.2022.4251.
Bastiaansen AEM, et al. Autoimmune Encephalitis Resembling Dementia Syndromes. Neurol Neuroimmunol Neuroinflamm. 2021 Aug 2;8(5):e1039. doi: 10.1212/NXI.0000000000001039.
Long JM, Day GS. Autoimmune Dementia. Semin Neurol. 2018 Jun;38(3):303-315. doi: 10.1055/s-0038-1660480.
Atzeni F, et al. Rheumatic diseases and autoimmune vascular dementia. Autoimmun Rev. 2017 Dec;16(12):1265-1269. doi: 10.1016/j.autrev.2017.10.011.
Banks SA, et al. Autoimmune encephalopathies presenting as dementia of subacute onset and rapid progression. Ther Adv Neurol Disord. 2021 Mar 19;14:1756286421998906. doi: 10.1177/1756286421998906.
Flanagan EP, et al. Autoimmune dementia and encephalopathy. Handb Clin Neurol. 2016;133:247-67. doi: 10.1016/B978-0-444-63432-0.00014-1.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







