川大华西应斌武团队《AHM》:硅酸铁纳米片+吲哚菁绿实现靶向肝癌治疗
2024-10-24 BioMed科技 BioMed科技 发表于上海
四川大学华西医院团队制备硅酸铁纳米片,具高比活性,与吲哚菁绿结合增强抗肿瘤治疗,体内外实验证实其效果及安全性。
近期,四川大学华西医院应斌武教授、孙旭平教授、朱帅汝博士、徐洪卫博士等人通过水热方法制备了硅酸铁(FeSi)纳米片,表现出比传统Fe3O4过氧化物酶(POD)更高的比活性。密度泛函理论计算表明,Si的引入增强了H2O2对Fe位点的吸附和解离,从而获得了优异的POD性能。进一步,我们将FeSi纳米片与吲哚菁绿(ICG)结合,以促进靶向聚集增强疗法。ICG的整合提高了FeSi纳米片在肿瘤组织中的渗透和保留,显著增加了其活性氧物种的产生,增强了治疗效果。此外,相比Fe3O4+ICG组,FeSi+ICG也表现出更好的治疗效果。相关工作以“Peroxidase-Mimetic Iron Silicate Nanosheets Coordinated with Indocyanine Green for Enhanced Anti-Tumor Therapy”为题发表在Advanced Healthcare Materials。

【图文赏析】
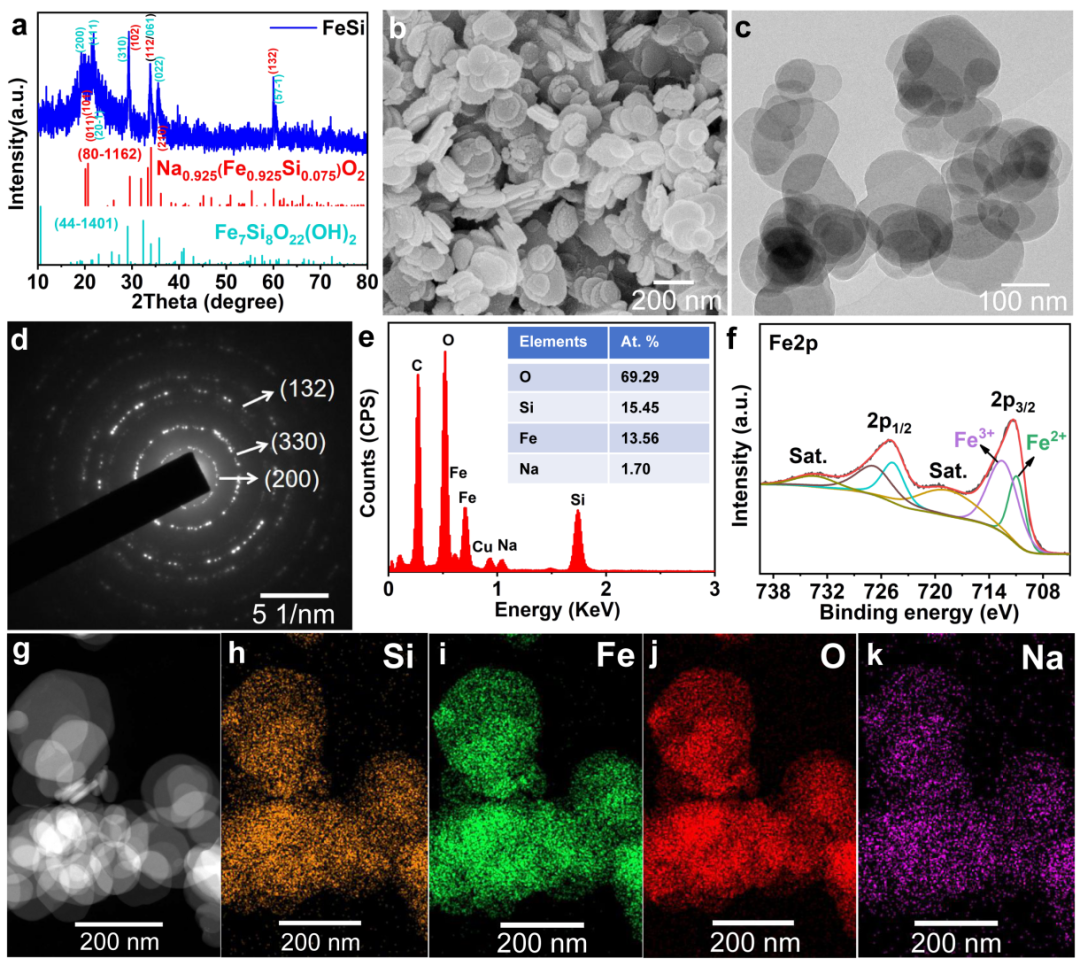
图1. FeSi样品的(a)XRD图,(b) SEM图,(c)TEM图,(d)SAED图,(e)EDS谱图,(f)Fe 2p XPS光谱和(g-k)元素分布图。
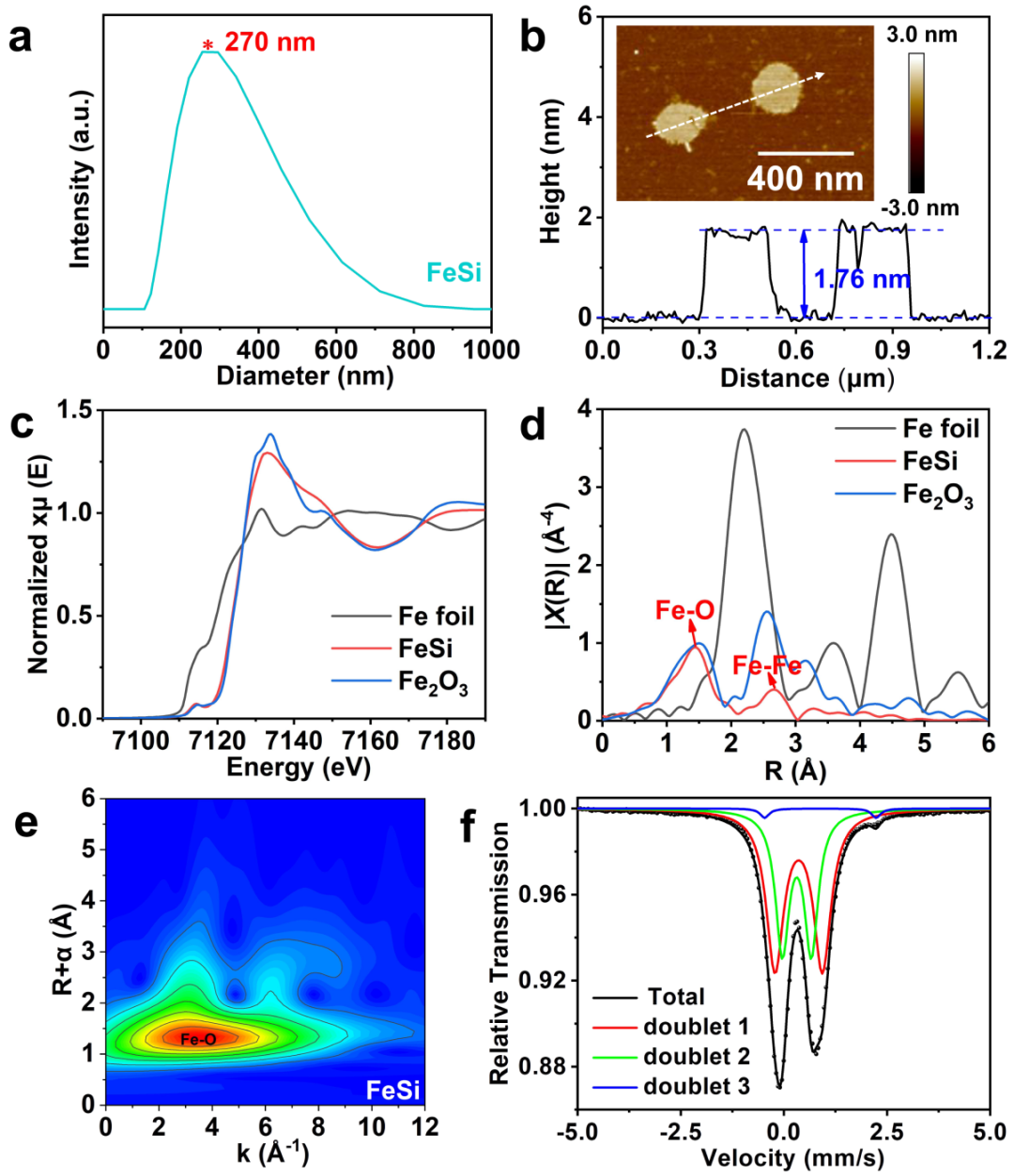
图2. FeSi纳米片的(a)粒径分布,(b)高度轮廓,(c)Fe K-edge XANES光谱,(d)R空间FT-EXAFS光谱,(e)小波变换图,(f)室温Mössbauer光谱。
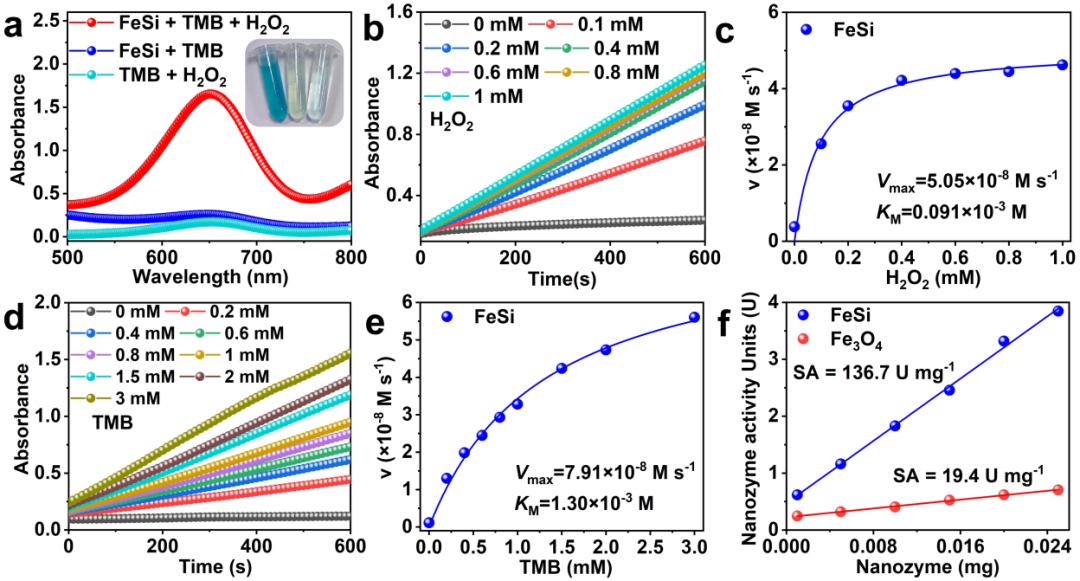
图3.(a)在不同反应体系(0.2 M NaAc/HAc缓冲液(pH=3.5),1 mM TMB,加或不加25 µg mL-1 FeSi和1 mM H2O2)中的吸光度光谱和视觉颜色变化。(b, d)不同体系在652 nm处的时间依靠吸收光谱。(c)以H2O2为底物和(e)以TMB为底物的Michaelis-Menten曲线。(f)比较FeSi和Fe3O4纳米酶的比活(U mg-1)。1个纳米酶活性单位(U)定义为每分钟催化1 μmol产物的纳米酶量。
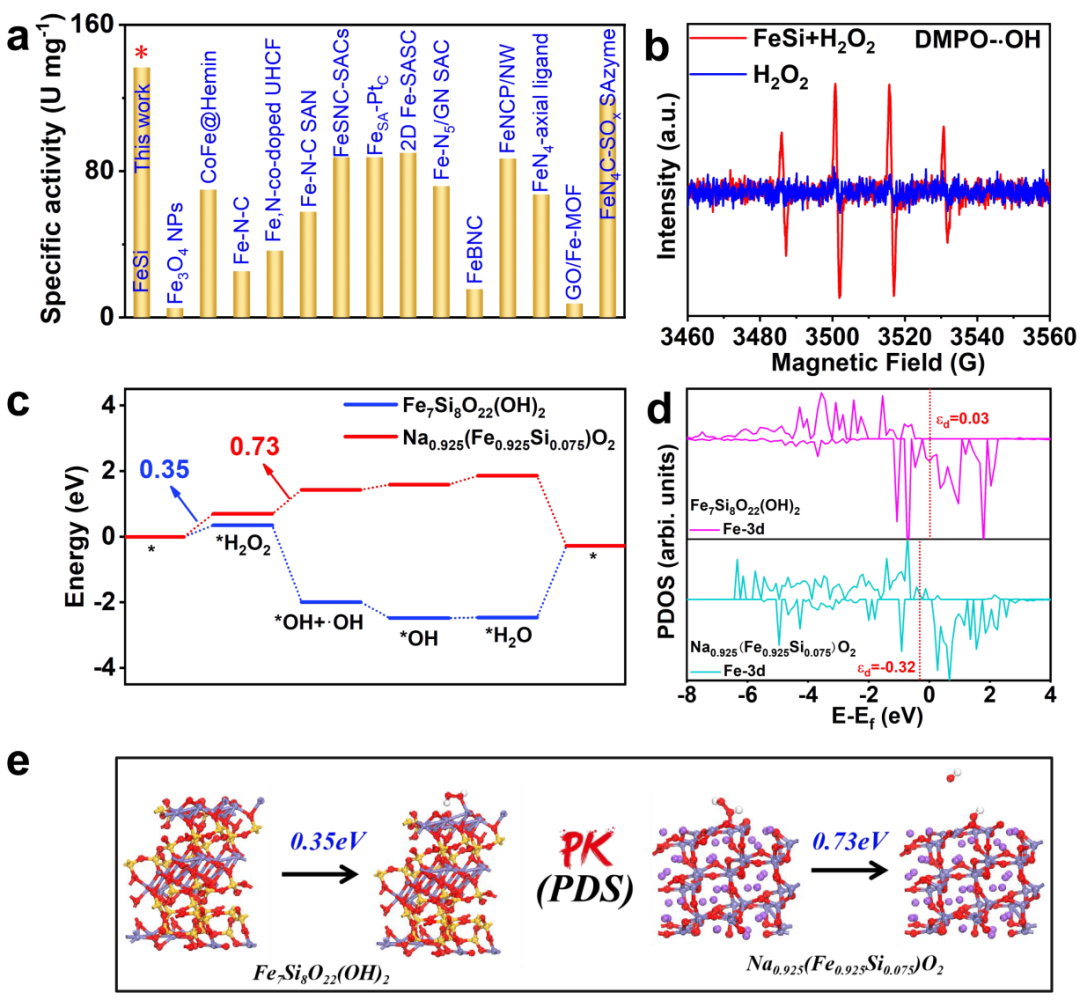
图4.(a)不同铁基POD纳米酶比活性(U mg-1)比较。(b)在pH=3.5的0.2 M NaAc/HAc缓冲液中使用DMPO作为诱捕剂获得FeSi的ESR光谱。(c)Fe7Si8O22(OH)2和Na0.925(Fe0.925Si0.075)O2的自由能图。(d)Fe7Si8O22(OH)2和Na0.925(Fe0.925Si0.075)O2的Fe d轨道的态密度分布。(e)Fe7Si8O22(OH)2和Na0.925(Fe0.925Si0.075)O2的化学结构和潜在决速步骤(PDS)所需能量示意图。
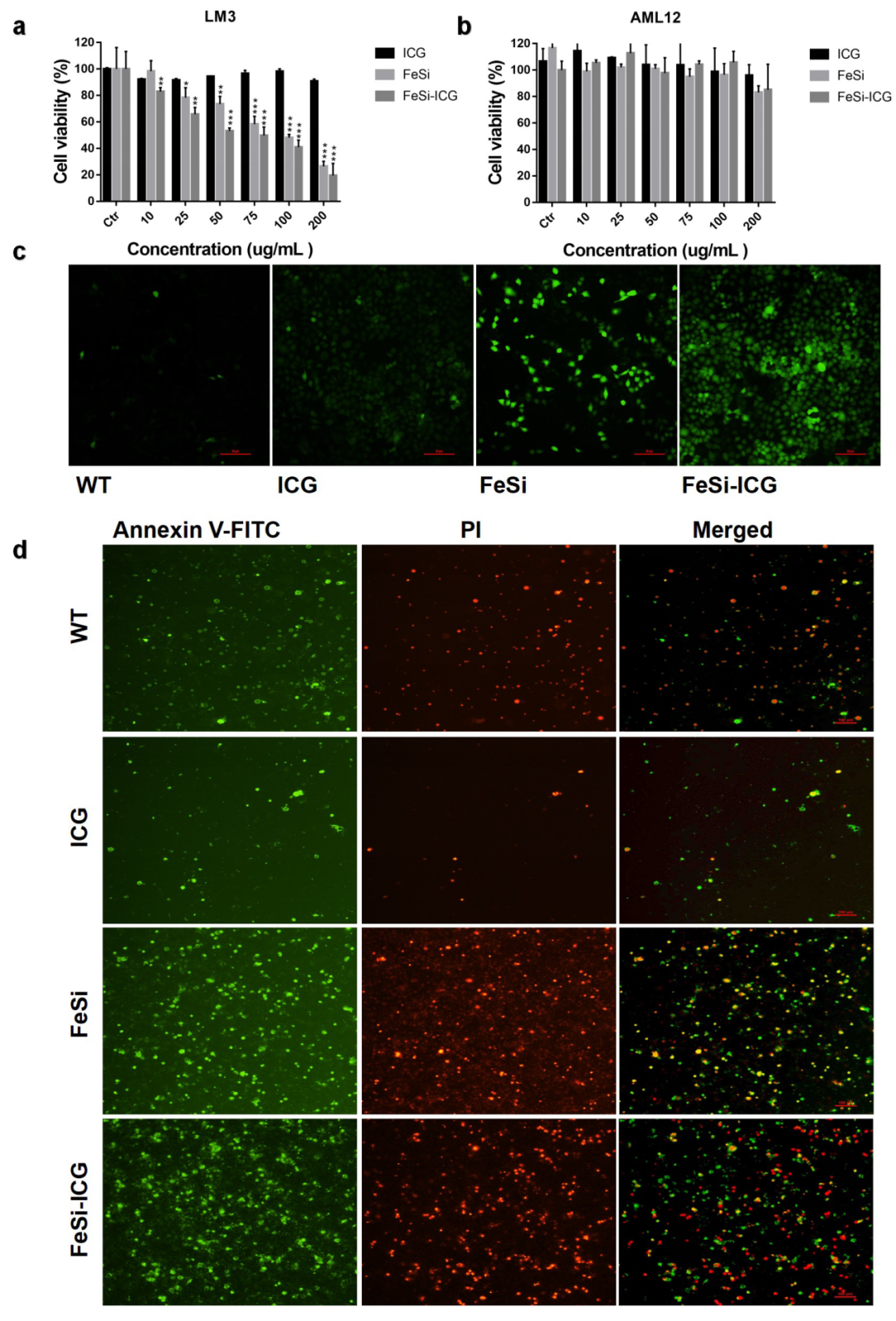
图5. FeSi纳米片的体外抗肿瘤作用。(a)不同浓度ICG、FeSi和FeSi-ICG孵育LM3细胞系24 h后的细胞活力(数据以均值±标准差表示,n=3)。(b)不同浓度ICG、FeSi和FeSi-ICG孵育AML12细胞系24 h后的细胞活力(数据以均值±标准差表示,n=3)。(c)ICG、FeSi和FeSi-ICG孵育LM3细胞系24 h后的ROS水平。比例尺= 50 µm。(d)采用Annexin V-FITC和碘化丙啶(PI)荧光染色检测ICG、FeSi和FeSi-ICG孵育LM3细胞系24 h后的凋亡情况。比例尺= 100 µm。*p < 0.05, **p < 0.01, ***p < 0.001。
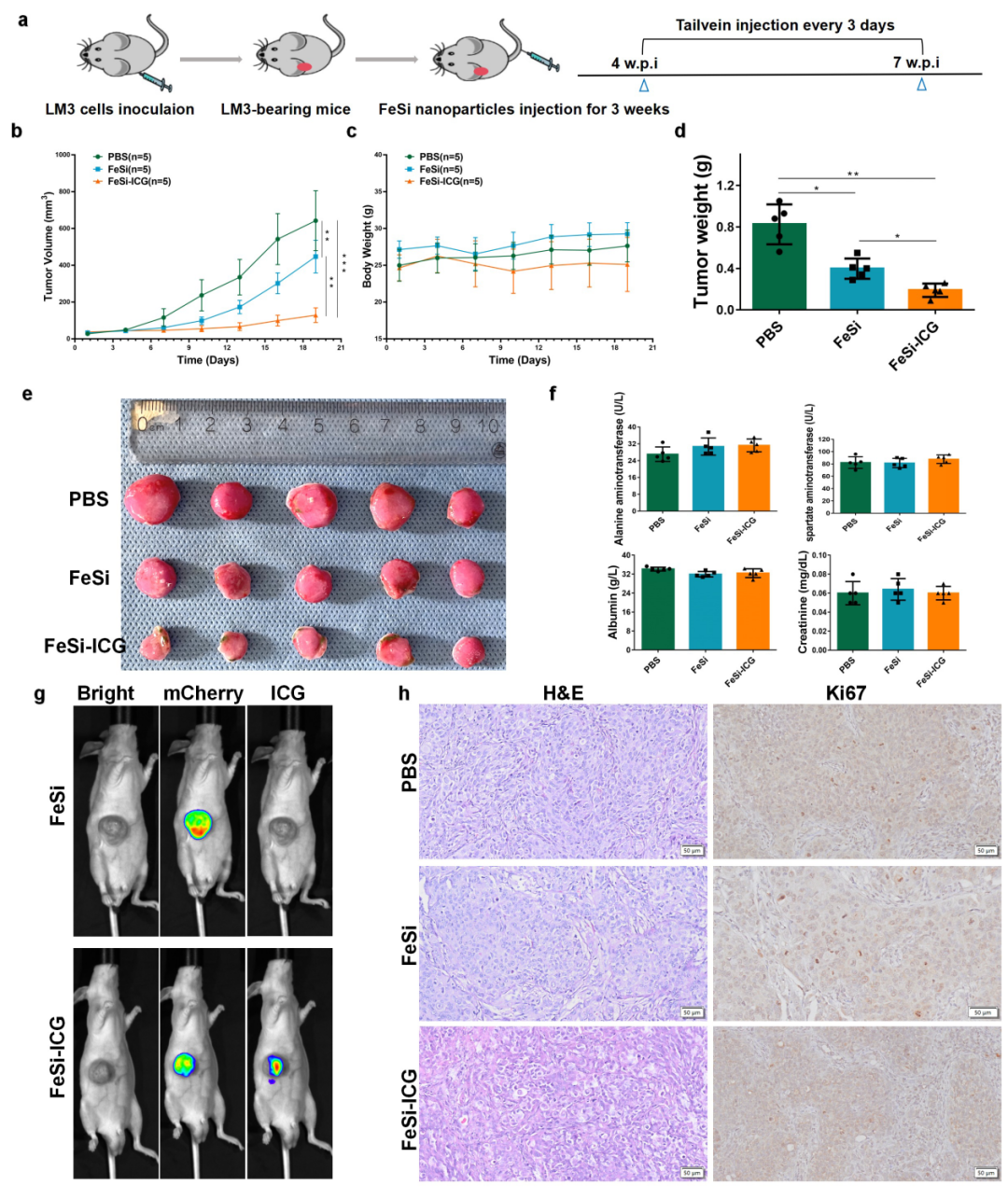
图6. FeSi纳米片在体内的抗肿瘤作用。(a)治疗设计示意图。w.p.i.,注射后几周。(b)每3天测量不同治疗组小鼠的肿瘤体积变化(数据以平均值±标准差表示,n=5)。(c)每3天测量不同治疗组小鼠的体重变化(数据以平均值±标准差表示,n=5)。(d)在实验结束时测量不同治疗组小鼠的肿瘤重量变化(数据以平均值±标准差表示,n=5)。(e)不同治疗组小鼠肿瘤大体图像(n=5)。(f)不同治疗组小鼠的丙氨酸氨基转移酶、天冬氨酸氨基转移酶、白蛋白和肌酐水平(数据以平均值±标准差表示,n=5)。(g)FeSi处理和FeSi-ICG注射后48h小鼠的明亮视野、mCherry荧光和ICG荧光。(h)不同治疗组肿瘤的H&E和Ki67染色情况。比例尺= 50 µm。*p < 0.05, **p < 0.01, ***p < 0.001。
【结论与展望】
综上所述,我们成功地合成了具有POD活性的FeSi纳米片,通过增强ROS的生成促进了有效的抗肿瘤治疗。DFT计算表明Fe7Si8O22(OH)2相是产生POD性质的主要活性材料。体内外实验均证实FeSi纳米片能有效抑制肝癌细胞增殖,同时保留正常肝组织和生理功能,具有良好的生物相容性和生物安全性。通过ICG修饰对肝癌细胞的特异性靶向进一步增强了FeSi纳米酶的抗肿瘤效果,为肝癌的临床治疗提供了良好的前景。
四川大学华西医院应斌武教授和电子科技大学(现四川大学华西医院)孙旭平教授为该论文的共同通讯作者,四川大学华西医院朱帅汝博士和四川大学华西医院徐洪卫博士为本论文的共同第一作者。本研究受到国家自然科学基金区域创新与发展基金、国家自然科学基金、四川省自然科学基金、宁波市自然科学基金、华西医院博士后科研基金等项目资助。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adhm.202403002
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肝癌# #吲哚菁绿# #硅酸铁纳米片#
71