JACS:罗成/王方军等报道小分子抑制剂诱导的CDK-Cyclin K变构激活解离新机制
2023-05-25 精准药物 网络 发表于上海
小分子抑制剂诱导的CDK-Cyclin K变构激活解离新机制。
近日,中国科学院上海药物研究所药物发现与设计中心罗成研究员团队与大连化物所生物技术研究部生物分子结构表征新方法研究组王方军研究员团队合作,通过整合赖氨酸反应性分析质谱(LRP-MS)和非变性质谱(nMS)的结构质谱策略,发现了小分子抑制剂SR-4835诱导细胞周期蛋白依赖性激酶12/13-细胞周期蛋白K复合物(CDK12/CDK13-Cyclin K)变构激活解离的抑制新机制,为CDK12/CDK13小分子抑制剂的理性设计开拓了新思路。
2023年5月19日,该工作以“Structural Mass Spectrometry Probes the Inhibitor-Induced Allosteric Activation of CDK12/CDK13-Cyclin K Dissociation”为题,发表在《美国化学会志》(Journal of the American Chemical Society)上。

CDK12和CDK13在转录和mRNA加工中发挥重要的调节作用,靶向抑制CDK12和CDK13已在体外模型中被证明是多种癌症治疗的有效手段。但是还没有CDK12/CDK13的小分子抑制剂被批准在临床使用。目前仍然缺乏对小分子抑制动态相互作用分子机制进行高通量表征的方法,极大限制了CDK12/CDK13抑制剂的理性设计和相关药物研发。
在本工作中,合作团队发展了整合LRP-MS和nMS的结构质谱策略,系统研究了多种小分子抑制剂调控下CDK12/CDK13-Cyclin K复合物的动态构象变化和整体蛋白组装。研究团队通过前期发展的LRP-MS策略获得了包括抑制剂结合口袋、结合强度、界面分子细节和动态构象变化在内的分子作用结构信息;发现SR-4835能够使CDK12/CDK13-Cyclin K相互作用界面赖氨酸标记反应性(溶剂可及性)显著增大,推测其诱导了CDK12/CDK13-Cyclin K复合物的解离。
进一步,利用自主研发的高灵敏度静态电喷雾离子源和nMS分析证明了SR-4835能够有效减弱CDK12/CDK13-Cyclin K的相互作用,并通过免疫共沉淀试验在活体细胞水平进行了验证。相关研究结果展示了LRP-MS整合nMS在分子水平评估和理性设计激酶抑制剂的巨大潜力。
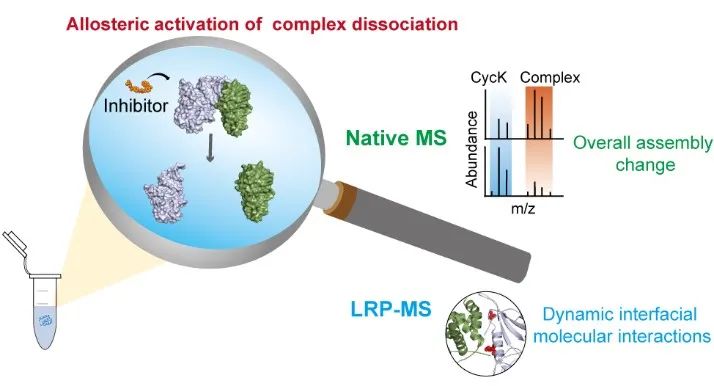
图1. 赖氨酸反应性分析质谱研究CDK12/CDK13-Cyclin K变构机制
王方军团队致力于发展生物大分子质谱新仪器和新方法,在大连相干光源搭建了高能紫外激光解离—串联质谱仪器,已在蛋白质及其复合物动态结构和相互作用的质谱分析中取得了系列研究进展(J. Am. Chem. Soc.,2023;Cell Chem. Biol.,2022;CCS Chem.,2022;Chem. Sci.,2021)。罗成团队基于药物设计和化学生物学技术,在蛋白质动态调控与创新药物早期发现取得系列研究进展(Nature, 2021; Cancer Cell, 2023; Nature Communi, 2022等)。
该工作的共同第一作者为大连化物所1822组联合培养硕士研究生白玉、刘哲益副研究员以及南京中医药大学/上海药物研究所联合培养博士研究生李元卿。该工作的通讯作者为王方军研究员与罗成研究员。项目获得科技部前沿生物重点专项、基金委、中科院和临港实验室等项目的资助。
全文链接
https://pubs.acs.org/doi/10.1021/jacs.3c01697
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言