FDA拒绝信迪利单抗用于治疗NSCLC
2022-03-27 Allan MedSci原创
FDA 咨询委员会投票决定礼来公司及其合作伙伴信达生物公司应该对信迪利单抗(Sintilimab)进行更多试验。
信迪利单抗(Sintilimab)已在中国以 Tyvyt 的名义获批,用于一线治疗非鳞状非小细胞肺癌,以及三线治疗复发或难治性经典霍奇金淋巴瘤。礼来(Eli Lilly)和 信达生物(Innovent)最初于 2015 年合作开发信迪利单抗,后来该交易扩大到包括中国以外的市场。该疗法正在各种癌症类型中进行评估,并且还在中国接受监管审查,用于其他适应症,包括一线鳞状非小细胞肺癌。
礼来(Eli Lilly)近日宣布,FDA 发布了一份完整的回复信( CRL ),内容涉及寻求批准信替利单抗用于某些非小细胞肺癌(NSCLC)患者的上市申请。此前,该机构的科学家表示,一项用于支持该申请的中国研究存在若干缺陷,其结果不适用于美国患者,而随后的 FDA 咨询委员会投票决定礼来公司及其合作伙伴信达生物公司应该对信迪利单抗(Sintilimab)进行更多试验。
两家公司正在寻求批准信迪利单抗与化疗联合用于一线治疗成人 IIIB、IIIC 或 IV 期非鳞状非小细胞肺癌。该申请基于 III 期 ORIENT-11 试验的结果,这一试验完全在中国进行。共有 397 名既往未经治疗、局部晚期或转移性非鳞状 NSCLC 患者随机(2:1 比例)接受 200 mg 信迪利单抗或安慰剂联合培美曲塞和铂类,每 3 周一次,共 4 次,然后是信迪利单抗或安慰剂联合培美曲塞治疗。允许超出疾病进展的交叉或治疗。主要终点是由独立审查委员会判断的无进展生存期(PFS)。截至 2019 年 11 月 15 日,中位随访 8.9 个月。信迪利单抗联合组的中位 PFS 显著长于安慰剂联合组(8.9 vs. 5.0 个月,p < 0.00001)(图1)。信迪利单抗联合组和安慰剂联合组的客观缓解率分别为 51.9%(95% CI:45.7%–58.0%)和 29.8%(95% CI:22.1%–38.4%)。
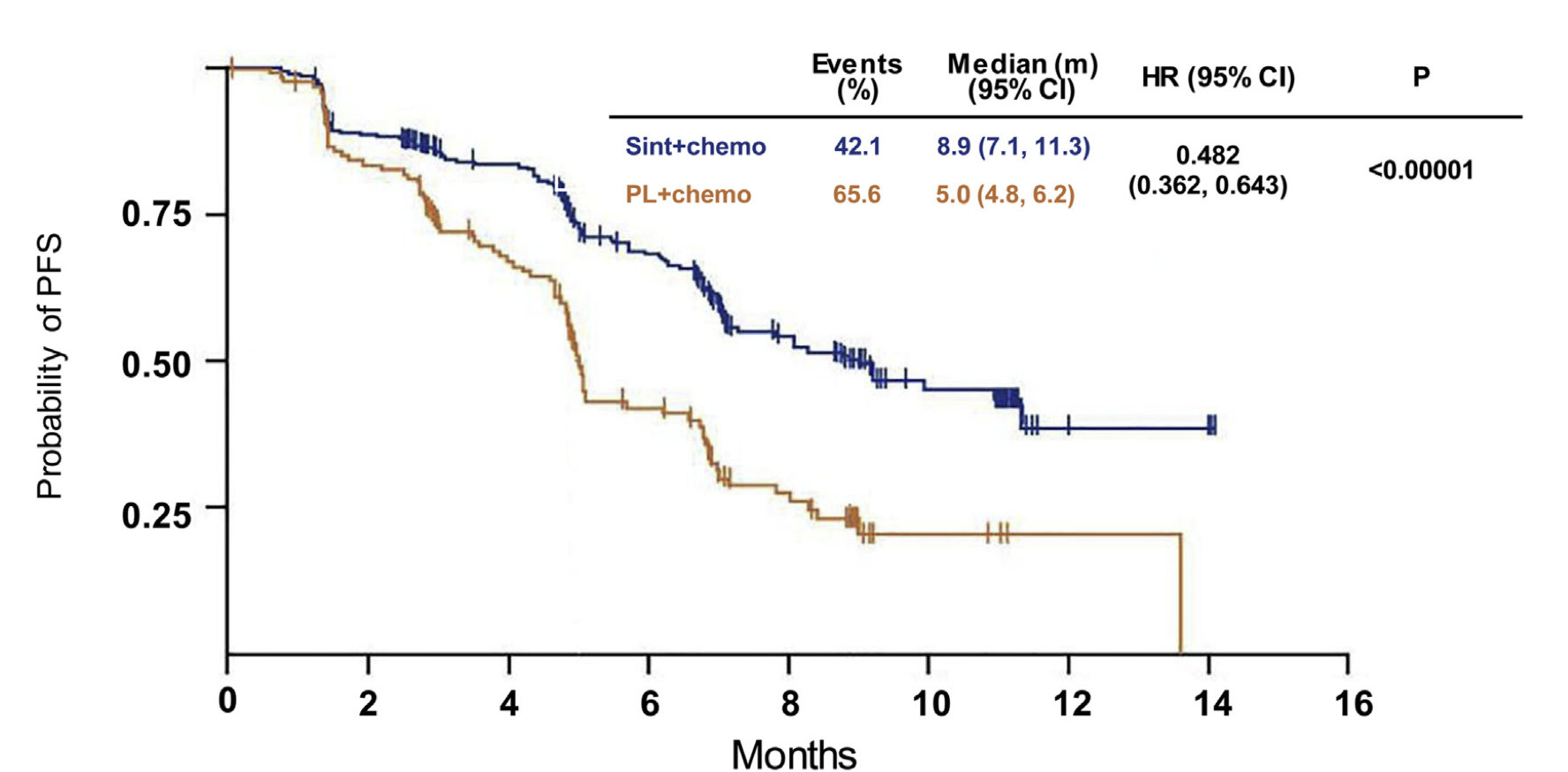
图1.信迪利单抗联合组和安慰剂联合组的PFS
据礼来(Eli Lilly)称,CRL 包括一项额外临床研究的建议,特别是一项多区域试验,将一线转移性非小细胞肺癌的标准治疗与信迪利单抗联合化疗进行比较。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#信迪利单抗##FDA#
118
值得学习
92