Front Immunol:类风湿性关节炎中调节性T细胞的作用
2022-09-06 小药说药 小药说药
调节性T细胞在自身免疫性疾病相关的研究中引起了越来越多的关注,类风湿性关节炎也不例外。Treg具有免疫抑制特性,在RA的发病机制和发现可能的治疗靶点方面具有重要意义。
虽然RA的发病机制复杂,涉及许多因素的相互作用,但调节性T细胞(Treg)在疾病发展和进展中的作用越来越受到关注。作为辅助性T细胞的一个特殊亚群,Treg在维持体内平衡和自我耐受方面起着重要作用,防止自身免疫性疾病的发展。RA患者的Treg细胞以功能受损和表型改变为特征。它们显示出对Th17细胞的可塑性增加,抑制能力降低。除了Treg细胞的抑制功能外,它们的有效性还取决于它们迁移到炎症组织中的能力。随着越来越多的关于Treg细胞在自身免疫疾病方面作用机制理解的增加,靶向Treg治疗自身免疫疾病显示出良好的前景。
RA临床表现为双侧隐匿性多关节对称性关节炎。患者在受影响的关节,主要是掌指关节、跖指关节和近端指间关节以及腕部出现疼痛和软性渗出性肿胀。然而,RA不仅限于小关节,也会影响踝关节、膝关节、肘关节和肩关节。虽然关节受累是RA相关的典型表现,但治疗不当可能导致许多关节外表现,包括但不限于心血管疾病、间质性肺病和肝功能障碍。
类风湿性关节炎确切的发病机制不明,主流的观点认为是多因素机制。各种环境因素在RA易感性中起作用,吸烟被确定为与RA发展相关的最重要的环境风险因素,其他因素包括维生素D缺乏以及职业性粉尘暴露等。此外,通过全基因组关联研究(GWAS)和荟萃分析,发现RA易感性也与主要组织相容性复合体(MHC)遗传变异相关。例如,已发现HLA-DRB1基因型与CD4+T细胞上CXCR4表达增加相关,这是一种参与细胞迁移的蛋白,导致持续的自身免疫和局部炎症,从而增加RA发展的风险。
目前,已有针对5个生物靶标的治疗方法获得FDA批准,用于治疗RA患者的不同亚群。
CD4+调节性T细胞是一种独特的T细胞亚群,参与维持和调节自身耐受和稳态。首次发现于1995年,Tregs占CD4+T细胞总数的5-10%,其特征是CD4、CD25、FOXP3和低水平CD127的共同表达。高水平的FOXP3和特异性去甲基化区域(TSDR)的去甲基化是Treg的显著特征,TSDR是FOXP3基因中的一个保守区域。
Tregs分为胸腺来源的Tregs(tTregs)和外周来源的Tregs(pTregs)。在T细胞发育过程中,接受中间TCR信号的原始CD4+T细胞被驱动分化成Treg细胞,这种信号强度的大小差异决定原始T细胞分化为常规T细胞还是调节性T细胞。此外, FOXP3-的常规T细胞在接受对非自身抗原的反复刺激或暴露于IL-10和TGF-β时,也会转变为Treg细胞。
Treg通过不同的机制抑制免疫系统,包括接触依赖性机制,例如通过CTLA-4,以及非接触依赖性机制,例如释放细胞因子,如IL-35或IL-10。鉴于Tregs在预防自身免疫性疾病方面的作用,Tregs在促进免疫耐受方面具有明显的潜力和很好的应用前景。
随着不断扩大的对调节性T细胞的认识,它们对类风湿性关节炎的作用越来越重要。调节性T细胞具有免疫抑制作用,不仅在RA的发病机制中发挥关键作用,还可以为可能的治疗方式提供有价值的见解。
尽管有争议,但普遍共识是类风湿性关节炎患者的调节性T细胞水平降低,这与Treg的一般抗炎作用一致。研究表明,与缓解期RA患者相比,活动期RA患者外周血中Treg的比例显著降低,部分原因可能是由于活动性RA中通过滑膜炎症过程产生的缺氧环境。有趣的是,已经证明,缺氧和随后诱导的缺氧诱导因子1α(HIF-1α)表达促进了FoxP3转录的诱导,进而促进了Treg的生成。此外,发炎关节的CD4+CD25+T细胞表达高水平的CTLA-4、GITR、CD69和MHC II类分子,表明处于激活状态。
研究表明,类风湿性关节炎患者的滑膜Treg功能有缺陷,不仅不能抑制其他CD4+T细胞和单核细胞产生促炎细胞因子,如TNF-α和IFN-γ,也不能抑制T效应细胞增殖。将CD4+CD25+T细胞过继转移到RA小鼠中显示出疾病严重程度的降低,突出了Treg在控制关节异常炎症反应中的重要性。此外,RA症状的严重性以及高水平的类风湿因子(RF)和抗CCP抗体与人类中较低数量的活化Treg有关。
Treg和Th17细胞的相互作用在RA的发病机制中起着非常重要的作用。通过产生和分泌多种细胞因子,如IL-17A、IL-17F和IL-22,已证明Th17细胞可刺激滑膜成纤维细胞和巨噬细胞大量产生促炎介质,如IL-1、IL-6、TNF-α和PGE2,从而恶化滑膜炎症。此外,Th17细胞刺激滑膜基质细胞和固有淋巴细胞分泌GM-CSF,从而引发和加剧关节炎症。
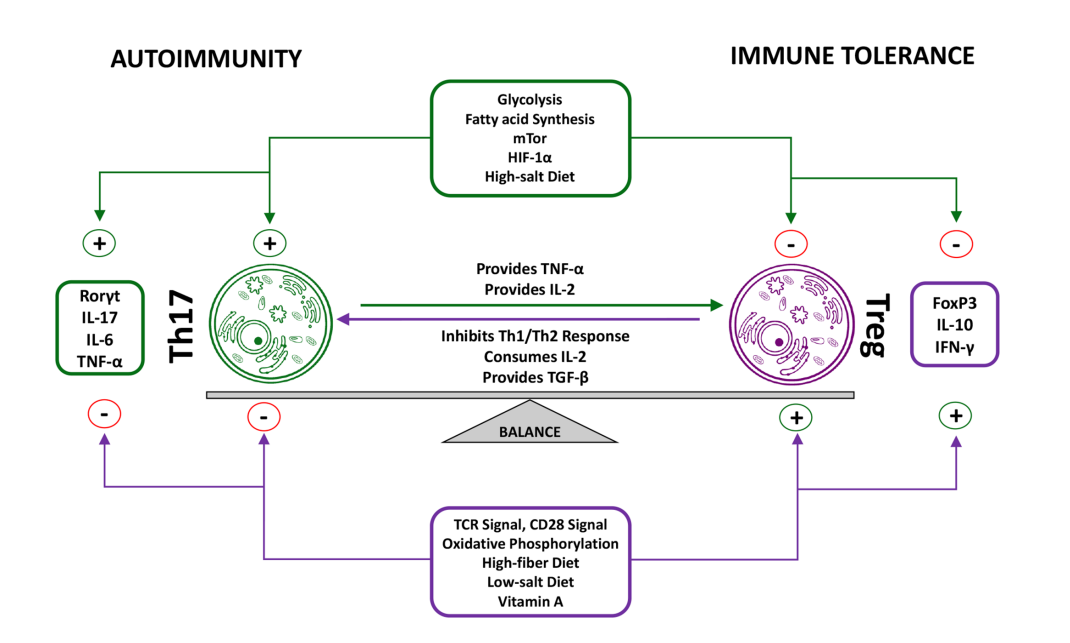
许多研究表明,与健康对照相比,类风湿性关节炎患者的Th17/Treg比值偏向于Th17细胞。Szodoray等人跟踪了患者从未分化结缔组织病(UCTD)发展为最终系统性自身免疫病(SIAD)时的Th17/Treg比率。从健康对照到UCTD再到SIAD,Th17/Treg比率持续增加。Treg细胞和Th17细胞之间的平衡受到各种因素的影响,包括维生素A、糖酵解、盐浓度和细胞因子等。
Th17/Treg比率已成为开发可能的治疗方法的一个关注领域,不仅可以治疗RA,还可以治疗涉及Th17/Treg失调的一系列自身免疫疾病。某些影响Th17/Treg平衡的药物已经存在,例如IL-6受体抑制剂Tocilizumab。
IL-6能够降低T细胞迁移的重要调节因子-血管舒张剂激活磷蛋白(VASP)的磷酸化水平,因此能够干扰Treg向炎症部位的迁移,从而影响Treg的抑制作用。有趣的是,这种干扰是调节性T细胞独有的,CD4+效应T细胞迁移不受影响。这种效应仅在RA患者中观察到,而在健康对照组中没有观察到。
VASP作为Ena/VASP家族的一员,是一种细胞骨架效应蛋白,参与协调单体肌动蛋白向肌动蛋白丝端的募集,在细胞迁移中发挥重要作用。与使用IL-6受体阻滞剂治疗的RA患者相比,未治疗RA患者的IL-6上调以及VASP磷酸化降低。此外,IL-6受体阻滞剂治疗能够增加RA患者外周血中Treg的频率。VASP磷酸化也对基因组水平有影响,低p-VASP表达与整合素介导的信号传导、整合素结合、白细胞迁移、细胞基质粘附、上皮细胞迁移、基质粘附细胞的扩散以及细胞增殖的调节相关。这些结果表明,由不同IL-6/IL-6R水平调节的VASP的磷酸化对RA患者的蛋白质组学和基因组稳态都具有重要意义,使其成为RA治疗中一个有趣的靶点。
G蛋白信号调节蛋白2(GPSM2),也称为LGN,参与G蛋白偶联受体功能的调节。GPSM2与细胞分裂和细胞周期的调节以及正常听力的发展密切相关。GPSM2突变已被证明会导致非综合征性听力损失和耳聋,同时发现恶性细胞的细胞迁移,表明GPSM2在异常细胞迁移中的作用。
最近,观察到GPSM2通过改变Treg迁移参与RA的发病机制,这扩大了对GPSM2功能的理解。研究表明,与健康对照组相比,来自RA患者的CD4+T细胞中GPSM2的磷酸化水平降低,在小鼠的自身免疫性关节炎模型中也显著下调。有趣的是,用抗IL-6R抗体治疗可恢复RA患者CD4+T细胞中GPSM2的磷酸化水平。
调节性T细胞在自身免疫性疾病相关的研究中引起了越来越多的关注,类风湿性关节炎也不例外。Treg具有免疫抑制特性,在RA的发病机制和发现可能的治疗靶点方面具有重要意义。
许多趋化因子和细胞因子都影响调节性T细胞,与RA的发生和发展有关。这些包括促炎细胞因子,如IL-6、IL-17、IL-1和TNF-α,以及抗炎细胞因子,例如IL-4和TGF-β。趋化因子如CXCL5和CCL2等与也调节性T细胞相关,与RA疾病活动密切相关。此外,RA的特征是调节性T细胞迁移到炎症部位的能力改变,部分原因是由于翻译后修饰和磷酸化状态改变导致GPSM2和VASP活性缺乏。
其中许多靶向细胞因子及其受体的单克隆抗体,如Infliximab、Adalimumab,Tocilizumab等以及用于治疗RA。随着我们对类风湿性关节炎和调节性T细胞的理解不断增长,未来治疗的潜在靶点也将不断增长。这种不断增长的理解也许有一天能够帮助我们在需要治疗之前就可以预防RA的发作。
参考文献:
1.Migration and homeostasis of regulatory T cells in rheumatoid arthritis. Front Immunol.2022; 13: 947636.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#关节炎#
96
#类风湿#
144
#风湿性关节炎#
75