Cancer Res:南方医科大学董忠谊团队发现PARP抑制诱导LKB1突变型肺癌的合成致死率和适应性免疫
2022-12-24 iNature iNature 发表于江苏省
在LKB1突变的非小细胞肺癌(NSCLC)中,突变负担升高和“寒冷”的肿瘤微环境(TME)之前存在矛盾。
在LKB1突变的非小细胞肺癌(NSCLC)中,突变负担升高和“寒冷”的肿瘤微环境(TME)之前存在矛盾。目前对这一矛盾特征的分子基础和治疗策略相关研究较为缺乏。
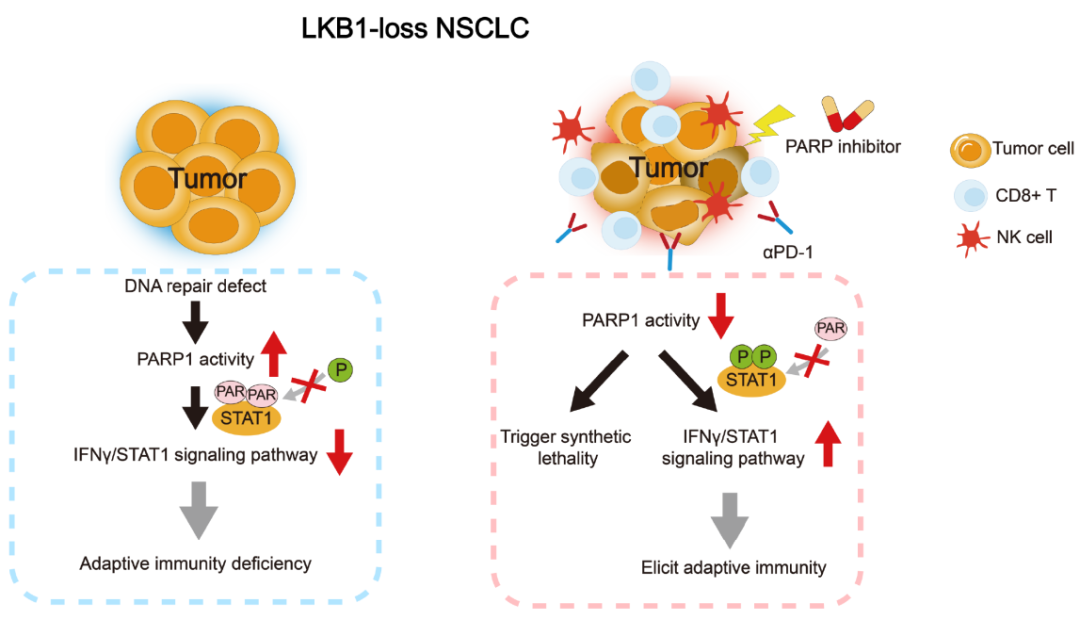
2022年12月13日,南方医科大学董忠谊团队在Cancer Research 上在线发表题为“PARP inhibition induces synthetic lethality and adaptive immunity in LKB1-mutant lung cancer”的研究论文,该研究通过绘制Kras和Kras/Lkb1驱动的肺肿瘤基因工程小鼠模型的单细胞转录组图谱,检测到Kras/Lkb1驱动的肿瘤中肿瘤内源性IFNγ信号通路受损,这解释了惰性免疫环境。机制分析表明,突变LKB1导致DNA损伤修复过程缺失,PARP1异常激活。过度激活的PARP1通过与STAT1的多聚(ADP -核糖化)物理相互作用和增强,削弱了IFN - γ通路,损害了其磷酸化和激活。
在LKB1突变介导的DNA修复缺陷的基础上,PARP1驱动程序的废除引发了NSCLC的合成致死性,同时也恢复了磷酸化的STAT1,以支持免疫“热”TME。因此,PARP1抑制恢复了中断的IFN-γ信号,从而在多个Lkb1缺陷的小鼠肿瘤模型中建立了适应性免疫反应,并与PD-1阻断发挥协同作用。总之,该研究揭示了DNA修复过程和适应性免疫反应之间未被探索的相互作用,为双重抑制PARP1和PD-1治疗LKB1突变NSCLC提供了重要信息。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







