PNAS:益生菌显奇效!王锋团队报道双歧杆菌可缓解癌症免疫治疗副作用
2020-10-22 丁香学术 Bio生物世界
免疫检查点阻断作为有效的肿瘤免疫治疗手段,近年在临床应用上取得突破性进展。但针对 CTLA-4 和 PD-1 等免疫检查点的抑制剂提升抗肿瘤效力的同时,打破了免疫平衡,并由此引危及生命的自身免疫反应。
免疫检查点阻断作为有效的肿瘤免疫治疗手段,近年在临床应用上取得突破性进展。但针对 CTLA-4 和 PD-1 等免疫检查点的抑制剂在提升抗肿瘤效力的同时,也打破了免疫平衡,并由此引起各种甚至会危及生命的自身免疫反应,其中腹泻和结肠炎是最常见和最严重的疾病之一。
双歧杆菌(Bifidobacterium)是食品中最常见的益生菌之一,近几年来频繁被各大商家当作买点,既往的研究已经发现双歧杆菌具有调节肠道功能、增强免疫力等作用,那么双歧杆菌是否可能在免疫检查点抑制剂诱导的肠炎中也发挥积极的作用呢?
2020 年10月19日,上海交通大学医学院王锋团队在 PNAS 上在线发表了题为:Bifidobacterium alters the gut microbiota and modulates the functional metabolism of T regulatory cells in the context of immune checkpoint blockade 的研究论文。
该研究发现,双歧杆菌在免疫检查点CTLA-4阻断条件下可以优化共生菌群的组成,并增强肠道调节性T细胞( Treg )的功能与代谢,从而缓解抗CTLA-4抗体诱导的肠道炎症。
作者的前期研究发现双歧杆菌在 CTLA-4 诱导的免疫病理反应中发挥的调节作用需要 Treg 细胞的参与,因此作者首先探究了 Treg 细胞是否直接影响肠道微生物组成。
作者首先用双歧杆菌混合物处理小鼠,结果发现小鼠肠道菌群中不仅双歧杆菌的丰度增加了,乳酸杆菌等多种细菌的丰度也显着增加。然而在 Treg 细胞缺失小鼠中,双歧杆菌无法定殖和增加其他益生菌含量。由此揭示肠道免疫状态决定双歧杆菌与其他共生菌的传递关系,最终贡献于肠道稳态维持。
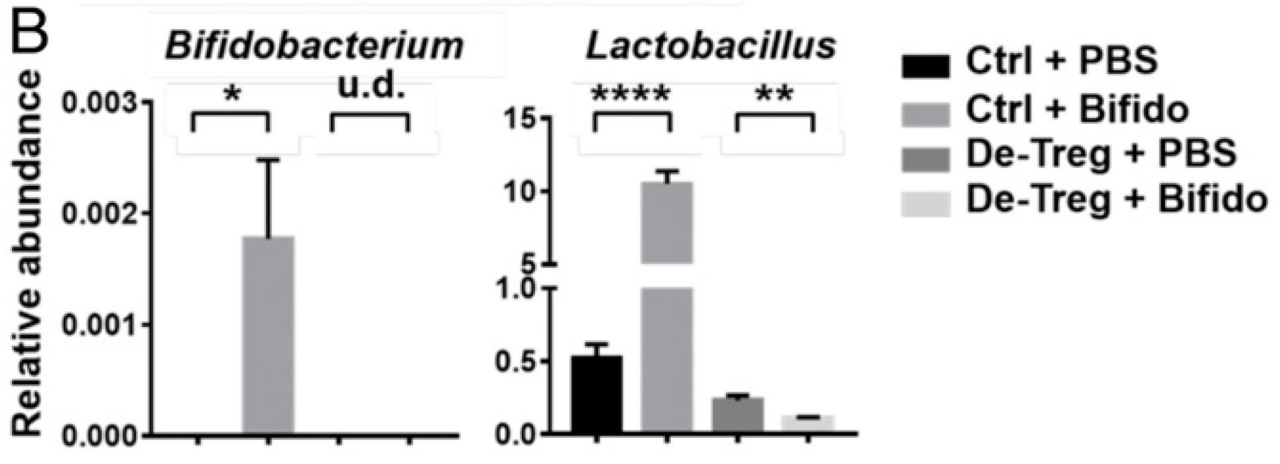
接下来,作者从先前实验中使用的四种双歧杆菌的混合物中单独测试了每种双歧杆菌菌株的作用,结果发现只有短双歧杆菌可以缓解结肠炎小鼠的症状。由于作者发现双歧杆菌和乳杆菌属的丰度在属水平上具有相关性,因此作者又用不同的乳杆菌菌株进行了实验,发现鼠李糖乳杆菌可减轻结肠炎小鼠的症状。
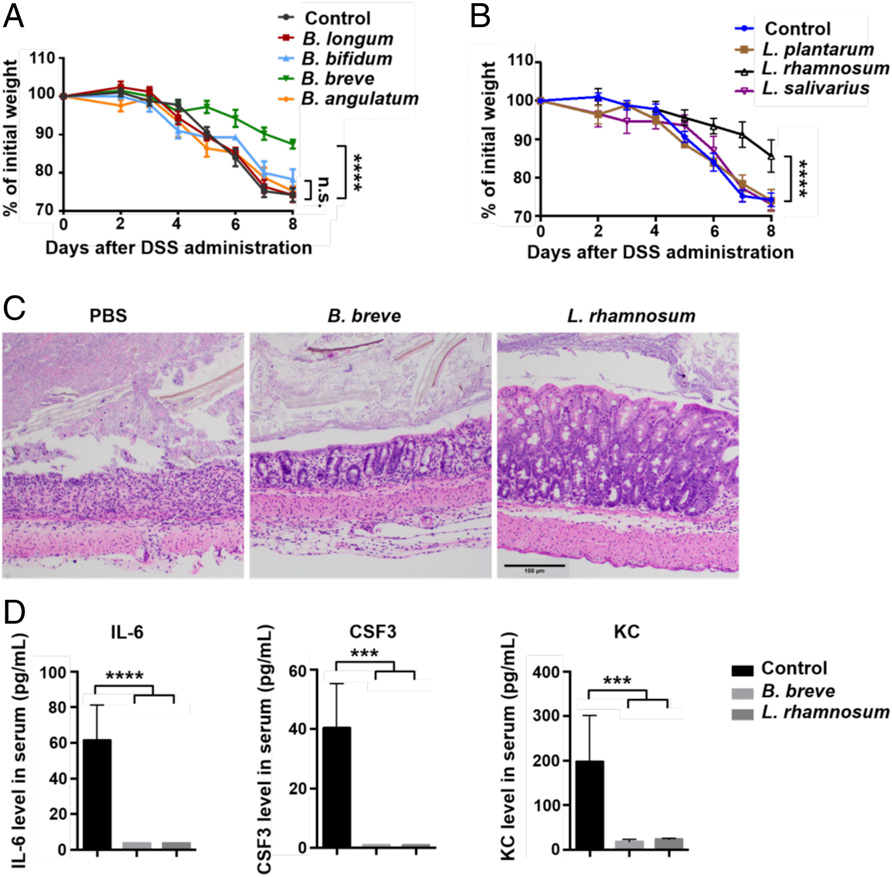
紧接着,作者研究了双歧杆菌对肠道 Treg 细胞的影响。作者分析了双歧杆菌处理和 PBS 处理小鼠的结肠固有层中 Treg 细胞的基因表达模式,结果发现双歧杆菌处理增加了 Il10rα,Cxcr5 和 Il17rα 等炎症相关基因的表达。 流式细胞术进一步证实双歧杆菌处理后结肠固有层中 Treg 细胞的 IL-10Rα 和 IL-10 的表达增加。
IL-22 也是 IL-10 家族的细胞因子之一,在维持肠道稳态中发挥重要作用,因此作者也同时研究了 IL-22 的作用。在敲除小鼠 Il-10 基因或使用 IL-22 中和抗体后,小鼠均表现出更为严重的肠炎。在敲除 Il-10 基因同时阻断 IL-22 的小鼠中,双歧杆菌对肠炎的缓解作用完全消失,表明 IL-22 和 IL-10 是双歧杆菌发挥改善肠道免疫病理的功能所必需的。
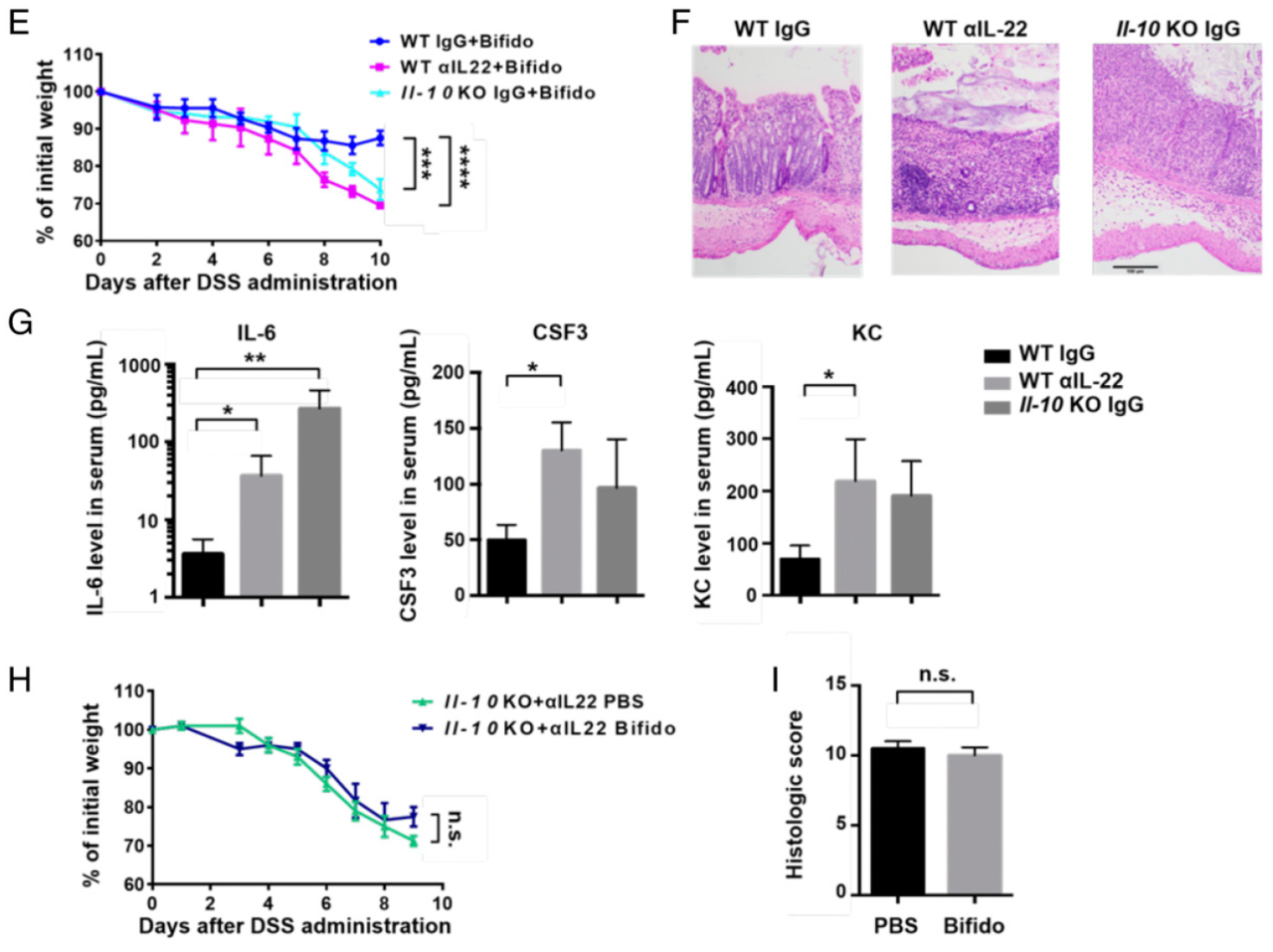
那么,双歧杆菌又是如何影响 Treg 细胞功能的呢?在对小鼠的血清进行了基于质谱的代谢物分析后,作者发现双歧杆菌处理组的小鼠血清辛二酸的水平显着升高,辛二酸可反应线粒体的活性。对 Treg 细胞的表达谱数据进行富集分析,也发现双歧杆菌处理后可显着影响代谢相关通路。

为了研究双歧杆菌是否会影响 Treg 细胞线粒体的体积和功能,作者通过荧光探针对细胞进行染色,以检测线粒体的体积和膜电位。流式细胞术的结果表明, 双歧杆菌治疗组中的 Treg 细胞线粒体体积和线粒体应激均增加。
此外,作者还发现双歧杆菌处理可显着上调 Treg 细胞中与线粒体功能或结构相关的多个基因的表达。这些结果表明 双歧杆菌可调节肠道 Treg 中的代谢过程并增强线粒体活性。

此项工作揭示了在 CTLA-4 免疫检查点阻断条件下双歧杆菌通过共生菌群对肠道 Treg 细胞功能的增强作用。研究发现将双歧杆菌引入小鼠会极大地改变其肠道微生物组,表明肠道微生物是一个动态且相互联系的生态系统。
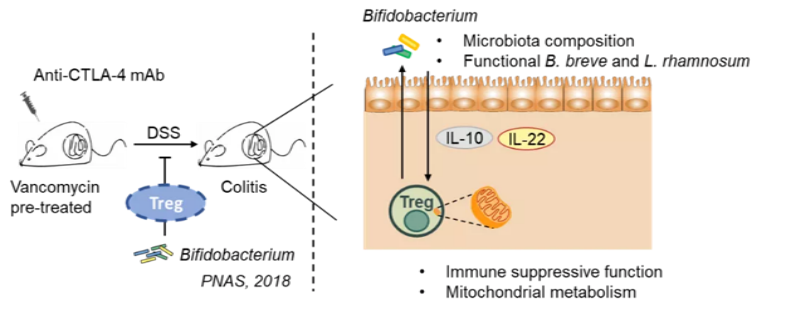
双歧杆菌还可增加肠道 Treg 细胞中 IL-10Ra 和 IL-10 的表达,进而增强 Treg 细胞的免疫抑制作用,以缓解 CTLA-4 阻断所导致的肠道免疫副作用。
双歧杆菌显着降低免疫检查点阻断肿瘤免疫治疗的副作用,并增强多种免疫检查点抗体联合治疗效果的特征,将有助于优化相关临床免疫治疗方案,为利用益生菌株改善肠道菌群结构,提升肿瘤免疫治疗的综合效果奠定了坚实的理论基础。
据悉,通讯作者为上海交通大学医学院上海市免疫学研究所王锋研究员和斯坦福大学医学院 Mark Davis 教授。文章共同第一作者为硕士研究生孙山,助理研究员罗凌杰和博士研究生梁文华。同时,该研究还获得了斯坦福大学 Micheal Fischbach 教授和 Justin Sonnenburg 教授等国内外多位合作者的大力支持。
原始出处:
Shan Sun, Lingjie Luo, Wenhua Liang,et al.Bifidobacterium alters the gut microbiota and modulates the functional metabolism of T regulatory cells in the context of immune checkpoint blockade.Proc Natl Acad Sci U S A. 2020 Oct 19;201921223. doi: 10.1073/pnas.1921223117.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#PNAS#
73
#副作用#
103
#双歧杆菌#
89
#益生菌#有点怀疑这个结果!
262