癌症是全世界疾病死亡的主要原因之一,尽管最近在癌症治疗方面取得许多进展,例如嵌合抗原受体T(CAR-T)细胞或抗体偶联药物(ADC),但仍需要识别肿瘤细胞表达的新靶点,开发用于肿瘤治疗的创新疗法。其中,IL-1RAP最近显示出成为癌症治疗新靶点之一的巨大潜力。
IL-1RAP参与IL-1家族的三种信号通路:白介素-1受体(IL-1R)、白介素33受体(IL-33R)和白介素36受体(IL-36R),这些途径均显示出促肿瘤活性。此外,发现IL-1RAP在几种癌症中上调,包括血液肿瘤以及实体肿瘤(胰腺、结直肠和乳腺肿瘤)。该蛋白显示出巨大的治疗潜力,目前正在进行针对IL-1RAP两种疗法的临床试验,一种是CAR-T细胞疗法,另一种是激活抗体介导的细胞毒性(ADCC)或直接阻断IL-1RAP的抗体免疫疗法。
IL-1超家族由多种细胞因子及其受体组成。目前,IL-1超家族中已描述了11种细胞因子、5种受体和5种共受体。虽然大多数细胞因子都已有研究,但一些细胞因子(IL-37、IL-38)和受体(SIGIRR、IL-1RAPL1/2)的确切功能尚未完全了解。
IL-1家族成员通常根据其共受体分为四个亚家族:(i)IL-1,(ii)IL-33,(iii)与共受体IL-1RAP协同工作的IL-36亚家族,以及(iv)与不同共受体结合的IL-18亚家族。
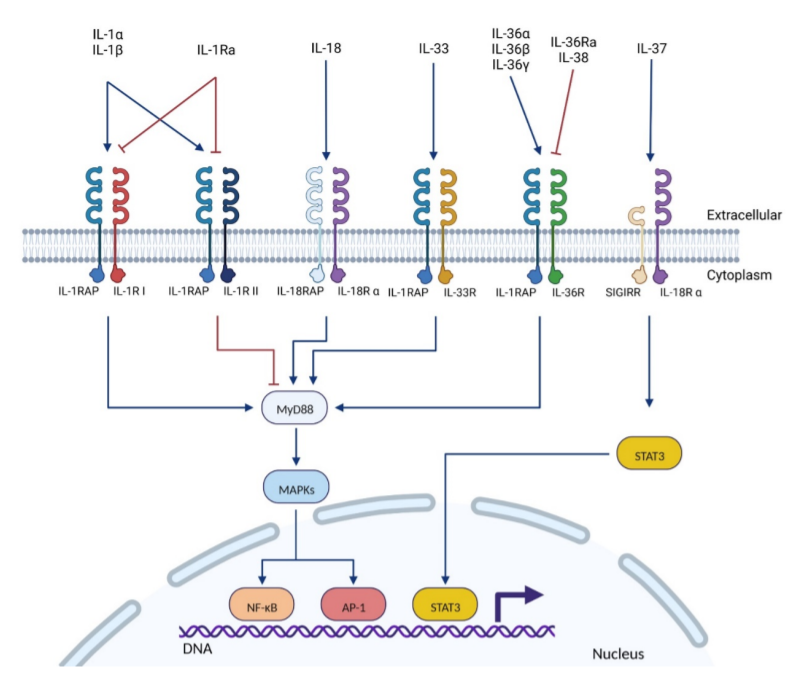
IL-1RAP是IL-1受体家族的成员。IL-1R超家族的所有蛋白质的分子结构都有很大的同源性。与该家族的大多数其他受体一样,IL-1RAP的分子结构由三重免疫球蛋白(Ig)外结构域(D1、D2和D3)和TIR C末端内结构域组成,并能激活NF-κB和MAPK通路。

与许多其他蛋白质一样,IL-1RAP可以通过选择性剪接表达几种亚型。IL-1RAP包括4种亚型:2种可溶性形式和2种膜形式。mIL-1RAP,最初被称为IL1-R3,mIL-1RAP参与免疫过程突触发生中的突触分化;sIL-1RAP,由mIL-1RAP的胞外域形成。sIL-1RAP可以结合可溶性形式的IL-1RII,并增加其对IL-1α和IL-1β的亲和力,sIL-1RAP在IL-1信号的负调节中起作用;sIL-1RAPβ:这是第二种可溶性形式,这种可溶性同种型的增加和膜形式的减少导致IL-1信号的抑制,以诱导细胞的凋亡机制;IL-1RAPb(也称为AcPb),其结构与mIL-1RAP的不同之处在于扩展的C-末端结构域(增加了140个氨基酸)和改变的TIR结构域。
IL-1RAP不能直接结合IL-1,其与IL-1R形成复合物,其结合IL-1的亲和力高于单独的IL-1R。IL-1家族细胞因子(IL-1α、IL-1β、IL-33、IL-36α、IL-36β和IL-36γ)与其主要受体(IL-1R I和IL-1R II、IL-33R/ST2、IL-36R/IL-1Rrp2)和IL-1RAP结合的一般模式如下:细胞因子结合其主要受体,诱导IL-1RAP的募集。受体胞内结构域和IL-1RAP的细胞内TIR结构域形成二聚体,这是招募和结合几种细胞内蛋白和激酶所必需的,如Toll相互作用蛋白(Tollip)、髓系分化因子88(MyD88)、IL-1R相关激酶(IRAK)家族成员和TNF受体相关因子6(TRAF-6)。这些蛋白随后触发细胞内信号级联,诱导NF-κB和AP-1依赖性的促炎细胞因子、趋化因子和炎症反应的表达。
在过去几十年中,IL-1RAP在肿瘤微环境中和肿瘤细胞表面的表达被广泛研究。首先,在血液系统癌症中观察到IL-1RAP过表达,如慢性粒细胞白血病(CML)和急性髓细胞白血病(AML)。其次,IL-1RAP也在几种实体癌中过度表达,影响不同的器官。

胰腺导管腺癌(PDAC)是最常见的胰腺癌,具有高度的侵袭性。使用免疫组化(IHC)和单细胞RNA-seq,发现PDAC患者样本中IL-1RAP过度表达(81%)。14个PDAC细胞系中也观察到IL-1RAP过表达,在人A6L细胞系中表达最高。
尤因肉瘤是儿童和青少年第二常见的骨肿瘤,其特征是小圆细胞过度表达CD99。同时,也观察到高水平的IL-1RAP mRNA,多个Ewing肉瘤细胞系的蛋白质表达水平也通过Western blotting得到证实。此外,非小细胞肺癌(NSCLC)、胶质瘤、三阴性乳腺癌(TNBC)、胃腺癌、宫颈癌的细胞系中也都观察到IL-1RAP的过表达。
IL-1RAP在肿瘤进展和转移中的作用
已有证据表明IL-1RAP在肿瘤促进、进展和转移过程的许多阶段中发挥重要作用。研究发现,使用shRNA对患者的原发性AML细胞下调IL-1RAP导致原发性细胞集落形成能力降低和凋亡增加。其次,使用靶向IL-1RAP的抗体阻断其功能也显示THP-1细胞(AML细胞)的凋亡和分化增加,同时细胞生长减少。这些结果表明IL-1RAP在AML进展中起着重要作用。
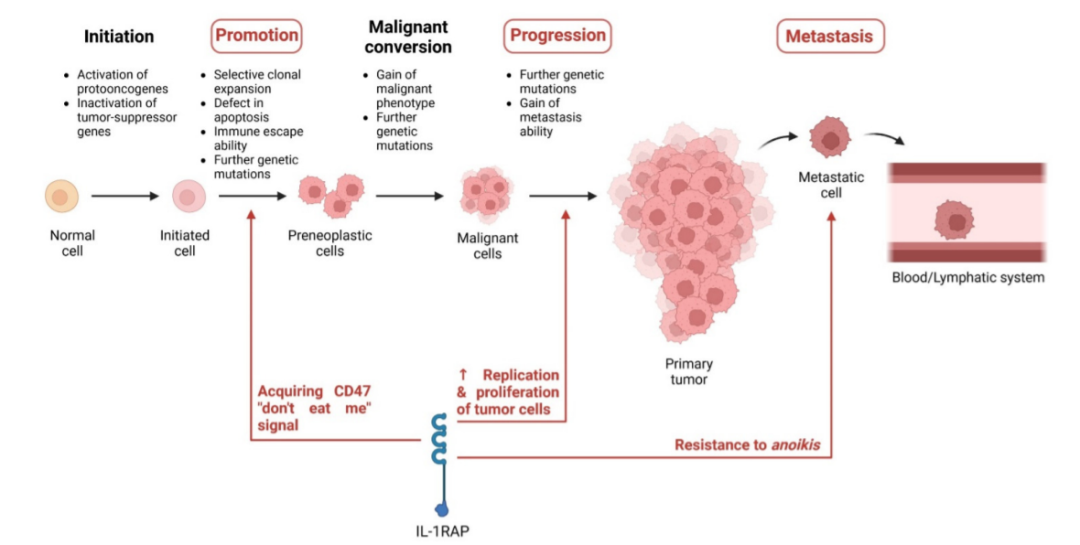
此外,研究还观察了IL-1RAP在胰腺导管腺癌和胃腺癌中肿瘤发展中的作用。在PDAC细胞系A6L中,IL-1RAP的抑制降低了PDAC细胞的生存能力及其集落生长能力。它还导致PDAC的侵袭性降低,并导致显著的G0/G1细胞周期停滞。在IL-1RAP敲低的细胞中,参与IL-1RAP途径的增殖性磷酸化/活化ERK(MAPK)水平降低。在胃腺癌中,IL-1RAP的抑制在体外和体内均导致肿瘤增殖、迁移和侵袭减少。总之,PDAC和胃腺癌的这些结果倾向于证实IL-1RAP在实体癌和血液癌的发展中起重要作用。
同时,其他研究探究了IL-1RAP在肿瘤发展的特定阶段的作用:免疫逃逸能力、肿瘤进展和转移过程中的失巢抵抗。
IL-1RAP在肿瘤微环境中的作用
炎症现在被认为是癌症的标志,其对肿瘤发展的影响由TME中发现的许多相互关联的因素驱动:细胞因子、趋化因子、先天性和适应性免疫细胞、成纤维细胞和缺氧。IL-1R轴已被证明在TME中的几个免疫细胞中发挥重要作用。
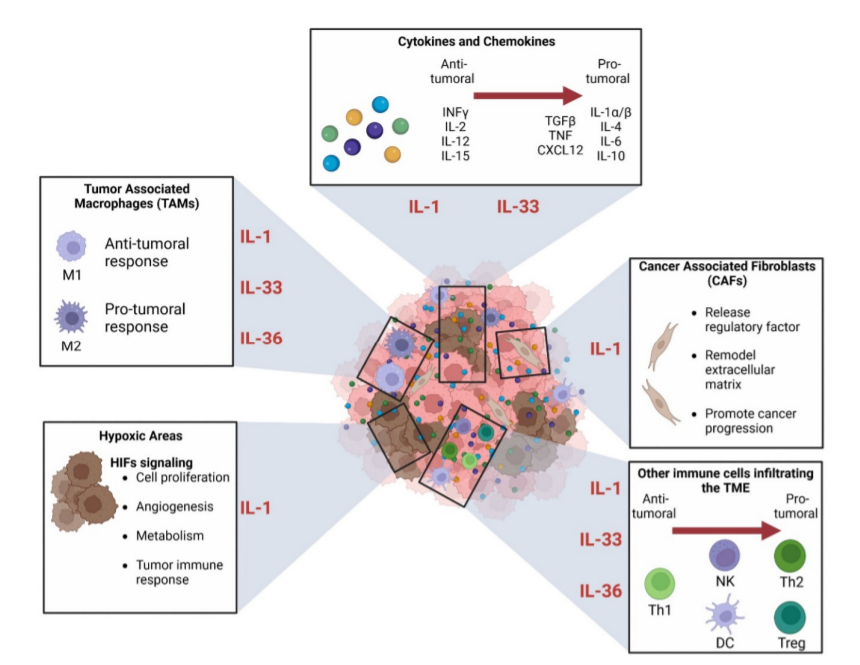
首先,在黑色素瘤中观察到,TME的肿瘤细胞、巨噬细胞和成纤维细胞之间的相互作用会启动IL-1信号级联,从而产生CXCR2刺激分泌。最终,这将提高黑素瘤细胞对MAPK信号抑制疗法(如vemurafenib、selumetinib)的抵抗。
其次,已知IL-1β/IL-1R通路对Th17细胞的早期分化和增殖至关重要。这些Th17细胞将产生IL-17,其促进小鼠黑色素瘤和膀胱癌的肿瘤生长和血管生成。
第三,在HPV阴性口咽鳞状细胞癌(OPSCC)中,已经证明IL-1/IL-1R轴负责趋化因子CXCL8的产生,趋化因子将招募中性粒细胞进入TME。这些肿瘤相关中性粒细胞(TAN)与OPSCC的不良预后相关。
此外,除了对肿瘤细胞的直接作用促进其增殖和肿瘤生长外,IL-1RAP还参与TME以促进血管生成、基质重塑以及TME成分产生的细胞因子和生长因子。总之,IL-1超家族在TME中的参与复杂作用网络,不同的信号轴可以发挥抗肿瘤或促肿瘤功能,这取决于癌症的类型和级别、炎症状态以及它们相互作用的细胞。该领域的进一步研究可能显示出阐明发病机制或确定新的治疗靶点的巨大潜力。
目前,靶向IL-1RAP的疗法大多处于临床前开发阶段,部分进入临床开发。其中大多数是基于靶向IL-1RAP的阻断抗体。
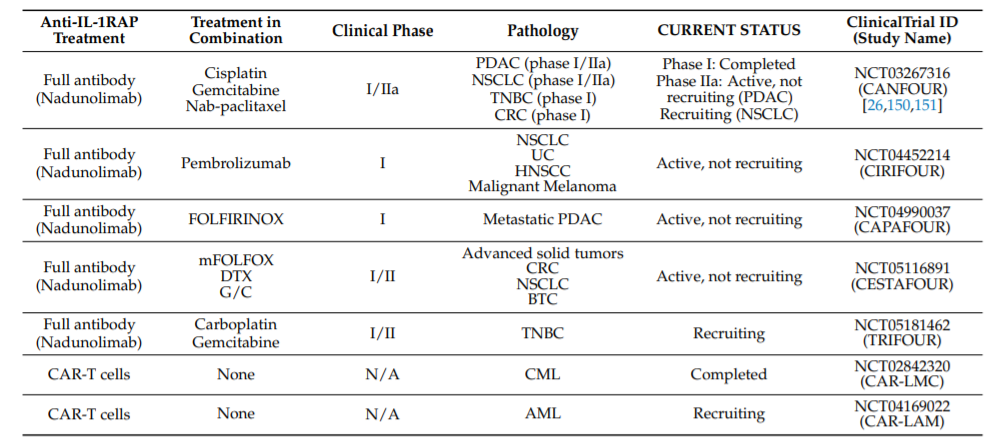
一家瑞典公司Cantargia AB多年来一直致力于将IL-1RAP作为多种癌症的靶点。他们研究了慢性和急性髓细胞白血病(CML和AML)以及几种实体瘤中的IL-1RAP。目前,正在临床测试抗IL-1RAP抗体在这些疾病中的疗效。已有临床实验的中期安全性结果,证明其抗体Nadunolimab耐受性良好,未报告急性毒性。
此外,法国的一个团队开发了能够靶向IL-1RAP的CAR-T细胞。目前,正在临床进行两项临床实验(NCT02842320和NCT04169022),尚未发表任何结果。
在过去十年中,新的研究发现了IL-1RAP在IL-1超家族信号通路中的作用及其在肿瘤发展和进展中的作用。IL-1RAP现在被认为是几种血液学和实体癌的有前途的治疗靶点。目前,已开发了靶向IL-1RAP的特异性疗法:基于抗体的疗法和CAR-T细胞疗法。随着实验的进展,期待这个新靶点能够给我们带来惊喜!
参考文献:
1. IL-1RAP, a Key Therapeutic Target in Cancer. Int J Mol Sci.2022 Dec; 23(23): 14918.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













