J Thorac Oncol:一文掌握——RET融合NSCLC
2017-11-27 wrangx 肿瘤资讯
2012年在NSCLC上首次发现RET重排,目前已发现至少12种融合变体,其中KIF5B-RET为最常见类型。RET融合主要检测方法为FISH和PCR。RET融合多见于不吸烟肺腺癌、晚期患者居多,对化疗相对敏感。目前RET抑制剂ORR 16%~47%,PFS2~7个月,疗效相对不理想。
2012年在NSCLC上首次发现RET重排,目前已发现至少12种融合变体,其中KIF5B-RET为最常见类型。RET融合主要检测方法为FISH和PCR。RET融合多见于不吸烟肺腺癌、晚期患者居多,对化疗相对敏感。目前RET抑制剂ORR 16%~47%,PFS2~7个月,疗效相对不理想。
介绍
基因融合是实体和血液恶性肿瘤重要的癌基因,第一成功案例为伊马替尼治疗BCR-ABL融合阳性的慢性淋巴细胞白血病,后续克唑替尼可有效延长ALK和ROS1基因融合阳性晚期NSCLC的生存期。在NSCLC中,常见融合基因有ALK(3%~7%)、ROS1(1%~2%)、NTRK(3.3%)和RET(0.7%~2%)。RET融合最先是在甲状腺癌上发现,多靶点TKI如舒尼替尼、索拉非尼、卡博替尼、乐伐替尼、阿帕替尼在RET融合细胞系上进行了基础研究,但这些药物相关的随机或回顾性临床研究还是很少。
分子生物学
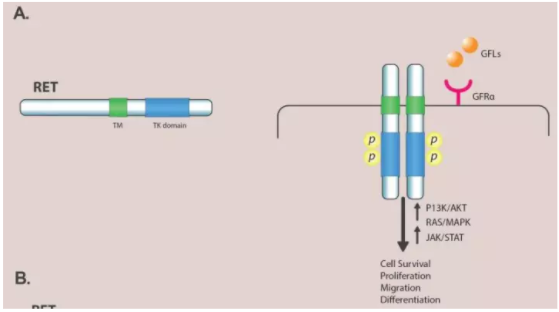
RET位于10q11.2,编码包括三个结构域酪氨酸激酶受体,胞外域(4个重复类钙粘蛋白、钙结合位点、富半胱氨酸区),跨膜域和胞内域,与ALK激酶域有37%氨基酸相同。RET配体有胶质源性神经营养因子家族如GDNF、artemin、神经生长因子、persephin。受体二聚化和激酶域自身磷酸化激活RET,下游信号通路包括RAS/MAPK/ERK、PI3K/AKT,JAK/STAT等,与细胞的增值、迁移和分化有关。
RET在器官生成和神经发育中起到重要作用,敲除RET基因的小鼠出生1天后因为肾不发育和先天性巨结肠死亡。乳头状甲状腺癌RET融合发生率为5%~40%。总体NSCLC人群RET融合发生率1.8%,在EGFR、ALK、ROS1、BRAF、KRAS和HER2野生型患者RET融合发生率为6.3%。在NSCLC中,至少发现12种RET融合变体包括KIF5B、CCDC6、NCOA4、MYO5C-R、EPHA5、TRIM33、CLIP1、ERC1、PICALM、FRMD4A、RUFY2、TRIM24。RET融合蛋白类似于ALK,但是于ROS1不同,KIF5B-RET融合蛋白包含马达结构域和KIF5 B的卷曲螺旋结构域,通过卷曲螺旋结构域的二聚化作用,该融合蛋白的RET酪氨酸激酶活性可异常活化,从而促进肺肿瘤发生。
分子检测
尽管免疫组化(IHC)是检测ALK和ROS1有效工具,但因为假阳性和假阴性发生率高无法检测RET融合。117例NSCLC标本,中等强度染色22例,RT-PCR检测仅1例阳性,余21例均为IHC假阳性。经RT-PCR检测后RET阳性和阴性标本间IHC染色无区别,假阴性率46%而假阳性率62%。鉴于目前IHC阳性值(RET染色10%~30%细胞)、抗体使用不一致,解读无法统一,需要新的抗体和IHC标准用于RET融合的筛查。
高敏感性FISH是RET融合检测金标准,且与融合伴侣无关,但检测费用高需要专业的技术力量,目前仅能在大的中心进行。FISH无法提供特殊RET融合伴侣的信息。目前FISH阳性阈值尚无标准,RET分离信号值10%~20%。
RET筛查研究上多使用PT-PCR,可检测已知RET融合,可用于细胞标本,主要缺点无法检测新的或未知伴侣,会低估RET融合发生率。经福尔马林处理标本RNA降解或质量下降也会影响结果。在多数RET融合筛查研究中,PT-PCR多于FISH或IHC技术联合。FISH和PT-PCR可相互补充,在一项筛查研究中,22例FISH阳性,PT-PCR发现12例为KIF5B-RET。尽管FISH检测RET融合敏感性较低,但PT-PCR会错过一些新的融合伴侣。
最后NGS、WGS和WTS都是很好的技术,相互检测DNA和RNA发现不同和功能的RET融合伴侣,可高敏感性检测RET基因,甚至标本肿瘤细胞比较少时。但技术操作复杂、数据庞大分析困难、成本高。另外NGS可在血液中检测到RET融合,在200例NSCLC中血检发现1例KIF5B-RET阳性。
临床病理特征
RET重排NSCLC多见于不吸烟肺腺癌。RET融合肺癌较ALK和EGFR阳性患者肿瘤分化程度低。11例RET融合NSCLC,7例为实性,4例为印戒细胞癌。RET融合和其他驱动基因亚型在性别、年龄和吸烟史上没有区别,但RET融合NSCL更年轻(73%<60岁)、非吸烟比例更高(82%)。RET融合NSCLC原发灶较小(<3cm)但易出现N2淋巴结转移。165例RET融合NSCLC回归性分析,更容易发生转移。影像学上具有淋巴管炎和沙粒小体两个特点。
开始认为RET融合和其他基因改变相互排斥,但回顾性NGS检测研究发现,12例RET融合肺癌4例(33%)伴有其他基因改变如EGFR、MAP2K1、CTNNB1和AKT1。类似的在22例RET阳性肺癌中10例(45%)伴有其他基因改变,8例为TP53突变、1例MET扩增、1例CTNNB1突变。
RET抑制剂
RET融合NSCLC胸苷酸合成酶mRNA水平增加,培美曲塞为基础化疗ORR高达40%,PFS19个月,与RET融合就对化疗敏感还是本身就是预后好的因素,还不明确。回顾性分析RET的预测价值,多数研究显示与OS或无复发生存期无关。目前还没有批准的选择性RET抑制剂,临床前和临床试验中评价非选择性和选择性RET抑制剂的作用,IC50值和作用靶点见下图。
凡德他尼
抑制VEGFR2~3、RET(IC50值100nM)。有4项凡德他尼的Ⅲ期研究937例患者,FISH检测7例RET融合,凡德他尼治疗3例无一例缓解。在日本进行的Ⅱ期LURET研究纳入17例RET融合NSCLC,给予凡德他尼治疗(300mg/天),CCDC6-RET占31%,KIF5B-RET占53%,RET状态未知占16%。ORR535、DCR88%,PFS4.7个月,OS11.1个月。在CCDC6-RET亚型中ORR83%而PFS8.3个月;在KIF5B-RET亚型,ORR20%而PFS2.9个月。治疗相关3~4级AEs:高血压58%、皮疹16%、腹泻11%、QT间期延长11%。治疗中断率21%,50%患者治疗减量。在韩国进行的Ⅱ期评价凡德他尼(300mg/天)疗效的研究,纳入18例患者,KIF5B-RET占28%,CCDC6-RET占11%,RET状态未知占56%,ORR15%、DCR65%,PFS4.5个月,OS11.6个月。3~4级AEs高血压17%、QT间期延长11%,减量占22%,5例KIF5B-RET无一例客观缓解。
卡博替尼
卡博替尼为多靶点抑制剂作用于VEGFR-2、MET、AXL、c-KIT和RET(IC50值5~20 nM)。体外研究卡博替尼可有效抑制KIF5B-RET转染淋巴细胞。在Ⅱ期研究中,卡博替尼(60mg/天)治疗FISH或NGS诊断RET融合26例患者,KIF5B-RET占62%,15%为少见融合形式,RET状态未知占23%。中期分析ORR28%、PFS5.5个月,OS9.9个月。KIF5B-RET的ORR20%,而其他融合形式ORR50%。3~4级治疗相关AEs:脂肪酶增加15%,转氨酶升高8%、高血压4%。治疗中断和减量为8%和73%,减量可能是疗效不佳的原因。
乐伐替尼
乐伐替尼抑制RET的IC50值最低(1.5nM)。体外和体内实验可抑制KIF5B-RET和CCDC6-RET肺腺癌。Ⅱ期研究乐伐替尼(24mg/天)治疗RET融合NSCLC,KIF5B-RET占52%,其他已知融合类型占48%,既往接受RET抑制剂治疗占28%。ORR16%、DCR73%、PFS7.3个月。7例既往RET抑制剂治疗患者,乐伐替尼治疗有效率14%。KIF5B-RET和其他融合类型ORR类似,但PFS时间较短3.6个月对比9.1个月。乐伐替尼相关3~4级AEs为92%(高血压58%,蛋白尿16%),减量和治疗中断发生率分别为64%和76%。
其他RET抑制剂
关于舒尼替尼、索拉非尼、艾乐替尼、ponatinib、dovitinib、阿帕替尼治疗RET融合肺癌证据多来此临床前研究、病例报道或回顾性研究。索拉非尼和舒尼替尼作用谱类似,抑制RET的作用有限。艾乐替尼抑制RET融合IC50值4.8 nM,艾乐替尼不作用于VEGFR-2,可避免抗血管成长药物毒性。体外研究艾乐替尼可抑制KIF5B-RET细胞生长,诱导CCDC6-RET阳性肺腺癌细胞系死亡。值得注意的是艾乐替尼对两种常见的RET重排守门突变有效(V804L和V804M)。在日本和美国艾乐替尼治疗RET融合Ⅰ/Ⅱ期研究正在进行。ponatinib治疗RET融合NSCLC的Ⅱ期研究正在进行。
RET抑制剂未来研究方向
目前多靶向激酶抑制剂治疗RET融合NSCLC的ORR16%-47%,PFS2.3~7.3个月,在有效率和生存数据上差于其他NSCLC驱动基因。另外RET TKIs3~4级毒性发生率高,主要因为对VEGFR激酶的抑制作用,导致高达70%患者减量。因此需要作用更强和高选择性的RET抑制剂,增加疗效并限制毒性,艾乐替尼和ponatinib可能更有前途,这两个药物对RET守门突变V804M/L和G810A有作用。目前RET融合NSCLC还没有突破性进展,需要研发高效低毒的RET抑制剂,探索不同融合亚型对疗效的影响及RET抑制剂的耐药机制。
原始出处:
Roberto Ferrara, et al. Clinical and translational implications of RET rearrangements in non-small cell lung cancer. J Thorac Oncol. 2017 Nov 8.
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#RET#
68
#THORAC#
70
#Oncol#
79
学习了谢谢分享!!
104
#融合#
68
学习了很多先进的医疗技术
90
很好的文章.谢谢分享
109
学习了.谢谢.
107
好资料.学习了.
0