Stem Cell Research & Therapy:联合移植技术让基因治疗成为A型血友病更具前景的治疗方法
2019-03-27 陈婉仪 医麦客
目前A型血友病的护理标准是蛋白质替代疗法,需要频繁输注FVIII蛋白质浓缩物。尽管这些疗法带来了预期寿命和生活质量的益处,但高成本、终身输注的需要以及不能保持稳定的凝血因子水平使它们远非理想。
目前A型血友病的护理标准是蛋白质替代疗法,需要频繁输注FVIII蛋白质浓缩物。尽管这些疗法带来了预期寿命和生活质量的益处,但高成本、终身输注的需要以及不能保持稳定的凝血因子水平使它们远非理想。
Jessica Morris每周给儿子Landon注射三次凝血因子(图片来源:NPR)
A型血友病源于F8基因突变的单基因缺陷,因此基因治疗被认为是一种很有前景的替代方案。许多候选基因疗法,如Sangamo Therapeutics和辉瑞(Pfizer)的SB-525、uniQure的AMT-180、BioMarin的valoctocogene roxaparvovec(BMN 270)正在开发和临床测试中。它们都基于称为腺相关病毒(AAV)载体的病毒载体,旨在将F8基因的功能形式递送至患者的细胞。但是基于AAV的基因疗法的长期有效性仍然是未知的,并且约三分之一的患者由于先前与AAV病毒接触而不适合,这意味着它们具有产生针对载体的免疫应答的潜力。
另一种可能性是使用基于细胞的基因疗法,其中首先将功能性F8基因引入患者体外的靶细胞中,然后将那些工程化细胞移植到患者体内。
近日,加州大学戴维斯分校的研究人员为基于细胞的A型血友病基因治疗提供了有希望的临床前证据:基于基因工程产生功能性凝血因子VIII(FVIII)的内皮祖细胞和干细胞的联合移植可实现稳定和长期的治疗,减轻患有A型血友病样疾病的小鼠的症状,即缩短出血时间。
寻找合适的移植细胞
该研究可能对A型血友病患者具有重要意义,因为基于细胞的疗法有望应对这种出血性疾病,但由于治疗细胞的长期植入不足而阻碍了成功的治疗。
对于A型血友病治疗,将循环凝血FVIII水平增加至正常值的1%以上可以显着降低自发性内出血的风险。长期以来,FVIII生物合成的主要细胞来源一直存在争议。20世纪60年代和80年代的肝移植研究表明,肝脏是FVIII的主要来源。早期的证据表明,肝细胞是肝脏中FVIII表达的唯一来源,但后来证明它主要是LSECs(肝窦内皮细胞)。除肝脏外,还显示来自其他器官如肺、心脏、肠和皮肤的内皮细胞也产生FVIII。因此,内皮细胞似乎是该疾病基因治疗的合适候选者。
ECFC(内皮细胞集落形成细胞)是一组具有高增殖能力的细胞,在成人外周血中稀有(约0.05-0.2 cells/ml),但在人脐带血中高度丰富(约2-5 cells/ml)。大量研究表明,从脐带血中获得的ECFC成熟程度较低,在体外和体内具有高增殖潜力。因此,脐带血可能是比骨髓更好的ECFC来源。
数据显示,脐带血衍生的ECFC不表达可观量的FVIII。为了增加FVIII分泌的量,在该研究中,研究人员使用慢病毒转导这些细胞以过表达FVIII。他们使用两种慢病毒载体转导ECFC,一种是编码BDD-F8的pCCLc-MNDU3-BDD-FVIII-PGK-NEO-WPRE,另一种是编码荧光素酶和GFP(绿色荧光蛋白)的pCCLc-MNDU3-LUC-PGK-EGFP-WPRE用于细胞追踪和植入分析。流式细胞术检测转导率为87.53%。
基于细胞的疗法另一潜在困难是,移植的细胞在患者体内产生凝血因子的时间太短。
为了改善移植的ECFC的植入,该研究已经考虑了两种或更多种细胞的联合移植。先前的研究表明,与单独的ECFC相比,ECFC与MSC(间充质干细胞)的共同移植改善了血管形成和植入。MSCs通过作为血管周围前体细胞发挥功能,有效地稳定体内新生血管。ECFC和MSCs的共同移植显着促进心血管疾病、脑血管疾病和骨再生过程中的组织恢复。
据作者所知,他们是第一个研究ECFCs和PMSCs(胎盘间充质干细胞)联合移植治疗A型血友病的研究机构。该项研究中,他们发现ECFCs在免疫缺陷小鼠中单独移植或与PMSCs一起移植时表现出持续植入。MSCs在移植后的较晚时间点显着增强ECFC植入。
更有效植入新生小鼠体内
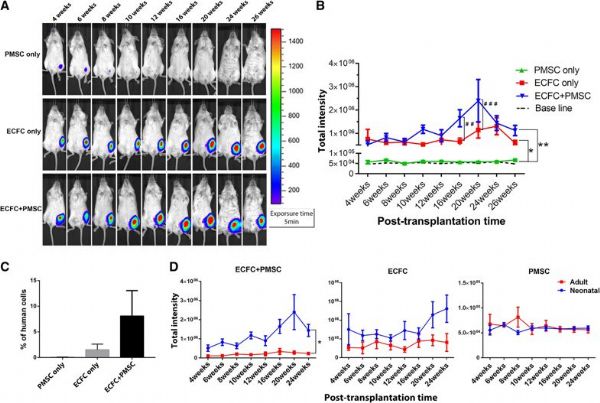
首先,为了研究成年动物中移植细胞的细胞存活和移植,研究人员将下列三组细胞肌内注射到12周岁NSG小鼠的左后肢中,通过IVIS成像系统监测细胞存活和植入。
ECFC组:GFP/荧光素标记的ECFC
PMSC组:GFP/荧光素标记的PMSC
ECFC/PMSC联合移植组:Td-番茄标记的PMSC和GFP/荧光素标记的ECFC
在移植后的前3周,所有三组中的生物发光信号显着降低。移植后第3周,PMSC组的信号达到基线,并且在24周的整个研究期间未显示任何增加。相比之下,ECFC组和ECFC/PMSC联合移植组也显示移植后前2周信号强度降低,但在移植后持续24周的时间段内显示出稳定的高于基线的植入率。
(图片来源:Stem Cell Research & Therapy)
下一步,研究人员采用相同步骤将三组细胞移植到新生NSG小鼠(3-5天龄),以研究细胞存活和植入中的差异。与成年小鼠一样,在新生小鼠中使用相同的实验设置和细胞数。移植后监测动物26周。
移植后的前3周,细胞存活率降低,并且这三组之间的细胞保留没有显着差异。移植后12周,PMSC组的生物发光信号连续降低并达到基线;相反,ECFC组中的生物发光信号保持相同的强度,在整个26周期间显着高于基线;在联合移植组中,强度在4至26周时间段内维持,并在20周时最高,表明移植细胞的长期植入和增殖。
与PMSC组相比,ECFC组和联合移植组的信号强度显着更高。在16周和20周时,联合移植组的信号显着高于ECFC组(p <0.01和p <0.001)。
(图片来源:Stem Cell Research & Therapy)
进一步的比较发现,在移植后4至24周期间,新生小鼠在联合移植组中具有比成年小鼠更高的生物发光信号,而在ECFC组和PMSC组中,没有显着差异。数据表明,对于长期的细胞移植,新生儿期联合ECFC和PMSC进行细胞移植或优于成人期。
联合移植:显着减轻A型血友病小鼠出血症状
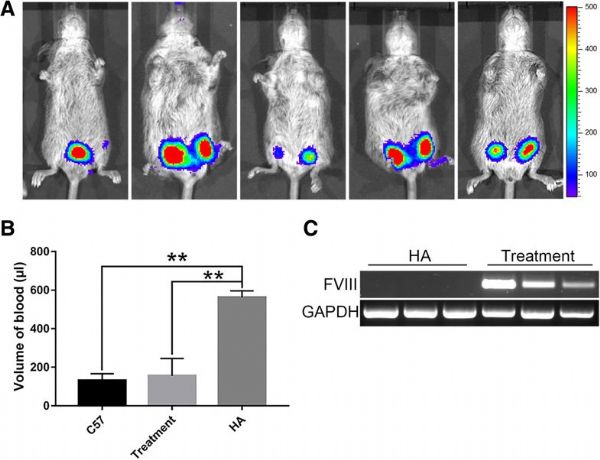
为了评估ECFCs和PMSCs的联合移植是否对治疗A型血友病有治疗效果,研究人员将3×10^6个ECFCs和2×10^6个PMSCs皮下移植到每只新生HA小鼠(出生后2周)的左右后肢。
联合移植显着减弱A型血友病新生小鼠的出血症状(图片来源:Stem Cell Research & Therapy)
移植后一周,生物发光成像显示移植的细胞保留在所有5只HA小鼠中。随后,进行尾夹测定以检测这些处理小鼠的失血,并与对照未处理的HA小鼠和对照正常C57BL/6小鼠进行比较。对照C57BL/6小鼠和对照HA小鼠的失血量分别为131.5±13.3μl和562.13±19.84μl。ECFC/PMSC联合移植的HA小鼠失血量为155.78±44.93μl,这与正常C57BL/6小鼠相似,并且显着低于对照HA小鼠。
RT-PCR分析进一步证实了F8在注射部位的小鼠组织中的表达,而对照HA小鼠没有可检测的F8表达。数据表明,ECFC和PMSC的联合移植显着减弱了HA小鼠的出血症状。
“这项研究表明,在新生儿中ECFCs与PMSCs的联合移植是实现稳定、长期植入的潜在策略,对A型血友病的基因治疗具有很大希望。”研究人员总结道。
基于造血干细胞的基因疗法已经在β-地中海贫血症、镰状细胞贫血症和一些免疫缺陷疾病中显示非常出色的疗效,针对血友病的AAV基因疗法也获得了相当大的成功,如果可以进一步拓展适用人群,那么将能造福更多的患者,有望找到最适合每个个体的治疗方式。
原始出处:Kewa Gao, Priyadarsini Kumar, Elizabeth Cortez-Toledo, et al. Potential long-term treatment of hemophilia A by neonatal co-transplantation of cord blood-derived endothelial colony-forming cells and placental mesenchymal stromal cells. Stem Cell Research & Therapy. 22 January 2019
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#ERA#
92
#stem cell#
72
#CEL#
85
#Cell#
63
#A型血#
102
#A型血友病#
77
#治疗方法#
53
#STEM#
71
#Research#
71
学习谢谢分享
93