怎么设置重症ARDS患者的PEEP
2024-11-18 重症医学 重症医学 发表于上海
本文综述 PEEP 在重度 ARDS 中的应用、俯卧位与 PEEP 的关系、V - V ECMO 与 PEEP 的关系,强调个性化 PEEP 评估和滴定对优化治疗与改善结局的重要性。
PEEP在重度ARDS中的应用
PEEP可以改善氧合
PEEP可促进肺泡复张并限制肺不张,从而减少通气不均匀性并可能预防VILI
PEEP可通过降低静脉回流梯度、增加肺血管阻力和降低心输出量
PEEP的受益和危害之间的平衡主要取决于其对肺复张的影响
评估和个性化PEEP策略
临床上评估个体化PEEP的方法较多(例如氧合、ΔP、PEEP、复张/充气比、计算机断层扫描、电阻抗断层扫描、超声等),然而,仅基于可复张性的PEEP管理可能无法为重度ARDS患者提供真正个性化的方法。需要一种更全面的方法。
临床意义
1、在没有“最佳”PEEP的情况下,可以同时增强肺泡复张和气体交换,同时避免过度扩张和血流动力学损害,中等水平的PEEP可以提供肺保护,同时最大限度地减少血流动力学损害。
2、一旦PEEP设置,定期重新评估其对心肺功能的影响至关重要。
俯卧位与PEEP
俯卧位的生理效应及其与PEEP的相互作用

俯卧位对PEEP管理的意义
1PP和PEEP之间的潜在协同作用可能有助于通气均匀化,恢复先前未通气的肺单位,和/或增强已通气肺单位的机械性能,而不会引起局部过度扩张。
2 PP可以减少PEEP,从而减少每充肺容量所需的能量,同时保留EELV,优化气体交换,并保持血液动力学稳定性。
3个体对PP反应的显著差异,包括呼吸力学、PTP和气体交换的变化,强调需要在PP期间定期重新评估PEEP设置。
VV-ECMO与PEEP

V-V ECMO对PEEP管理的意义
1、在V-V ECMO治疗的严重ARDS患者的“超保护”通气期间设置PEEP,特别是在涉及多器官功能障碍和休克的治疗初始阶段,应努力平衡肺保护与血流动力学稳定性。
2、作为“肺休息”策略的一部分,中等水平的PEEP(10至15 cmH2O)可能适用于该ARDS亚组,以最大限度地减少VILI,维持血流动力学稳定性,并优化呼吸道DO2。
3、V-V ECMO期间PEEP的进一步个性化需要定期评估PEEP在心肺功能方面的获益和风险。
以下是全文,请详细阅读
重度ARDS患者的呼气末正压管理:俯卧位和体外膜肺氧合的意义

摘要
重度急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者呼气末正压通气(positive end-expiratory pressure,PEEP)滴定的最佳策略尚不清楚。目前的指南强调了在这些患者的心肺功能方面,仔细评估PEEP滴定的风险-受益的重要性。在过去的几十年中,PEEP使用的主要目标已经从仅改善氧合转变为强调肺保护,并且越来越关注肺损伤的个体模式、肺和胸壁力学以及PEEP的血流动力学结果。在中重度ARDS患者中,建议俯卧位(PP)作为肺保护性通气策略的一部分,以降低死亡率。然而,PP期间呼吸力学和血流动力学的生理变化可能需要仔细重新评估通气策略,包括PEEP。对于最严重的具有难治性气体交换障碍的ARDS患者,如果不能进行肺保护性通气,则可使用静脉-静脉体外膜肺氧合(V-V ECMO)促进气体交换,并允许使用“超保护性”通气的“肺休息”策略。因此,在V-V ECMO治疗的重度ARDS患者中,肺复张对改善氧合和充分PEEP均质通气的重要性可能与保守治疗的患者不同。本综述讨论了严重ARDS患者的PEEP管理,以及PP或V-V ECMO管理对呼吸力学和血流动力学功能的影响
背景
自Ashbaugh等人于1967年提出呼气末正压(PEEP)以来,PEEP一直是急性呼吸窘迫综合征(ARDS)机械通气患者管理的基石。作为肺保护性通气策略的一部分,PEEP可改善通气分布,并可能限制呼吸机诱导的肺损伤(VILI)。尽管已经评估了基于氧合和呼吸力学的PEEP滴定的不同方法,在随机临床试验中,改善临床结局的最佳策略尚未确定。
目前欧洲重症监护医学会(ESICM)关于ARDS的指南并没有推荐基于高氧或低氧的PEEP或呼吸力学指导的PEEP滴定与氧合相比。相比之下,美国胸科学会(ATS)关于ARDS管理的指南建议在中重度ARDS患者中使用较高的PEEP而不是较低的PEEP ,该指南基于两项荟萃分析,显示了较高的PEEP与该ARDS亚群的生存率改善之间存在相关性。
采用俯卧位(PP)和静脉-静脉体外膜肺氧合(V-V ECMO)管理重度ARDS患者,呼吸力学和辅助策略的相关变化,也可能影响PEEP的生理效应。在这些情况下,“最佳”PEEP可能会有所不同,需要仔细重新滴定,以平衡潜在的益处和危害。
本文综述了重度ARDS患者的PEEP管理,重点关注个性化PEEP对呼吸力学和心肺功能的生理影响,以及PP和V-V ECMO管理的意义。
PEEP在重度ARDS中的应用
生理效应和原理
大约50年前,Suter等人描述了根据呼吸力学和氧气输送速率(DO2)滴定的“最佳”PEEP可能改善呼吸衰竭患者的心肺功能。从那时起,PEEP使用的主要目的已经从仅仅改善氧合转变为强调肺保护,越来越多的人关注肺损伤的个体模式、肺和胸壁力学以及PEEP的血流动力学后果。
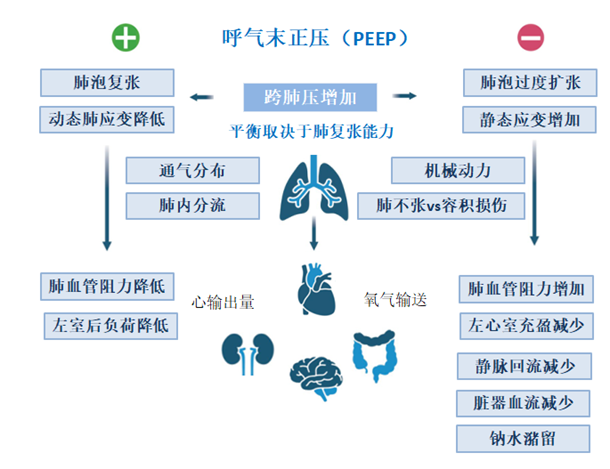
作为肺保护性通气策略的一部分,PEEP可促进肺泡复张并限制肺不张,从而减少通气不均匀性并可能预防VILI (图1)。然而,由于肺泡过度膨胀和向肺传递的机械功率(MP)增加,过度的呼气末正压可能导致VILI。
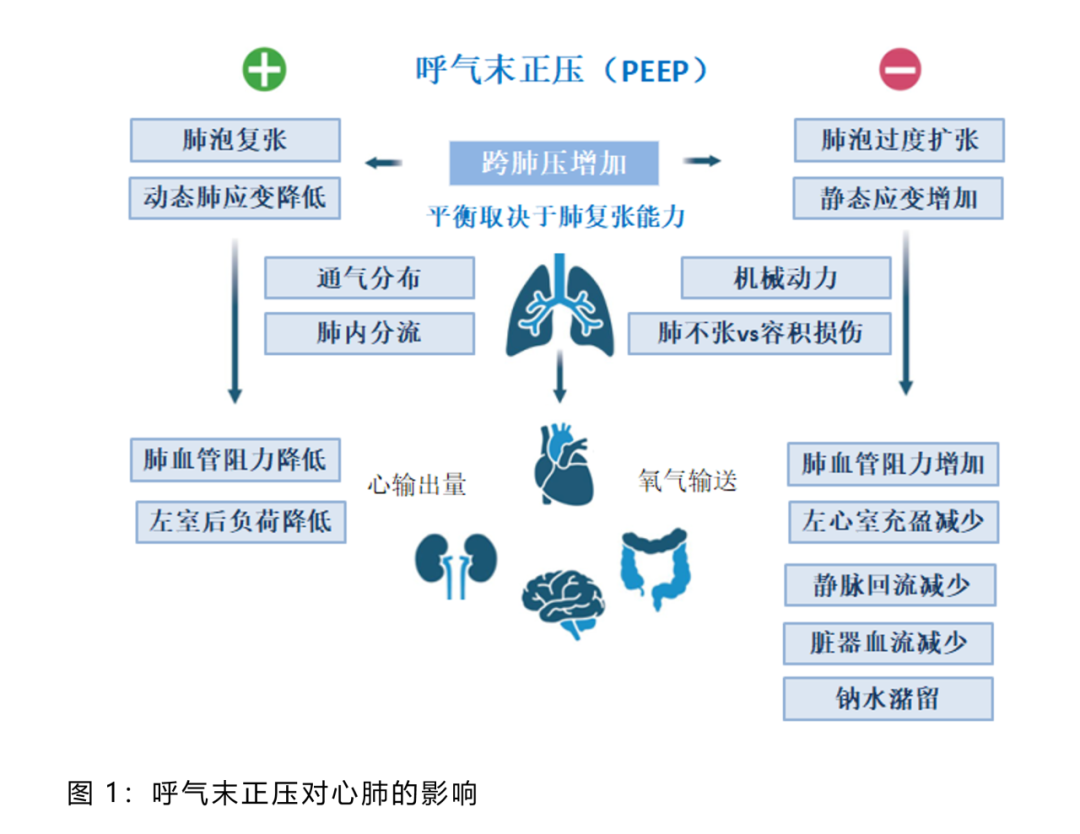
PEEP可通过降低静脉回流梯度、增加肺血管阻力和降低心输出量从而对血流动力学产生不利影响(图1)。过度PEEP的这些血流动力学后果可能增加对液体用药和血管活性药物的需求,这可能影响患者结局。
PEEP的受益和危害之间的平衡主要取决于其对肺复张的影响,定义为对气道压力增加的反应,使无通气和通气不良的肺实质再通气。PEEP的应用增加了非依赖性和依赖性肺区域的跨肺压(PTP),即气道和胸膜压力之间的差异。肺容量相对于静息肺容量的变化,称为功能残气量(FRC),代表肺应变。肺应变分别由PEEP呼气末肺容积(EELV)由PEEP相对于FRC确定和潮气量(VT)(相对于EELV的VT)引起的静态和动态分量组成。
在高复张的病例中,PEEP诱导的肺组织收缩期前收缩末压升高导致肺实质再通气,并伴有轻微过度扩张。虽然PEEP增加静态应变,但EELV的相应增加显著降低了潮气通气的动态应变,可能改善气体交换、肺保护并限制VILI。相反,在低复张性病例中,过度PEEP不能显著恢复肺实质,增加静态应变但没有减少动态应变。这导致充气肺实质过度膨胀,导致肺应力和应变增加,并增加VILI和血流动力学损害的风险(图1)。值得注意的是,由于ARDS患者的肺不均匀性,PEEP增加肺动脉收缩压总是涉及再通气和通气肺实质过度扩张之间进行权衡,“复张性”表明了这种平衡。尽管增加PEEP可以降低轻度和中度ARDS患者的肺不均匀性,但当气道平台压限制在推荐的30 cmH2O时,重度ARDS患者可能无法实现显著的肺复张或降低肺不均匀性。
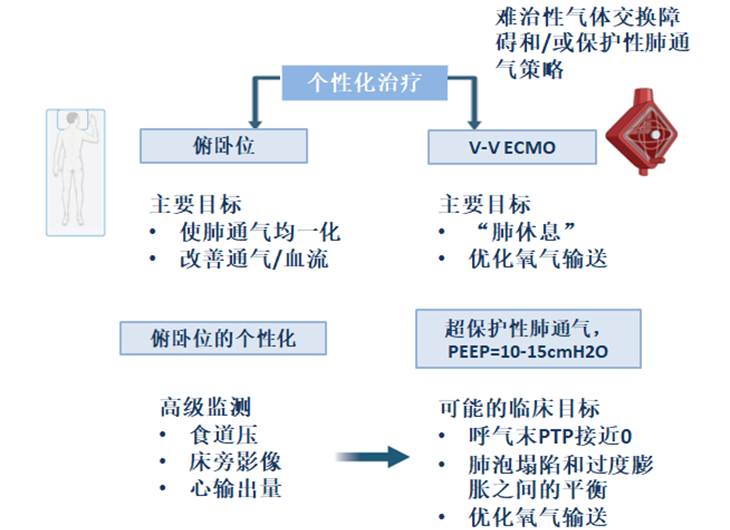
在这些情况下,可以使用PP来增强通气分布,从而减少过度扩张和肺泡周期性开闭。在具有难治性气体交换障碍或无法提供肺保护性通气的重度ARDS患者中,V-V ECMO促进气体交换并允许“超保护性”通气策略。
评估和个性化PEEP策略
重度ARDS的特征在于肺损伤模式(局灶性与弥漫性)、肺和胸壁力学、血流动力学和潜在多器官功能障碍的显著异质性。这种可变性,加上不同呼吸机策略的相互作用,使PEEP管理和最佳个性化PEEP策略的定义变得复杂。尽管在重度ARDS中管理PEEP的最佳方法尚不清楚,但ESICM和ATS指南都强调了在设置PEEP时评估心肺风险-受益比的重要性。
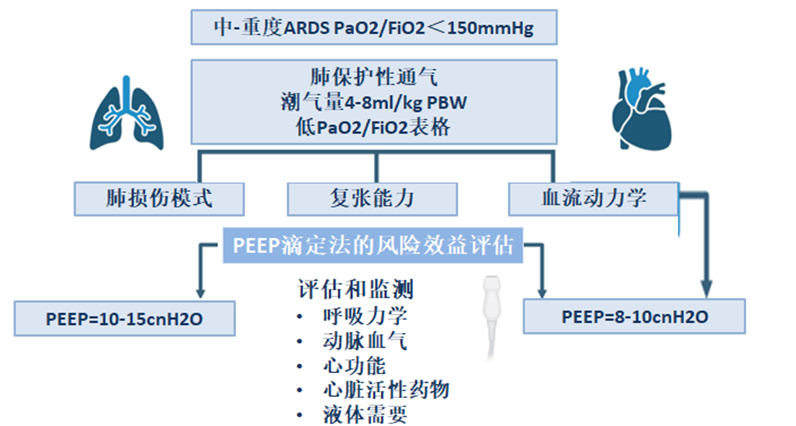
可以使用生理参数(例如氧合、ΔP、PEEP)、床旁操作(例如复张/充气比)和成像技术(例如计算机断层扫描、电阻抗断层扫描、超声)评估肺复张能力,以估计对较高PEEP的理论反应。然而,仅基于可复张性的PEEP管理可能无法为重度ARDS患者的呼吸机管理提供真正个性化的方法。需要一种更全面的方法包括评估PEEP、治疗策略(PP,极低潮气量的“超保护”通气)、气体交换和PTP之间的相互作用,以及考虑与血流动力学变量和液体需求相关的“生物学”成本(图2)。
在EPVent-2试验的再分析中强调了PEEP在平衡肺保护和血流动力学稳定性方面的竞争效应。这项研究表明,PEEP策略对死亡率的影响取决于多器官功能障碍的严重程度。PEEP滴定至PEEP接近0 cmH2O时,与更高的正压或负压相比,生存率更高,表明需要平衡肺不张和过度扩张。在床旁,这种方法可以与非侵入性方法(如电阻抗断层扫描(EIT))结合,以可视化通气分布并半定量地估计对PEEP的反应。
考虑到严重ARDS患者中血流动力学损害(包括急性肺心病)的高患病率,应考虑PEEP对血流动力学变量的影响以及对心脏活性药物和液体的需求。在该ARDS亚组中,建议使用超声心动图和先进的血流动力学监测(如肺动脉导管和经肺热稀释法)监测机械通气和心肺功能之间的相互作用。在存在与死亡率增加相关的右心衰竭的情况下,应定期重新评估PEEP对PTP、肺泡复张和过度扩张的反应以及对心肺功能的影响。
在重度ARDS患者中,采用PP和V-V ECMO治疗可改善右心室功能并优化血流动力学。这些策略可以增强氧合,均匀化局部的PTP,并可能降低通气强度。
临床意义
@在没有“最佳”PEEP的情况下,可以同时增强肺泡复张和气体交换,同时避免过度扩张和血流动力学损害,中等水平的PEEP可以提供肺保护,同时最大限度地减少血流动力学损害。
@一旦PEEP设置,定期重新评估其对心肺功能的影响至关重要。
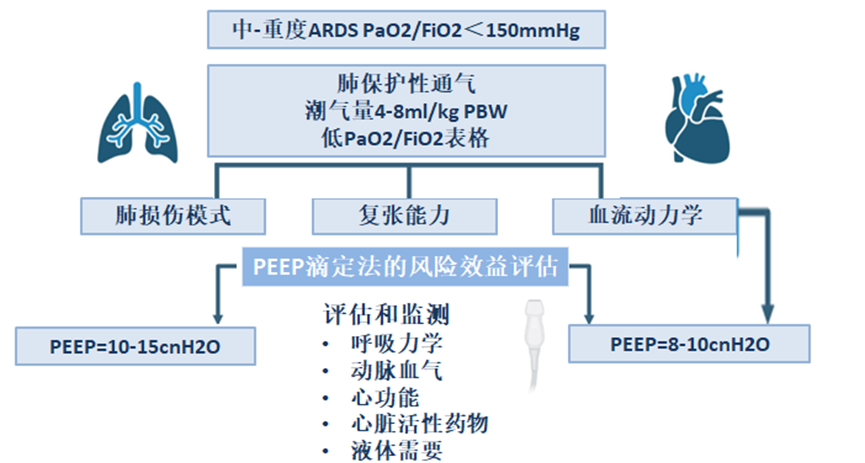
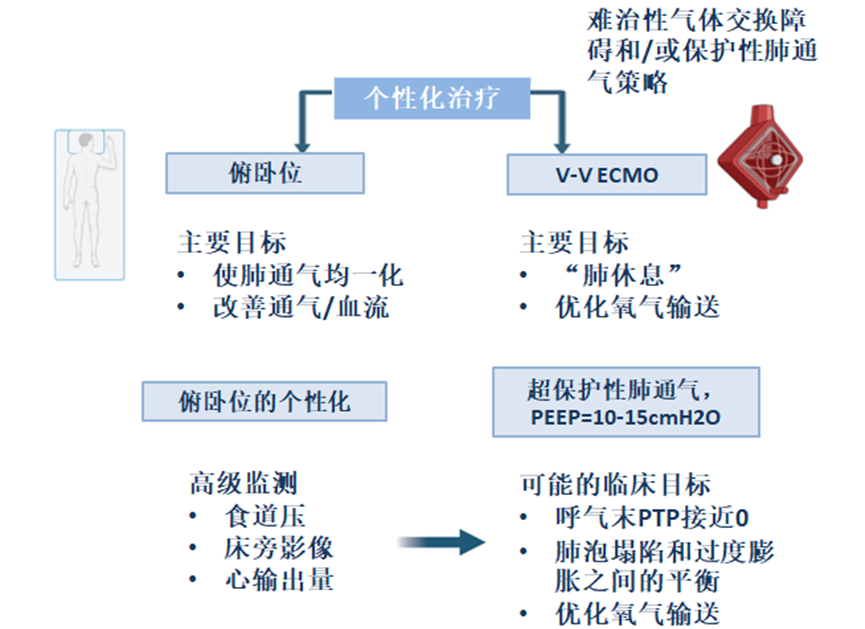
图2:重度ARDS患者俯卧位和V-V ECMO时PEEP滴定和个性化治疗的风险-收益评估可能的算法,PaO2/FiO2:动脉血氧分压除以吸入氧浓度;VT:潮气量;PBW:预测体重;PEEP:呼气末正压;V-V ECMO:静脉-静脉体外膜氧合;PTP:跨肺压
俯卧位
俯卧位的生理效应及其与PEEP的相互作用
根据PROSEVA试验的结果,当前指南建议对中重度ARDS患者(PaO2/FiO2 < 150 mmHg)进行俯卧位通气,以降低死亡率。根据Sud等人最近的一项荟萃分析,在最严重的ARDS患者中(PaO2/FiO2 < 80 mmHg),PP和V-V ECMO均与相对于单独的低或中度呼吸性心动过速的结局改善相关。鉴于PP是重度ARDS的关键治疗,了解PP期间发生的生理变化对于优化PEEP管理至关重要。PP和PEEP可以协同作用,影响呼吸力学、肺容量和气体交换(表1)。

在仰卧位,重力引起垂直胸膜压力梯度,使PTP从肺的腹侧至背侧减低。在重度ARDS患者中,水肿肺的压力、镇静和神经肌肉阻滞会加剧这种胸膜压力梯度,导致背基底肺泡塌陷和通气不均匀性。实验数据表明胸膜压力梯度增加,PEEP水平降低,导致仰卧位非依赖性肺区域的主要通气。虽然增加PEEP可以促进背基底肺泡复张,但也可能导致非依赖性肺区域过度扩张。PP通过降低纵隔的压缩力来降低胸膜压力梯度,从而使局部呼气末和吸气末的胸膜压力PTP分布更加均匀,从而实现通气。此外,PP通过肺复张增加EELV,这与PTP的均匀分布有关。这种通气分布和肺复张的均匀化减少了通气/灌注失调和分流,从而改善了PP期间ARDS患者的气体交换。
如前所述,在重度ARDS患者中,单独使用PEEP可能不会诱导显著的肺复张,并可能导致充气肺实质过度扩张。实验数据表明,PEEP和PP的协同效应优化了依赖性和非依赖性肺区域的局部顺应性,并使经肺动脉驱动压(ΔPTP)最小化。因此,通过降低胸膜压力梯度,PEEP和PP的组合促进了依赖性肺区域的复张,而不会过度扩张非依赖性肺区域,从而可能减轻VILI。
在ARDS患者中,在高PEEP水平下观察到PP可增强肺复张并降低肺泡不稳定性和过度扩张。PP过程中的另一个重要机制是胸壁弹性增加,这会改变区域性肺通气PTP,并通过向背侧转移肺通气来诱导复张,从而改善通气均匀性。通气/灌注匹配的这种改善和分流的减少改善了气体交换。而均质化的区域性呼吸道PTP可减轻机械通气的心肺效应。在伴有右心衰竭的重度ARDS患者中,PP可能有助于减轻右心负荷并优化血流动力学,可能有助于改善患者结局。
PP期间的背侧通气转变和肺泡恢复可能会降低ΔPTP,这是独立于胸壁力学的真实肺顺应性的替代。值得注意的是,实验和临床数据表明,与仰卧位相比,PP期间使用较低PEEP可以实现最小ΔPTP。这表明之前未通气的肺单位的复张和/或已通气肺单位的机械性能得到改善。PP期间的最佳PEEP水平以及在患者体位改变后是否应进行调整仍存在争议,因为缺乏以患者为中心的结局研究。基于呼吸机的测量值并不总是与肺-呼吸系统弹性比的变化相关,而肺-呼吸系统弹性比的变化会显著改变PP期间的肺能量转移,这一事实加剧了这一挑战。
临床资料
在PROSEVA试验中,根据较低的PEEP/FiO2表,证明了PP的死亡率降低,患者最初使用约10 cmH2O的PEEP进行通气。在接下来的7天内,PEEP逐渐降至8-9 cmH2O,无需根据患者体位进行调整。在PROSEVA试验中,由于呼吸周期中肺应力和应变分布更均匀,肺保护得到改善被认为是导致结局改善的主要因素。尽管使用PROSEVA方案的生理学研究并未降低PP的驱动压(ΔP)或MP,但确实显示EELV增加和ΔPTP降低,表明PP期间肺应力和应变分布更均匀。此外,与仰卧位相比,PTP和EELV可以在较低的气道压力下实现,因此PP可以减少每次充气时肺容量的弹性能量传递。
Morais等人最近的一项生理学研究表明,由于PP期间呼吸力学发生了显著变化,因此有必要根据患者体位进行个性化PEEP。使用EIT和食管测压,作者发现PP期间局部和整体呼吸力学的反应不均匀,约50%的患者需要PEEP调整至少4cmH2O。相反,Mezidi等人发现,在仰卧位和PP之间,根据生理终点调整的PEEP没有显著变化。在另一项最近的研究中,根据仰卧位和PP中最低的静态呼吸系统顺应性或呼气末PTP相对于FiO2的阳性值来滴定PEEP。采用这两种策略,PP期间根据生理目标的PEEP滴定较低,导致气道压力和MP降低,同时保留EELV并改善氧合和血流动力学。以呼气末PTP为0至2 cmH2O为目标的食道压引导通气,与仰卧位相比,PP期间PEEP中位数降低5 cmH2O,显示出更低的弹性能量传递,改善气体交换和DO2。
俯卧位对PEEP管理的意义
@PP和PEEP之间的潜在协同作用可能有助于通气均匀化,恢复先前未通气的肺单位,和/或增强已通气肺单位的机械性能,而不会引起局部过度扩张。
@PP可以减少PEEP,从而减少每充肺容量所需的能量,同时保留EELV,优化气体交换,并保持血液动力学稳定性。
@个体对PP反应的显著差异,包括呼吸力学、PTP和气体交换的变化,强调需要在PP期间定期重新评估PEEP设置。
静脉-静脉体外膜肺氧合
V-V ECMO的原理和潜在适应症
对于最严重的ARDS和难治性气体交换障碍患者,根据埃奥利亚试验的合格标准定义(PaO2/FiO2 < 50 mmHg 持续 >3 h,或PaO2/FiO2 < 80 mmHg 持续 >6 h,或pH <7.25且PaCO2 ≥ 60 mmHg持续>6 h,呼吸频率增加至35次/min以及调整机械通气设置以保持平台压≤ 32 mmHg cmH2O),根据现行指南建议使用V-V ECMO 。体外回路促进气体交换,同时采用旨在实现“肺休息”的“超保护”通气策略。这种策略被大多数中到高容量ECMO中心采用,旨在通过降低呼吸机VT、呼吸频率和气道压力来降低肺应力和应变,从而最大限度地减少向发炎肺实质的能量转移。尽管纠正难治性低氧血症至关重要,但使用V-V ECMO管理重度ARDS患者的主要受益被认为是与较低强度机械通气相关的VILI风险降低。
考虑到体外回路可确保充分的气体交换,呼吸机的两个主要目标在接受V-V ECMO的重度ARDS患者后的处理:(1)肺保护以减少VILI;和(2)减少机械通气的血液动力学影响以优化DO2(表2)。后者对于保守治疗无效的右心衰竭重度ARDS患者尤为重要。在这种情况下,V-V ECMO可以促进气体交换,同时允许“超保护”通气策略,最大限度地减少呼吸设置和相关的血液动力学影响。已证明该方法可通过降低缺氧性肺血管收缩和胸内压改善右心室功能,从而降低右心室后负荷并增强右心室偶联。

PEEP是超保护通气策略的一部分
体外循环促进的“超保护”通气策略对PEEP管理具有重要意义。首先,不依赖PEEP通过肺泡复张来确保氧合,因为气体交换主要由体外回路管理。其次,在“超保护”通气过程中,VT和呼吸速率的降低改变了充足的PEEP在潮气通气过程中增加EELV和限制动态应变的作用。此外,在这些患者中,充分PEEP对稳定水肿肺泡和防止周期性肺泡萎陷和重新开放的重要性需要重新评估。
虽然“超保护”通气期间的VT减少降低了过度扩张的风险,但预测体重2至4 ml/kg的VT,结合中度PEEP水平和有限的气道平台压,仍可能导致重度ARDS患者(特别是EELV非常低的患者)的局部过度扩张和VILI 。根据现行的ARDS指南并使用PEEP/FiO2表,符合V-V ECMO条件的患者最初应使用16至24 cmH2O的经验PEEP进行管理。体外循环生命支持组织(ELSO)建议PEEP水平在10 - 24 cmH2O之间,同时维持吸气平台压低于25 cmH2O。因此,V-V ECMO治疗期间的PEEP管理在不同中心之间存在相当大的差异。LIFEGARDS研究中的参与中心使用的平均PEEP为11 ± 3 cmH2O。同样,塞萨尔和埃奥利亚试验使用了10 - 12 cmH2O的PEEP范围,以促进“肺休息”。尽管有许多研究评价了呼吸机设置(包括PEEP)对V-V ECMO期间患者结局的影响,但关于最佳PEEP的结果并不一致。最近的分析确定了更多的综合通气参数,如ΔP和MP,作为该ARDS亚组死亡率的独立预测因子。迄今为止,改善V-V ECMO治疗重度ARDS患者结局的最佳PEEP策略仍不清楚。在开始体外支持和“超保护”通气后,使用中等水平的PEEP(10 - 15 cmH2O)可能是合理的,以平衡该ARDS亚组的肺保护和血流动力学稳定性。PEEP设置的进一步个性化应通过PEEP在心肺功能方面的获益和风险的临床评估来指导,以最大限度地减少VILI,保持血流动力学稳定性,并优化DO2(图1)。
临床和实验数据
在需要V-V ECMO治疗的最严重ARDS患者中,可复张差异很大,影响PEEP相关的获益和风险。Franchineau等人在一项使用EIT的生理学研究中确定了47%入选患者的最佳PEEP为15 cmH2O,40%入选患者的最佳PEEP为10 cmH2O,定义为防止肺泡塌陷和避免过度扩张之间的折衷,其分别可导致过度扩张导致肺损伤和容量性肺损伤。Graf等人,在V-V ECMO患者中通过计算机断层扫描定量肺体积,发现滴定PEEP使静态肺应变增加约1.5倍,而不增加依赖性肺区域,导致非依赖性肺应变显著升高。尽管平均PEEP为15.4cmH2O,但观察到潮气量复张,潮气量VT为3 ml/kg预测体重。在V-V ECMO和“超保护”通气期间,设置PEEP以达到最小化ΔP并防止周期性肺泡萎陷,同时限制气道平台压力以避免非依赖性肺过度扩张可能是具有挑战性的。接受周期性肺泡开放和关闭(肺不张损伤),同时避免与容量创伤相关的高气道压力(主要在非依赖性肺组织中),可能有利于减少V-V ECMO初始阶段的肺部炎症。这种方法最大限度地减少了向肺实质的能量转移,这反映在MP中。尽管目前正在讨论每种MP成分的重要性,但总体MP较高会增加ARDS患者发生VILI的风险,并与V-V ECMO治疗期间的死亡率相关。
采用低创伤性的通气策略和适度的PEEP水平,以促进“肺休息”,可以提供肺保护和心肺功能之间的有利平衡。在V-V ECMO管理的实验性ARDS模型中,10 cmH2 O的中等PEEP水平在维持血流动力学稳定的同时最小化肺损伤。相反,不恰当的PEEP,无论过低还是过高,都会分别加重肺损伤或加速血流动力学衰竭。比较等效总MP与不同静态和动态成分的实验研究显示了相似的肺损伤结局,高PEEP对血流动力学的影响最大,需要予以药物控制。然而,V-V ECMO治疗期间PEEP不足可能导致进行性肺泡塌陷,随后可能增加肺血管阻力。在最严重的ARDS患者的“超保护”通气期间使用中等PEEP水平时,需要考虑的另一个方面是存在完全气道闭合,这可能混淆呼吸力学评估,并导致脱氮引起的肺不张。
PEEP引起的局部呼吸机PTP的变化决定了机械通气的心肺效应,特别是在具有显著通气异质性的重度ARDS患者中。PEEP不足导致的肺不张可导致右心衰竭,而PEEP过度导致的肺过度扩张会损害肺循环,并减少心输出量。因此,个人恢复能力以及肺复张和过度扩张之间的平衡是PEEP管理中维持血流动力学稳定性和优化DO2的关键考虑因素。最近一项在使用V-V ECMO治疗重度ARDS患者的研究中,比较了ELSO推荐的最低PEEP(10 cmH2O)的中度经验PEEP水平与“超保护性”通气期间,基于最高呼吸系统依从性(平均16.2±4.7 cmH2O)和呼气末PTP为0 cmH2O(平均17.3±4.7 cmH2O)的个体化PEEP滴定。尽管呼吸力学指导的PEEP滴定与经验PEEP 10 cmH2O相比降低了ΔPTP,但两种方法均增加了MP和肺应力,导致心输出量和CO2减少,潜在地损害了体外回路维持组织正常氧合的目标。值得注意的是,肺复张性未使用影像学或生理操作进行正式评估。在研究队列中,较高的PEEP没有显著恢复肺功能,这与该ARDS亚组中的先前发现一致。研究队列中较高的疾病严重程度和多器官功能障碍也可能导致与较高PEEP相关的血流动力学损害。
V-V ECMO对PEEP管理的意义
@在V-V ECMO治疗的严重ARDS患者的“超保护”通气期间设置PEEP,特别是在涉及多器官功能障碍和休克的治疗初始阶段,应努力平衡肺保护与血流动力学稳定性。
@作为“肺休息”策略的一部分,中等水平的PEEP(10至15 cmH2O)可能适用于该ARDS亚组,以最大限度地减少VILI,维持血流动力学稳定性,并优化呼吸道DO2。
@V-V ECMO期间PEEP的进一步个性化需要定期评估PEEP在心肺功能方面的获益和风险。
结论
在以肺损伤模式、呼吸力学、血流动力学和潜在多器官功能障碍的显著异质性为特征的重度ARDS患者中,需要仔细评估PEEP在心肺功能方面的获益和风险。在这些患者中,PP的使用及其与PEEP的协同作用,通气分布对PEEP管理有重要意义,因此有必要在PP期间重新评估PEEP设置。使用V-V ECMO管理最严重的ARDS患者有助于气体交换并允许“肺休息”策略。在这个ARDS亚组中,在“超保护”通气期间适度的PEEP水平可以平衡肺保护和血流动力学稳定性。个体化评估和仔细的PEEP滴定对于优化呼吸机管理和改善患者结局至关重要。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














PEEP的受益和危害之间的平衡主要取决于其对肺复张的影响
16
#ARDS# #呼气末正压#
32