前沿诊断技术 | 肿瘤免疫微环境有效预测晚期非小细胞肺癌免疫治疗疗效!
2024-01-15 上海阿克曼病理 上海阿克曼病理 发表于陕西省
该项研究意味着肿瘤免疫微环境检测未来将成为晚期NSCLC患者开展有效免疫治疗的评估利器。
近年来,肿瘤的免疫治疗联合化疗已经成为晚期非小细胞肺癌的一级推荐治疗,II期和III期的二级推荐 [1]。然而,目前免疫治疗的优势人群仍不清楚,现有的TMB和PD-L1等标志物预测价值也有限,因此迫切需要寻找更有效的生物标志物来筛选获益人群。
其中一个原因是,肿瘤会通过采用各种方法来适应并最终抵抗机体的免疫攻击。这些机制统称为适应性免疫抵抗(AIR) [2]。肿瘤微环境(TME)对AIR的产生有重要的作用。因此,了解TME应该是指导及改进当前癌症治疗的实用方法的关键焦点。
近日,国际知名肿瘤学期刊《胸部肿瘤期刊》(Journal of Thoracic Oncology)发表了一篇中山大学肿瘤防治中心的最新研究成果:联合PD-L1表达和免疫浸润水平的肿瘤免疫微环境(TIME)综合分型模型可有效预测晚期非小细胞肺癌(NSCLC)患者免疫治疗联合化疗的疗效。这是首个在Ⅲ期随机对照临床试验中证明了PD-L1高表达且免疫浸润高的晚期NSCLC患者是免疫治疗优势人群的研究。该研究结果显示:在85例PD-L1 mRNA表达较高的患者中,62例(72.9%)同时具有较高的肿瘤免疫浸润(图1A)。同时,PD-L1 mRNA表达与免疫评分表现出显著的相关性(图1B)。该项研究意味着肿瘤免疫微环境检测未来将成为晚期NSCLC患者开展有效免疫治疗的评估利器。
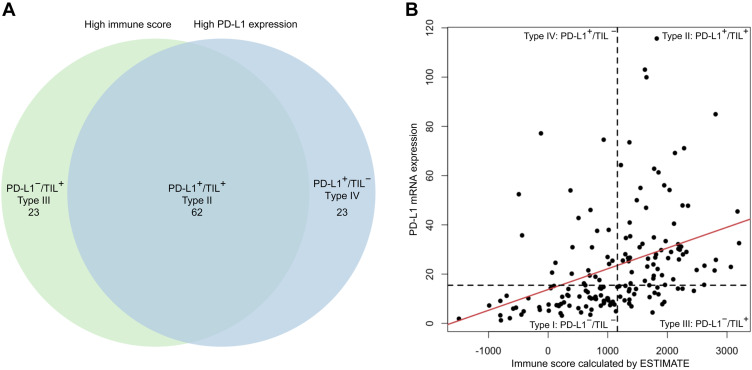
(图1A:高免疫评分和高PD-L1 mRNA表达的患者之间的重叠。图1B:PD-L1 mRNA表达与免疫评分之间显著相关(Rs,0.53,p < 0.001))
01 什么是肿瘤微环境和肿瘤免疫微环境?
组成肿瘤的各种成分称为肿瘤微环境(TME),TME的具体组成因肿瘤类型而异,但大多数具有标志性特征,包括肿瘤细胞,免疫细胞,基质细胞,细胞外基质(ECM),血管,可溶性因子和物理性质 [3] [4]。
而肿瘤免疫微环境(TIME)的定义则是:在TME中,所有免疫成分都被明确定义为,因为它们在肿瘤生物学中具有独特的内部相互作用和重要作用,包括先天免疫细胞,适应性免疫细胞,细胞外免疫因子和细胞表面分子 [5] [6] [7]。
所以,肿瘤微环境是以肿瘤为中心、包含众多物质的一个微小社区;而肿瘤免疫微环境则是这个微小社区里面负责免疫功能的一个群体,包括免疫细胞和相关免疫因子。研究表明,TIME中的免疫细胞的组成对临床治疗疗效有着重要的影响 [8]。例如,T细胞浸润较多的三阴性乳腺癌(TNBC)通常比T细胞发炎较少的乳腺癌预后更好 [9]。
02 肿瘤免疫微环境有哪些分类?
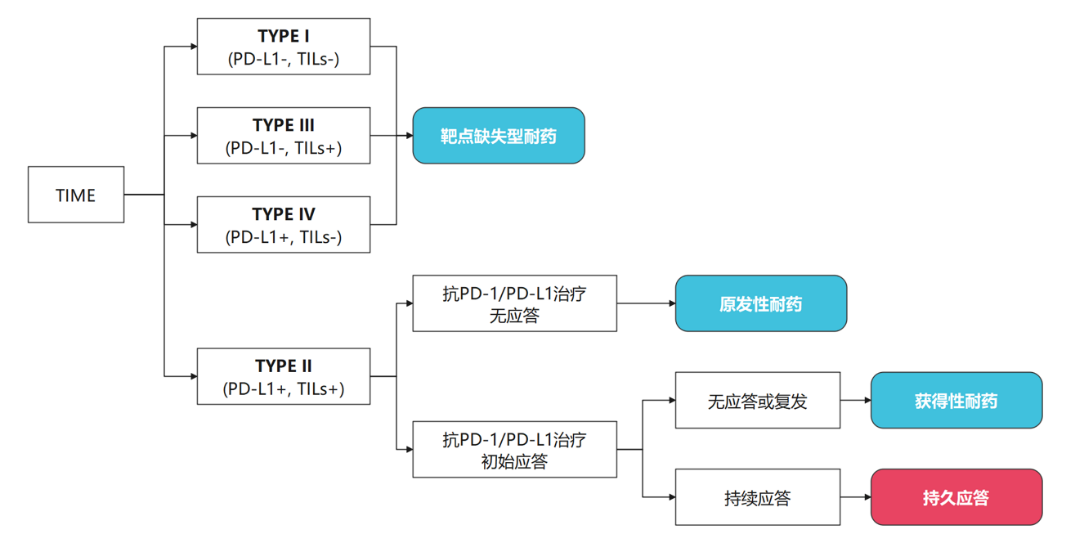
提出可以结合肿瘤细胞PD-L1的表达和肿瘤周围浸润淋巴细胞(TIL)将肿瘤分为四种类型:PD-L1低/TIL低(I型)、PD-L1高/TIL高(II型)、PD-L1低/TIL高(III型)和PD-L1高/TIL低(IV型)。理论上,只有II型肿瘤才对抗PD-1/PD-L1免疫检查点抑制剂治疗敏感 [10]。
03 肿瘤免疫微环境细胞的构成
免疫检查点(PD-1、PD-L1)的临床意义
免疫检查点属于免疫系统的调节机制。这些途径主要是防止机体过度免疫,从而防止免疫系统不分青红皂白地攻击细胞。然而,一些癌症可以通过刺激免疫检查点靶点来保护自己免受攻击。
常见的免疫检查点:
PD-1:程序性死亡受体1(Programmed Death Protein 1,PD-1)是一种重要的免疫检查点,属于CD28超家族。PD-1主要表达于活化的T细胞和B细胞、自然杀伤细胞(NK细胞)、单核细胞以及部分肿瘤细胞 [11] [12]。其功能是抑制免疫细胞的过度激活,这是免疫系统一种正常的自稳机制,类似汽车的刹车系统,在免疫系统受刺激过度激活时及时“刹车”,使免疫系统的激活程度保持在正常范围内。
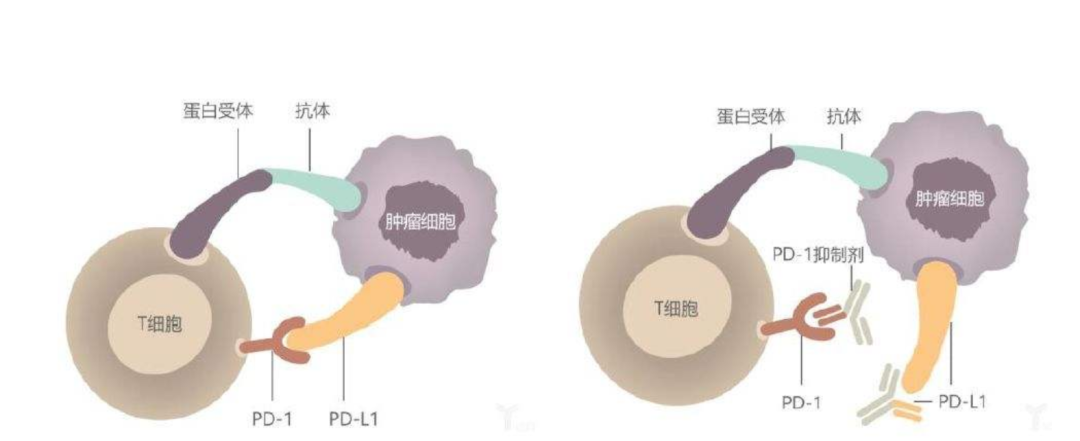
PD-L1:即程序性死亡配体1(Programmed death ligand 1,PD-L1)。在肿瘤微环境中,PD-L1及少量的PD-L2表达于肿瘤细胞。肿瘤细胞PD-L1与肿瘤浸润淋巴细胞(TILs)上的PD-1相互作用被认为是肿瘤发生免疫逃逸的主要机制,因此是非常具有吸引力的治疗靶标 [13] [14]。用免疫检查点抑制剂(Immune Checkpoint Blockade,ICB)阻断PD-1和PD-L1之间的相互作用可以激活宿主抗肿瘤免疫从而起到杀伤肿瘤细胞的作用。
肿瘤浸润性淋巴细胞(CD4、CD8、Foxp3)的临床意义
肿瘤浸润性淋巴细胞 (Tumor Infiltrating Lymphocytes, TILs) 是指离开血液进入到肿瘤中的淋巴细胞,为肿瘤微环境中的一大重要组成部份。
常见的肿瘤浸润性淋巴细胞:
CD8:CD8分子是一种白细胞分化抗原,约30%~35%的T细胞表达CD8,这些细胞会识别由8~10个氨基酸残基组成的抗原肽(受自身MHCI类分子的限制),并在活化后分化为具有细胞毒作用的细胞毒性T细胞(CTL),可以特异性杀伤癌细胞。
CD68:CD68在人类巨噬细胞表面广泛表达,是识别巨噬细胞的关键生物标记物。对免疫微环境中的CD68蛋白进行标记有利于标记出巨噬细胞的数量、定位和分布情况。PD-L1在肿瘤细胞和免疫细胞中表达,并且都与免疫检查点抑制剂疗法的反应有关,表达于巨噬细胞表面的PD-L1参与抑制激活型T细胞,介导免疫逃逸。
Pan-CK:Pan-CK是广谱细胞角蛋白,染色Pan-CK主要用于上皮与非上皮成分的鉴别诊断,如低分化癌与肉瘤、淋巴瘤等的鉴别。
FoxP3:FoxP3是控制调节性T细胞(Treg)发育和功能的关键转录因子之一,被认为是Treg的标志性分子,其主要表达在CD4+ T细胞亚群中,在免疫系统中发挥抑制作用。Treg细胞通过分泌免疫抑制性细胞因子(包括白细胞介素IL-2、IL-10、IL-35和TGF-β)及表达CTLA-4和PD-1等检查点分子抑制CD4+和CD8+T细胞的活性以维持自身耐受性。FoxP3蛋白的检测用于标记免疫微环境中的Treg细胞。
04 肿瘤免疫微环境细胞的检测方式
可以通过多重免疫荧光技术 (Multiplex Immunofluorescence,m/IF) 检测免疫微环境相关细胞的靶标,综合评估肿瘤免疫微环境。这项技术允许在单一组织切片上同时检测多个抗体靶标,并对免疫细胞组成及原位信息进行评估研究。
多重免疫荧光技术优势:
多靶标:通过顺次单标、多轮复染的方式实现在同一张FFPE切片上同时检测多个靶标,相比传统IHC/IF可以用较少的样本进行多种靶标检测。
更灵敏:利用酪胺信号放大(Tyramine Signal Amplification, TSA)技术,信号稳定持久,可大幅提高检测灵敏度,有利于检测低丰度样本。
更准确:TSA技术采用荧光信号与抗原共价键结合,可通过微波加热洗脱抗体,减少了对样本和抗原的损伤,增加了重复实验的准确性。另外,不需要后期图像对齐,信号同时存在一张图像上,改善了靶标间的准确性和稳定性。
05 哪些患者适合检测肿瘤免疫微环境?
lIV期无驱动基因突变或靶向药物治疗不理想的非小细胞肺癌患者。
lⅡ期、Ⅲ期根治性手术后需用免疫药物开展辅助治疗的非小细胞肺癌患者。
06 肿瘤免疫微环境检测的样本要求?
可选样本类型:石蜡切片、蜡块或组织样本。
注意:如果是石蜡切片,需要提供防脱白片5~10张;如果是组织样本,则需要提供10%福尔马林固定的组织样本。
参考文献
[1] 中国临床肿瘤学会 (CSCO)。《非小细胞肺癌诊疗指南2022》.
[2] “Kim TK, Vandsemb EN, Herbst RS, Chen L. Adaptive immune resistance at the tumour site: mechanisms and therapeutic opportunities. Nat Rev Drug Discov. 2022 Jul;21(7):529-540.”.
[3] “Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144(5):646–74.”.
[4] “Bader JE, Voss K, Rathmell JC. Targeting metabolism to improve the tumor microenvironment for cancer immunotherapy. Mol Cell. 2020;78(6):1019–33.”.
[5] “Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol. 2013;14(10):1014–22.”.
[6] “Binnewies M, Roberts EW, Kersten K, Chan V, Fearon DF, Merad M, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nat Med. 2018;24(5):541–50.”.
[7] “Greten FR, Grivennikov SI. Inflammation and cancer: triggers, mechanisms, and consequences. Immunity. 2019;51(1):27–41.”.
[8] “Riera-Domingo C, Audige A, Granja S, Cheng WC, Ho PC, Baltazar F, et al. Immunity, hypoxia, and metabolism-the menage a trois of cancer: implications for immunotherapy. Physiol Rev. 2020;100(1):1–102”.
[9] “Zemek RM, De Jong E, Chin WL, Schuster IS, Fear VS, Casey TH, et al. Sensitization to immune checkpoint blockade through activation of a STAT1/NK axis in the tumor microenvironment. Sci Transl Med. 2019;11(501).”.
[10] “Kim TK, Herbst RS, Chen L. Defining and Understanding Adaptive Resistance in Cancer Immunotherapy. Trends Immunol. 2018 Aug;39(8):624-631.”.
[11] Giraldo NA, Nguyen P, Engle EL, et al. Multidimensional, quantitative assessment of PD-1/PD-L1 expression in patients with Merkel cell carcinoma and association with response to pembrolizumab. J Immunother Cancer. 2018;6: 99.
[12] “Di Raimondo C, Rubio-Gonzalez B, Palmer J, et al. Expression of immune checkpoint molecules programmed death protein 1, programmed death-ligand 1 and inducible T-cell co-stimulator in mycosis fungoides and Sezary syndrome: association with disease stage a”.
[13] “Morad G, Helmink BA, Sharma P, Wargo JA. Hallmarks of response, resistance, and toxicity to immune checkpoint blockade. Cell. 2021;184: 5309-5337.”.
[14] “Lee JB, Ha SJ, Kim HR. Clinical Insights Into Novel Immune Checkpoint Inhibitors. Front Pharmacol. 2021;12: 681320.”.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













目前免疫治疗的优势人群仍不清楚
76