Blood:双功能的PD-1xαCD33xαCD33融合蛋白可逆转急性髓系白血病的适应性免疫逃逸
2018-10-07 MedSci MedSci原创
靶向CD33的双特异性T细胞衔接器(BiTER)AMG330,在体外和小鼠模型中均被证明可高效调节急性髓系白血病(AML)细胞的细胞溶解。但T细胞激活与PD-L1和AML细胞上的其他抑制检查点上调相关,而PD-L1和抑制检查点上调又会导致适应性免疫耐受。PD1和PD-L1阻滞剂或许可中和T细胞功能障碍,但是,这会导致广泛的免疫相关的副反应(irAEs)。Monika Herrmann等人开发出一种
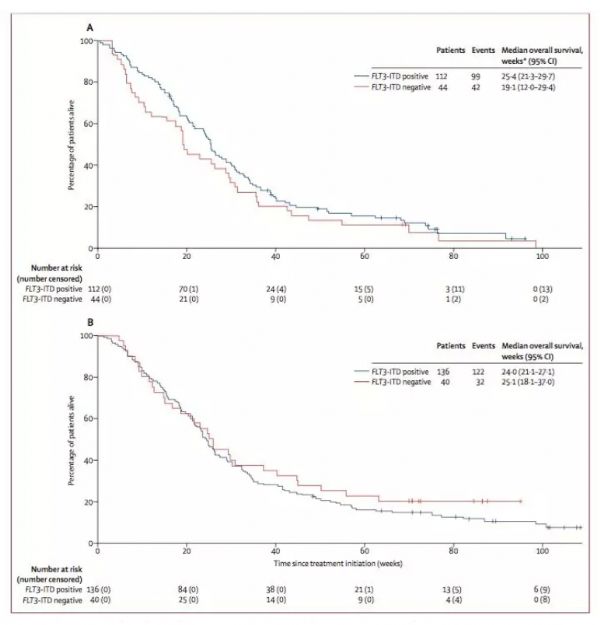
Monika Herrmann等人开发出一种双重功能的检查点抑制T细胞结合(CiTE)抗体,该抗体可促进T细胞与AML上的CD33结合,同时局部限制免疫检查点封闭。这一点是通过融合PD-1的胞外结构域(PD-1ex)实现的,PD-1ex对PD-L1、αCD3.αCD33BiTER样支架的自然亲和力较低。通过检查点封闭和亲和力依赖性锚定的协同效应,PD-1ex连接体增强了T细胞激活(IFN-γ升高3.3倍),同时促进针对CD33+PD-L1+细胞系和患者来源的AML细胞产生高选择性高效的细胞毒性作用。在小鼠移植瘤模型中,CiTE可诱导完全消除AML,且无免疫相关副反应的初始迹象,即体重减轻。
综上所述,Monika Herrmann等人开发出的分子可优先靶向AML细胞,而高亲和力阻滞剂,如临床所批准的抗癌药,同时会靶向PD-L1+的非AML细胞。通过在一个单分子中结合免疫检查点封闭和T细胞激活的高效性,研究人员有望将与系统应用免疫检查点抑制剂相关的irAEs降至最低,为患者提供高潜能的治疗方案,特别是复发型/难治性AML患者。
Monika Herrmann,et al.Bifunctional PD-1 x αCD3 x αCD33 fusion protein reverses adaptive immune escape in acute myeloid leukemia. Blood 2018 :blood-2018-05-849802; doi: https://doi.org/10.1182/blood-2018-05-849802
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#适应性免疫逃逸#
55
#融合蛋白#
67
#髓系白血病#
49
#适应性免疫#
62
学习
80
#融合#
37
#CD33#
69
#适应性#
46