Nature子刊:徐华强/庄友文团队揭示过敏毒素识别补体受体系统的分子模式和选择性机理
2023-05-19 生物世界 生物世界 发表于上海
该研究首先利用冷冻电镜技术方法获得了C3a结合C3aR,无配体结合的C3aR和C5a结合C5aR1分别偶联下游Gi蛋白异源三聚体的高分辨率复合体结构,结合大量突变研究结果。
补体是先天免疫系统的重要组成部分,对于防御微生物感染以及清除免疫复合物和受损细胞至关重要。补体激活过程除了产生攻膜复合物MAC(membrane-attack complex)杀灭病原菌发挥免疫防御之外,同时也产生多种活性物质发挥免疫调节功能,包括被称为过敏毒素的系列碱性肽,例如C3a和C5a。在功能上,过敏毒素既发挥固有免疫防御活性,又同时参与调控获得性免疫中T细胞活性等。
C3a和C5a是重要的炎症介质,两者虽然在氨基酸序列和结构上相似,但却分别特异性结合并激活细胞膜上不同的G蛋白偶联受体(G-protein coupled receptor, GPCR),C3aR和C5aR(C5aR1/ C5aR2)发挥生理功能。C3aR,C5aR1和C5aR2三种补体受体均属于Class A类GPCR,构成GPCR超家族中的补体受体亚家族。C5aR1(CD88)和C5aR2(C5L2或GPR77)为C5aR的两种亚型,二者均可被C5a以高亲和力结合并激活。C3aR和C5aR广泛分布在中性粒细胞和肥大细胞等免疫细胞中,其中,C3aR 与C5aR1 是典型的GPCR,被过敏毒素激活后通过活化G蛋白Gi/o介导下游信号通路,或者介导非G蛋白依赖的β-arrestin信号传导。作为趋化类GPCR,C5aR1与甲酰肽受体(FPRs)、趋化因子受体、白三烯B4受体(BLTRs)和前列腺素D2受体2 (CRTH2)等GPCR在进化上高度同源,共同构成一个Gi偶联的趋化因子受体亚家族,在固有免疫防御以及炎症发生和消除过程中发挥重要作用。与C3aR和C5aR1不同的是,C5aR2并不表现Gi蛋白偶联和信号活性,对β-arrestin信号存在天然的偏向性。
C3a轴和C5a轴信号传导构成补体系统免疫的重要组成部分,在炎症反应发生发展过程中扮演重要角色。过去近二十年的研究发现,补体系统的过度激活以及C3a轴和C5a轴信号通路异常与多种严重的急性或慢性炎症疾病的发生发展密切相关,包括败血症、类风湿性关节炎、哮喘和新冠病毒SARS-CoV-2引起的急性呼吸衰竭等。靶向调节C3a-C3aR和C5a-C5aR相互作用进而干预炎症反应的发生与进程展现出对这些疾病的巨大治疗潜力,同时也是科学研究和治疗炎症相关疾病药物开发的热点。2021年,FDA批准了首个靶向C5aR1的选择性抑制剂Avacopan用于抗中性粒细胞胞质自身抗体相关性血管炎。然而,过敏毒素C3a和C5a如何结合并激活其特异性受体介导信号传递的机制长期处于未知状态,严重制约了相关靶向药物发现进程。
2023年5月11日,中国科学院上海药物研究所徐华强研究员、庄友文副研究员在 Nature Chemical Biology 期刊发表了题为:Revealing the signaling of complement receptors C3aR and C5aR1 by anaphylatoxins 的研究论文。
该研究首先利用冷冻电镜技术方法获得了C3a结合C3aR,无配体结合的C3aR和C5a结合C5aR1分别偶联下游Gi蛋白异源三聚体的高分辨率复合体结构,结合大量突变研究结果,该团队解释了过敏毒素识别补体受体的独特作用机制,由配体结合口袋的拓扑特征介导的选择性机制,以及与趋化因子受体不同的作用模式等科学问题。

C3a 和C5a分别由77和74个氨基酸构成,且含三对分子内二硫键,该研究团队首先尝试了多种外源表达策略和优化手段,实现了具备高生物活性的重组过敏毒素蛋白分子的异源高表达和有效纯化。C3aR的第二个胞外环ECL2具有172个氨基酸,C3aR和C5aR1分别含有多个酪氨酸磺酸化翻译后修饰,这些结构特征赋予了该受体家族难表达、不稳定的特性。该研究团队前期经过大量摸索,包括标签筛选、组装方式、去垢剂优化等技术手段,最终克服了过敏毒素-补体受体复合物不稳定和冷冻电镜样品难进孔等技术难题,获得了分辨率为2.9-3.2Å的电镜结构。
研究发现,C3a 和C5a均以羧基端(C端)插入正构结合口袋的方式识别补体受体,这与趋化因子和甲酰肽等其他多肽趋化类炎症介质以氨基端(N端)插入的方式识别受体的模式不同(甲酰肽受体FPRs能模式化识别含甲酰化甲硫氨酸标记的甲酰肽,参与固有免疫防御和活性调节。研究团队前期报道了甲酰肽受体FPR1和FPR2在甲酰肽和其他多肽炎症分子等激活下的系列结构,揭示了FPRs识别甲酰肽等的保守分子模式和潜在的激活机理等)。结构表明,C3a和C5a的C末端loop区均以“Hook”构象将之锚定到受体的正性结合口袋,并且构成与受体互作的主要界面。该团队通过结构分析,将C3a和C3aR的结合分为两个部分,分别为正性结合口袋和胞外结合域,即“两位点模型”。然而,C5a在此基础上多了与C5aR1的N末端的相互作用,即“三位点模型”,更类似于趋化因子与趋化因子受体的识别模式。C5a与C5aR1的N末端的直接相互作用促使了整个C5a的α螺旋核心区域相对于C3a在C3aR的结合模式偏转了约84°。相比之下,C5a在C5aR1的结合口袋大小比C3a在C3aR中的高出了447 ų。
C3a和C5a的C端序列,尤其是C末端的精氨酸,对于两者激活各自受体至关重要。该研究结合大量受体和配体的突变功能实验结果,发现C3a 和C5a的C末端精氨酸的侧链插入到补体受体TM6/7附近保守的带负电结合口袋,与受体的D7.35形成静电作用,并与Y6.51形成阳离子-π相互作用,这对补体受体的识别和激活至关重要。通过C3a和C5a的C末端氨基酸互换,发现C3a的C末端对完全激活C3aR具有不可替代性,而C5a的C末端替换为C3a相应的氨基酸(长度为5个氨基酸),依然可以完全激活C5aR1,将替换长度增加为10个氨基酸,则减弱1000倍的亲和力,揭示了C5aR1的胞外端对识别C5a极为关键。
这些结果共同阐述了过敏毒素C3a 和C5a保守的分子识别模式,以及各自的受体选择性拓扑结构决定因素,为靶向补体受体C3aR和C5aR1的药物研发提供了结构和功能基础,同时,完善并深化了我们对补体系统信号传导分子机制的认识。
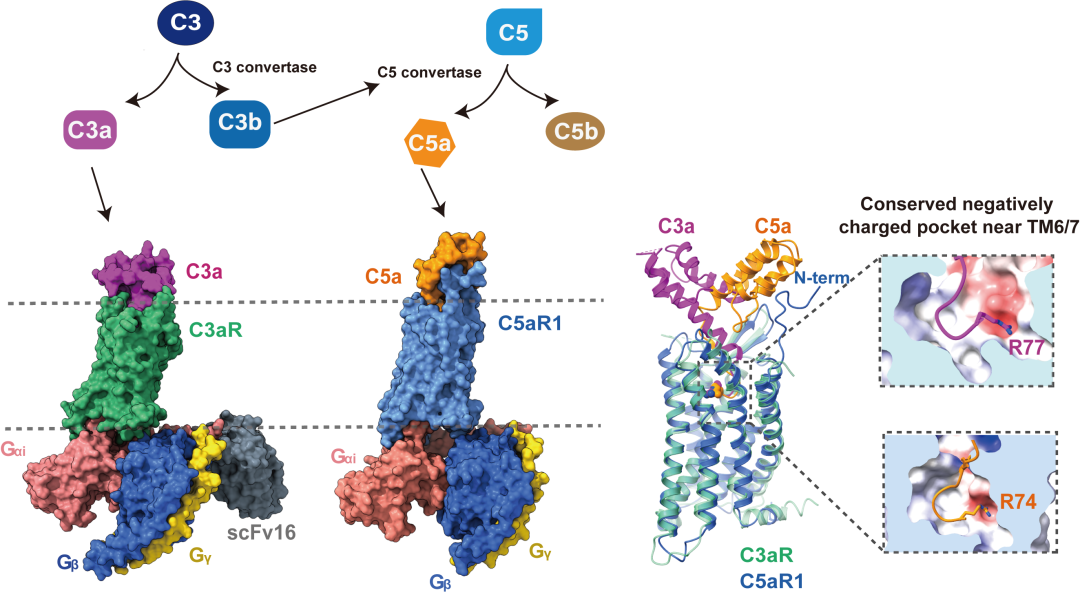
图1. 补体受体与过敏毒素识别的结构示意图。过敏毒素C3a和C5a与各自特异性受体的结合模式差异较大,尤其体现在C3a和C5a的α螺旋核心区域与受体的互作。然而,两者的C末端与补体受体的结合具有保守的分子识别模式。
论文链接:
https://www.nature.com/articles/s41589-023-01339-w
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








