陈学思院士最新AM:凝聚驱动的半渗透性纳米反应器,用于酶级联介导的癌症联合治疗
2024-09-08 BioMed科技 BioMed科技 发表于上海
介绍基于酶级联的癌症疗法及挑战,阐述新型纳米反应器 HGS-PCV 的设计、性能及治疗机制,为癌症治疗提供新途径。
基于酶级联过程的癌症疗法
酶级联(Enzyme cascades)是生物学过程中的关键组成,也是癌症治疗中一种新兴的方法,其特点是具有复杂的生物化学反应网络。在酶的启动下,级联反应的每一步都会产生一种化合物,作为后续酶反应的底物,从而产生最终的治疗化合物。与传统疗法相比,这一过程提供了高度特异性、可控性和有效的方法,在提高疗效的同时最大限度地减少了不良反应。尽管天然酶具有巨大的潜力,但它们面临着固有的挑战,如不稳定、活性降低和肿瘤选择性有限。
鉴于邻近效应的存在,创建类似于自然界的空间受限微环境对于高效的酶级联反应至关重要。因此,开发简单可调的中空纳米反应器,以其独特的包膜形态有望成为封装酶的理想仿生系统。一方面,脂质体以其生物相容性而闻名,通常可用于酶封装,但同时这一体系也存在着内在不稳定性。另一方面,无机空心球具有优异的渗透性和机械稳定性,但由于严格的合成条件,可能会损害酶的功能。此外,尽管聚合物具有稳定性和生物相容性,但它们在膜渗透性和复杂的合成过程方面存在挑战。为了解决这些限制,下一代空心纳米反应器应将易于合成、高生物相容性和可调节的半渗透性等诸多特点相结合,智能地响应肿瘤微环境(TME),以更好地改善癌症治疗。
凝聚驱动的纳米反应器
有鉴于此,吉林大学陈学思院士和孙静教授等人开发了基于仿生同源多肽的乳糖酸(lactobionic acid,LA)修饰、TME响应性聚电解质复合囊泡(HGS-PCV),可作为一种简单、智能和高效的纳米反应器以封装葡萄糖氧化酶(GOx)、血红蛋白(Hb)和索拉非尼(SRF),用于治疗肝癌细胞。HGS-PCV的TME响应性渗透行为使葡萄糖能够选择性地进入其内部,从而在肿瘤内引发酶级联反应。这个复杂的过程可产生有毒的羟基自由基,同时降低pH。而这种pH变化增强了SRF的释放,有效地促进了靶癌症细胞的铁死亡和凋亡。此外,给予HGS-PCV不仅会引发免疫原性细胞死亡,而且在诱导淋巴结内树突状细胞成熟方面也起着至关重要的作用。它刺激适应性T细胞反应,有助于阻止体内远端肿瘤的生长。相关工作以“Coacervation-Driven Semipermeable Nanoreactors for Enzymatic Cascade-Mediated Cancer Combination Therapy with Enhanced Efficacy”为题发表在Advanced Materials。

【文章要点】
一、HGS-PCVs的设计制备
复杂凝聚是一种植根于液-液相分离的现象,这为设计功能性纳米反应器提供了思路,以期能够在不需要有机溶剂的情况下封装各种生物分子。然而,由传统聚电解质衍生的复杂凝聚层存在显著缺点,即它们倾向于产生不规则、不稳定和广泛分散的结构,再加上在水溶液中也缺乏可调性。为了应对这些挑战,作者提出了一种开创性的解决方案,即基于仿生同聚肽类化合物设计两性离子聚电解质复合物纳米囊泡(PCV),以直接通过凝聚来创建一个新颖的智能纳米反应器平台(图1)。为此,作者通过N-烯丙基-N-羧酸酐的开环聚合,然后进行后聚合官能化,制备了均聚类肽(homopolypeptoid)聚N-烯丙基甘氨酸(PNAG)。随后,作者用半胱胺盐酸盐和3-巯基丙酸对PNAG进行化学修饰,分别得到PNAG-g-NH2和PNAG-g-COOH。之后,作者还通过PNAG-g-NH2的氨基与LA的羧基之间的直接碳二亚胺酰胺化反应合成LA修饰的PNAG-g-NH2是。在化学计量平衡下,使用LA改性的PNAG-g-NH2和PNAG-g-COOH在水中制备具有中空结构的PCV。最后,作者将Hb/GOx/SRF的组合封装到PCV中,以获得酶级联纳米反应器HGS-PCV。
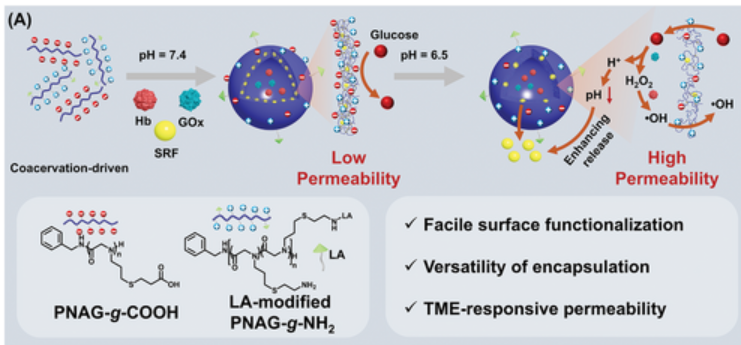
图1 HGS-PCVs的设计
二、HGS-PCVs的性能
SRF是唯一被批准的HCC多激酶抑制剂,存在脱靶副作用和不良药代动力学。PCV的表面功能化使其能够修饰LA,以靶向递送至肝癌细胞。此外,PCV的多功能性有助于在囊泡膜内有效装载疏水性SRF,同时在内水腔内封装酶级联物(Hb和GOx)。更重要的是,HGS-PCV的TME响应性电荷改变调节了渗透性。如图2所示,癌细胞的加速膨胀和增殖需要大量的葡萄糖摄取。由于其固有的离子性质,PCV表现出显著的半渗透性,促进葡萄糖等小分子渗透到其内部。进入PCV后,GOx催化的葡萄糖酶降解导致H2O2和葡萄糖酸的产生,从而导致系统pH值降低。由于过量电荷的存在,pH降低会增加聚合物链之间的排斥相互作用,而宽敞的膜结构最终导致药物的快速释放。同时,产生的H2O2进一步引发了涉及Hb的级联反应,最终导致有毒•OH的产生。
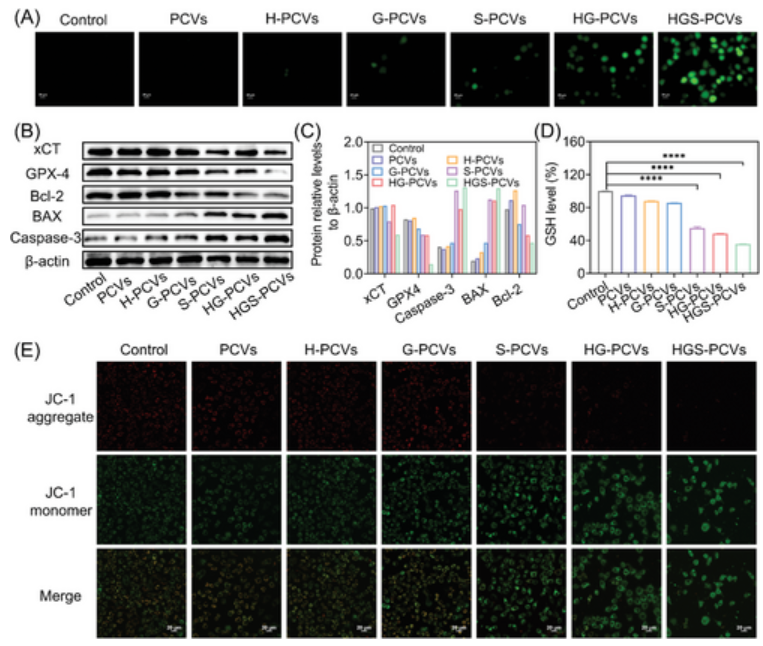
图2 HGS-PCVs的的治疗机制
三、治疗机制及治疗效力
上述过程高效产生的 •OH促进脂质过氧化,从而导致细胞铁死亡,而产生的葡萄糖酸降低了HGS-PCV内的pH值,增强了SRF的释放并放大了铁死亡过程。体内结果表明,HGS-PCV的协同治疗效果可结合铁死亡和凋亡,同时也引发免疫原性细胞死亡(ICD)。这一过程促进了树突状细胞(DC)的发育,并刺激了适应性T细胞反应,最终抑制了远端肿瘤的肿瘤生长(图3)。
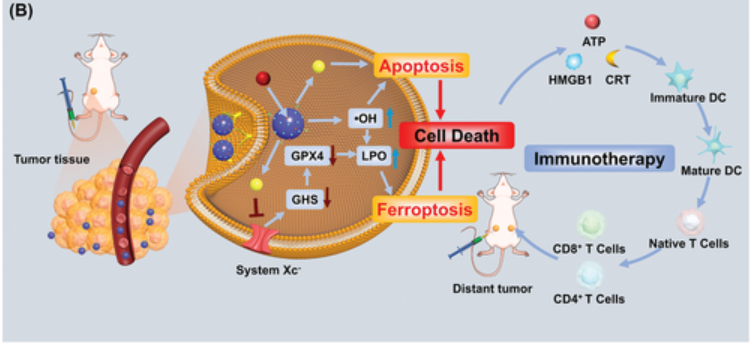
图3 HGS-PCVs的联合治疗
【结论与展望】
总之,该文介绍了由凝聚驱动的pH响应性改性PCV纳米反应器的合成。作者探索了HGS-PCVs的半渗透性,以及其促进肿瘤内GOx和Hb之间葡萄糖引发的酶级联反应性能。这种级联反应不仅会产生极具杀伤力的•OH,还会降低HGS-PCV的内部pH值,从而增强SRF的可控释放。这种双管齐下的方法会引发受影响细胞的铁死亡和凋亡,显示出对肿瘤的显著疗效。使用HGS-PCV可有效诱导ICD,进一步有助于DC的成熟,并激活适应性T细胞反应,在体内抑制远端肿瘤的生长方面发挥着重要作用。因此,本研究强调了HGS-PCV作为一种组合策略的潜力,为癌症治疗领域提供了一条新的途径。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202407378
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#癌症治疗# #酶级联#
77