卵巢癌BRCA1vsBRCA2,胚系vs体细胞,对铂类和PARP抑制剂疗效有差别?
2024-01-09 苏州绘真医学 苏州绘真医学 发表于陕西省
本研究旨在评估 BRCA1 和 BRCA2 变异状态(BRCA1 vs. BRCA2,胚系 vs. 体细胞)对 HGSOC 患者治疗反应和生存结局的影响。
引入 PARP 抑制剂(PARPis)作为高级别浆液性卵巢癌(HGSOC)患者的治疗选择,改变了 BRCA 检测方法。本研究旨在评估 BRCA1 和 BRCA2 变异状态(BRCA1 vs. BRCA2,胚系 vs. 体细胞)对 HGSOC 患者治疗反应和生存结局的影响。805 例福尔马林固定石蜡包埋(FFPE)HGSOC 样本使用 NGS 进行了 BRCA1 和 BRCA2 变异检测。在符合分析条件的 787 例样本中,104 例(13.2%)携带致病性 BRCA1 或 BRCA2 变异。其中,80 例患者进行了血液样本检测,发现 58.7% 的致病性变异为遗传性。BRCA1 和 BRCA2 之间胚系和体细胞变异的分布没有差异。有趣的是,在PARPi治疗下,仅体细胞变异(无胚系)的患者相比胚系变异的患者表现出更好的结局。确定BRCA1和BRCA2变异是遗传性还是获得性可为HGSOC患者改善管理策略和预测预后提供有价值的信息。
研究背景
高级别浆液性卵巢癌(HGSOC)是最普遍的卵巢癌类型,占卵巢肿瘤的70%。该高度侵袭性癌症是一项重大的临床挑战,其惰性性质意味着诊断时通常处于晚期。根据国际妇产科联盟(FIGO)分期系统,约84%的患者被诊断为晚期III-IV期疾病。这种晚期诊断对预后有显著影响,III-IV期的5年总生存率(OS)约为10%-30%,而I-II期为85-90%。HGOSC 的标准治疗包括肿瘤细胞减灭术和铂类/紫杉烷类联合化疗。这种一线化疗产生 70% 的出色反应率。然而,尽管进行了积极的一线治疗,仍有75%的患者会在3年内复发并最终死于疾病。
聚 ADP-核糖聚合酶抑制剂(PARPis)是 HGSOC 靶向治疗的最新重大突破。PARPis对具有 DNA 同源重组修复缺陷(HRD)的肿瘤特别有效。在这些肿瘤中,PARP抑制剂造成两种非致死事件(PARP抑制和HRD)的结合导致合成致死。癌细胞无法修复DNA损伤,导致DNA断裂和细胞死亡的积累。然而,一些患者由于获得性耐药机制而复发。几项研究表明,PARPi的敏感性可能因肿瘤的遗传和分子特征而异,这意味着多种因素可能导致对PARP治疗的临床反应的差异。
PARPis已获得FDA批准用于治疗BRCA1或BRCA2变异(胚系和/或体细胞)的HGSOC患者,这些患者对一线铂类化疗有反应。根据多项研究,约16%-23%的HGSOC样本在诊断时存在BRCA1或BRCA2致病性变异。在遗传性乳腺癌和卵巢癌综合征患者中,大多数这些变异可以在胚系水平上检测到,但这些变异中近30%发生于肿瘤本身,只能在体细胞水平上识别。这些发现强调了 HGSOC 患者肿瘤组织检测致病性 BRCA1 或 BRCA2 变异以评估是否适合 PARPis 治疗的重要性。
尽管这一领域已经得到了大量研究,但关于 BRCA1 和 BRCA2 变异的起源(遗传性或获得性)与患者预后之间的相关性,目前仍不清楚。为此,回顾了我院HGSOC患者,分析了BRCA1和BRCA2变异的体细胞或胚系起源,并评估其对化疗或PARPis的敏感性和结局的影响。
研究结果
患者队列和变异
2016 年到 2021 年,法国蒙彼利埃大学医院病理实验室收到 805 例来自 HGSOC 患者的福尔马林固定石蜡包埋(FFPE)样本,使用下一代测序(NGS)进行 BRCA1 和 BRCA2 全外显子检测。在符合分析条件的 787 例样本中,104 例(13.2%)携带致病性/可能致病性(致病性)变异,40 例(5.1%)携带意义未明的变异(VUS),643 例(81.7%)为 BRCA1 和 BRCA2 野生型(WT)(图 1 和图 2A)。在携带致病性变异的样本中,4例同时存在同一基因VUS(2例为BRCA1,2例为BRCA2),4例同时存在另一基因VUS(2例为BRCA1致病性变异和BRCA2 VUS,2例为BRCA2致病性变异和BRCA1 VUS)。

图1

图2
在致病性变异中,69例(66.3%)为BRCA1变异,35例(33.7%)为BRCA2变异。小插入/缺失(indels)是最常见的DNA变异,占BRCA1变异的68.1%和BRCA2变异的74.3%。BRCA1 和 BRCA2 剪接变异各有 3 例患者检出,而错义变异仅见于 BRCA1,有 4 例样本检出,其中 1 个变异破坏了翻译起始密码子(图 2B)。此外,这些变异中包含移码或无义变异,诱导过早终止密码子的出现,在BRCA1和BRCA2变异中分别占86.9%和91.4%(图 2B)。尽管突变似乎分布于整个基因,但有 7 个 BRCA1 变异在不止一例样本中检出,其中一个变异(p.Glu1005Asnfs*19)有3例样本检出。
致病性变异患者的临床病理特征
携带致病性变异的患者的临床和病理特征见表1。诊断时的中位年龄为 63.4 岁(范围:30.4-87.0)。在有FIGO分期的患者中,85.9%为III期和IV期疾病。根据国际指南,建议有 BRCA1 或 BRCA2 致病性变异的女性接受遗传咨询。80/104 例患者进行了血液样本检测,结合肿瘤样本检测结果,将变异分为两类:(i)仅在肿瘤样本中检测到的体细胞变异和(ii)在血液和肿瘤样本中均检测到的胚系变异(图 3A)。其余24例携带致病性变异的样本的胚系状态不可及。47 个变异被归类为胚系(58.7%),33 个为体细胞(41.2%),BRCA1 和 BRCA2 之间的分布相似(p = 0.68,图 3A)。两组患者在诊断年龄和分期方面无显著差异。此外,关于整个基因的变异分布,没有明显集中在特定区域(图3B,C)。
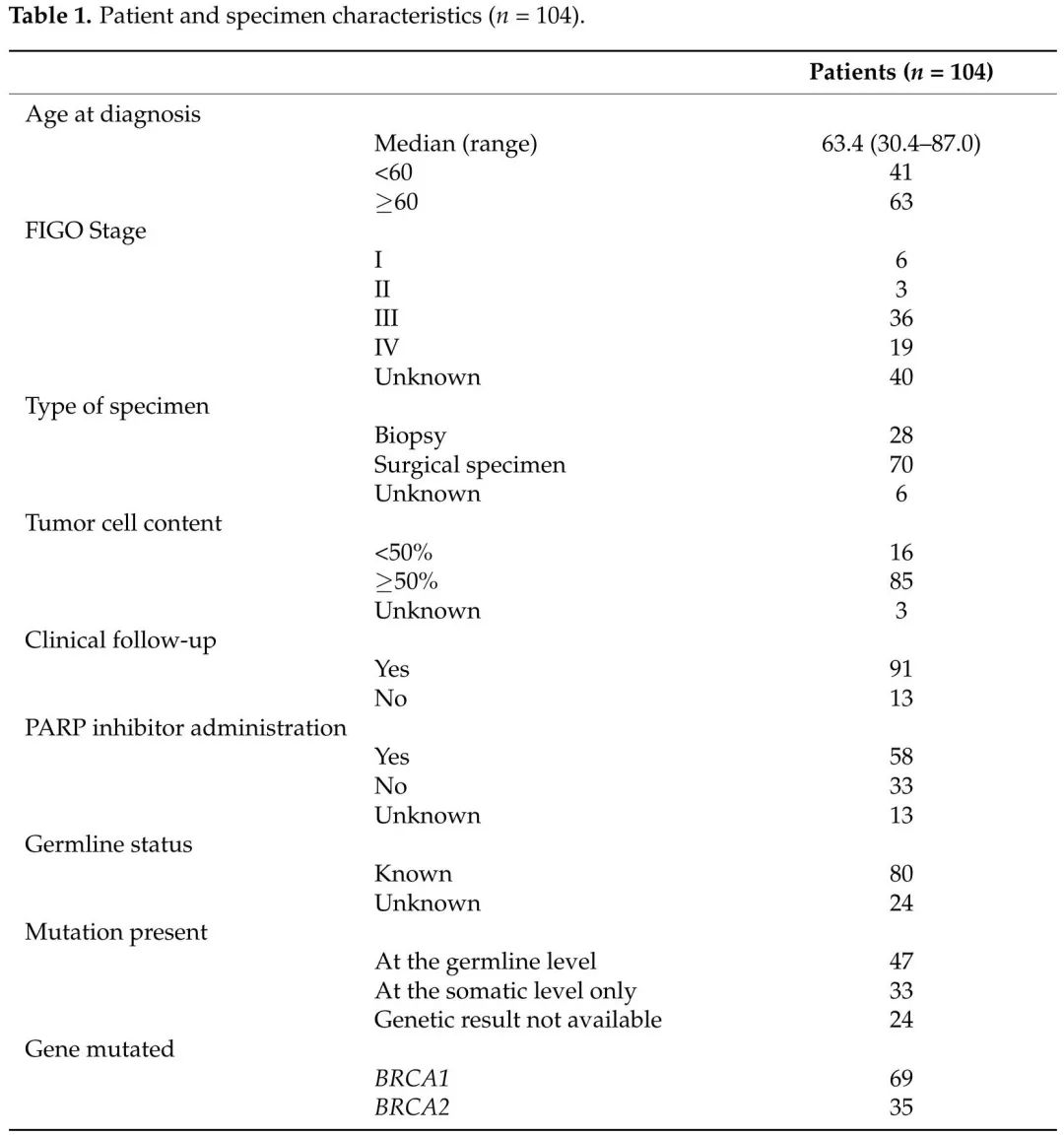
表1
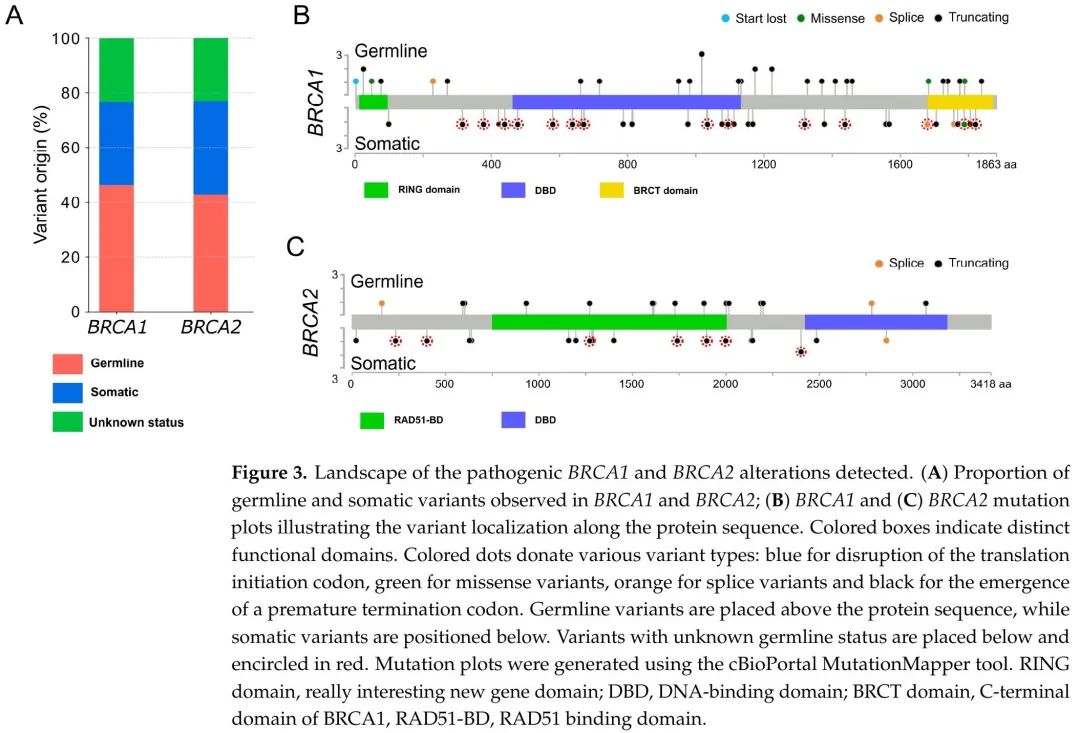
图3
患者临床结局,根据胚系或体细胞致病性变异分类
在 80 例接受基因检测的患者中,66 例有完整的临床随访。所有患者均接受了一线铂类化疗,53例复发。其中,49例在表现出对铂类化疗敏感后接受了PARPis作为维持治疗。接下来,评估了变异状态(BRCA1 vs. BRCA2,胚系 vs. 体细胞)在治疗反应和总生存期方面的预后价值。BRCA1和BRCA2变异的患者对铂类治疗和PARP抑制剂治疗的反应相似,总生存期也相似(表2和图4A-C)。有趣的是,在PARPi治疗下,只携带体细胞变异而不携带相应胚系变异的患者结局优于携带胚系变异的患者(p = 0.049;log-rank检验),而在铂类治疗下没有观察到差异(表2和图4D,E)。此外,体细胞变异的女性生存时间似乎也长于遗传性变异的女性(图4F,5年生存率分别为86.4%和63.7%),尽管差异没有统计学意义(p = 0.17)。

表2
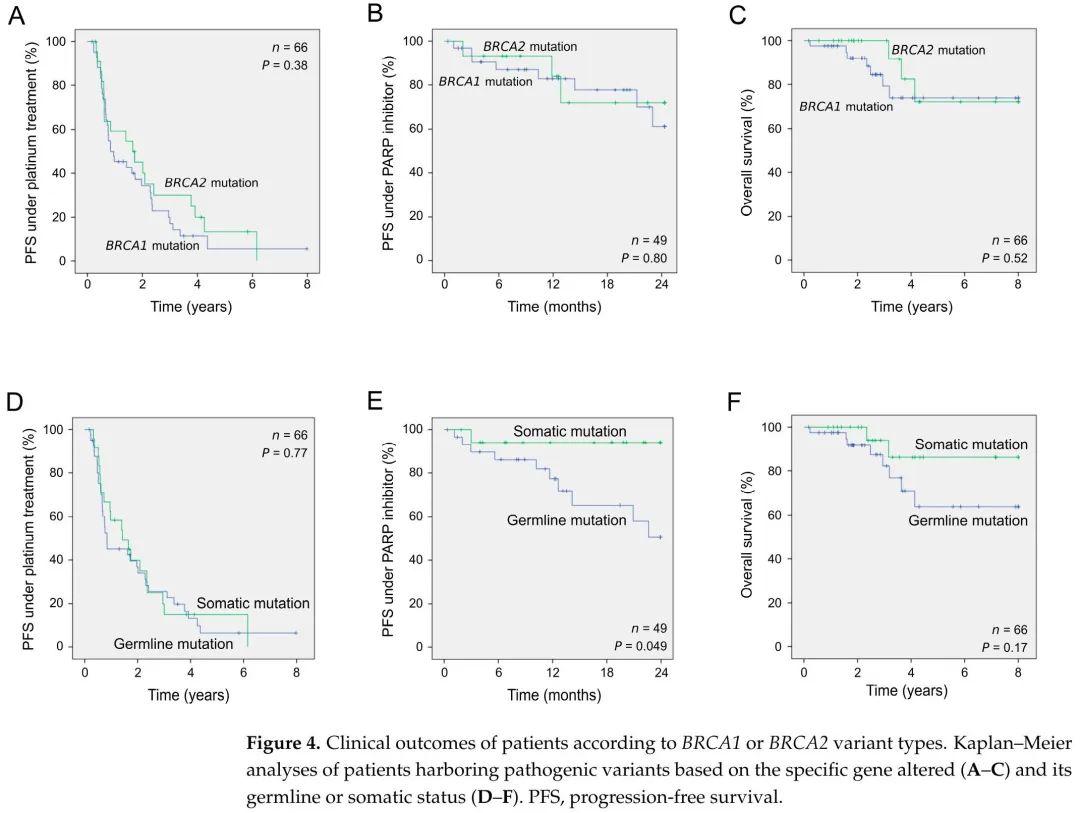
图4
讨 论
引入 PARPis 作为具有 BRCA1 或 BRCA2 致病性变异的 HGSOC 患者的治疗选择,使 BRCA 检测方法发生重大变化。BRCA检测最初用于识别易患遗传性乳腺癌-卵巢癌(HBOC)综合征的患者,现在对于识别最有可能从PARPis治疗中获益的患者也至关重要。有趣的是,最初的临床研究表明,体细胞BRCA变异的患者也可能对PARPis有反应。SOLO-1研究显示,奥拉帕利维持治疗可改善有害胚系或体细胞BRCA变异患者的PFS。3期PAOLA-1试验显示,对于BRCA有害变异或HRD阳性肿瘤患者,与单药贝伐珠单抗相比,奥拉帕利联合贝伐珠单抗的PFS和OS均有所改善。基于 SOLO-1 研究结果,奥拉帕利于 2018 年获得 FDA 批准用于胚系和/或体细胞 BRCA 变异的晚期 HGSOC 的一线维持治疗。关于贝伐珠单抗的给药、剂量、时间和安排仍存在争议。最近,卢卡帕利和尼拉帕利已获批用于BRCA变异和HRD阳性肿瘤患者的一线维持治疗。因此,能够快速识别胚系和体细胞变异的肿瘤BRCA检测已在临床实践中实施。几项研究报道,16-23%的诊断时HGSOC样本携带BRCA1或BRCA2致病性变异,其中约28-39%的变异仅存在于体细胞水平。在本研究中,检出致病性变异的比例略低(13%),体细胞变异比例较高(44%)。原因包括:对于一些患者,在诊断早期已进行了胚系BRCA检测,由于没有检测到变异,这些患者的肿瘤样本被送到我们的实验室进行进一步检测。因此,最近的数据和本研究支持即使没有胚系变异,也应进行肿瘤检测,以识别那些具有体细胞变异的患者,其可能获益于 PARPi 治疗。此外,越来越多的证据表明,PARPis为晚期HGSOC带来获益,无论患者的BRCA分子状态如何。这扩大了卵巢癌患者的潜在治疗选择。
在本研究中,我们发现整个 BRCA1 和 BRCA2 基因的胚系和体细胞变异的分布没有明显集中在特定区域。同样,两个基因变异类型比例相似。在89.4%的病例中,变异导致过早终止密码子的出现,产生改变的mRNA,被无义介导的mRNA衰变途径降解。错义变异位于BRCA1的关键功能域,如RING结构域。其他变异包括剪接位点变异,对蛋白质的影响仍不明确。最近,两项研究表明,基于所涉及的BRCA变异,细胞对顺铂和/或PARPis的敏感性存在差异。Wang 等人表明,携带 BRCA1 外显子 10 移码突变的细胞系和肿瘤样本表达一种对化疗和 PARPis 部分耐药的BRCA1 亚型。然而,作者还报告,并非所有变异都导致相同的治疗反应,携带相同变异的两名患者来源的异种移植模型对奥拉帕利治疗的反应不同。因此,仍然需要进一步的研究,根据检测到的变异,更好地识别能从PARPis治疗中获益的女性。
虽然目前已知BRCA变异的患者对铂类化疗和PARPis的反应较好,但变异基因或变异起源(遗传性或获得性)对临床结局的影响尚不清楚。一些研究表明BRCA2变异的患者对化疗的反应较好,生存率较高,而最近的研究未发现BRCA1和BRCA2变异患者之间存在任何差异。我们队列中 BRCA1 和 BRCA2 变异的患者对铂类治疗和 PARPis 的反应以及总生存期相似。此外,我们发现体细胞或胚系变异的患者对化疗的反应没有显著差异,正如先前报道的那样。然而,有趣的是,当首次探索体细胞或胚系变异对PARPis反应的影响时,我们发现体细胞变异患者的结局更好。此外,具有体细胞变异的女性生存时间似乎长于具有遗传性变异的女性。这些结果可能由多个原因所致。第一,治疗可能会影响携带胚系变异的非肿瘤细胞。此外,与DNA修复途径相关的基因的胚系变异可能导致基因组不稳定性加剧和体细胞变异的出现,从而影响患者预后。最近的研究结果还表明,胚系变异可能影响肿瘤微环境和肿瘤内免疫反应。这些或可解释在胚系变异患者和体细胞变异患者之间观察到的生存结局的差异。需要更多的研究来加强我们对这个高度复杂的问题的了解。
由于样本量小,研究的回顾性性质,应谨慎解释这些结果,需要使用更大队列进行验证。区分携带胚系变异和体细胞变异的患者可能有助于管理决策,对携带胚系变异、在PARPis治疗下有早期复发风险的患者进行更严格的监测。
总之,本研究结果表明,确定BRCA变异的起源(胚系或体细胞)有利于准确评估患者预后。此外,肿瘤学家、生物学家和遗传学家之间的多学科合作在HGSOC患者管理中很重要。
参考文献:
Vendrell JA, Ban IO, Solassol I, Audran P, Cabello-Aguilar S, Topart D, Lindet-Bourgeois C, Colombo PE, Legouffe E, D'Hondt V, Fabbro M, Solassol J. Differential Sensitivity of Germline and Somatic BRCA Variants to PARP Inhibitor in High-Grade Serous Ovarian Cancer. Int J Mol Sci. 2023 Sep 16;24(18):14181. doi: 10.3390/ijms241814181. PMID: 37762485; PMCID: PMC10532320.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#卵巢癌# #PARP抑制剂#
62