第十三届江西省心血管病高峰论坛:心肌重构的机制和干预研究
2022-12-14 MedSci原创 MedSci原创 发表于上海
目前,高血压心肌重构的临床和技术方面研究很多,而且在临床上关于压力超负荷导致的心肌重构有很多的治疗药物进行干预。
2022年12月3日,第十三届江西省心血管病高峰论坛顺利举行。本次论坛,来自复旦大学附属中山医院的邹云增教授以《心肌重构的机制和干预研究》为题,为大家做精彩讲述。梅斯医学将重点加以整理,分享给各位同道。
机械应力负荷诱导心肌重构的机制和干预
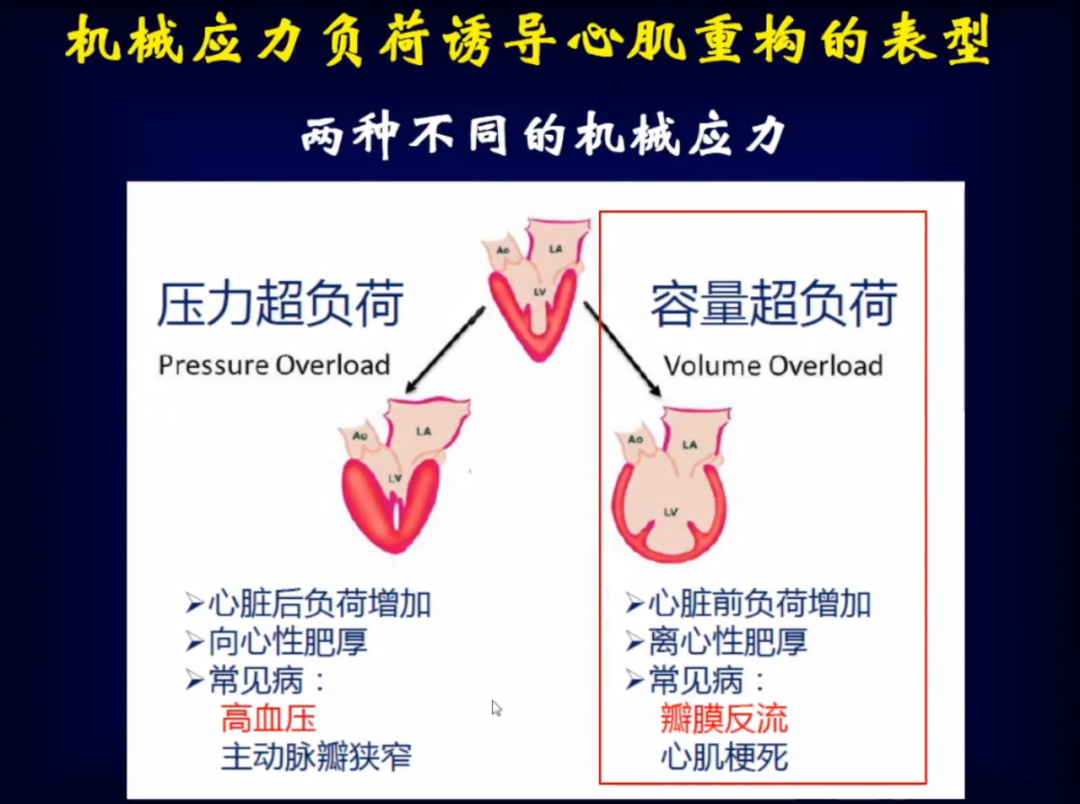
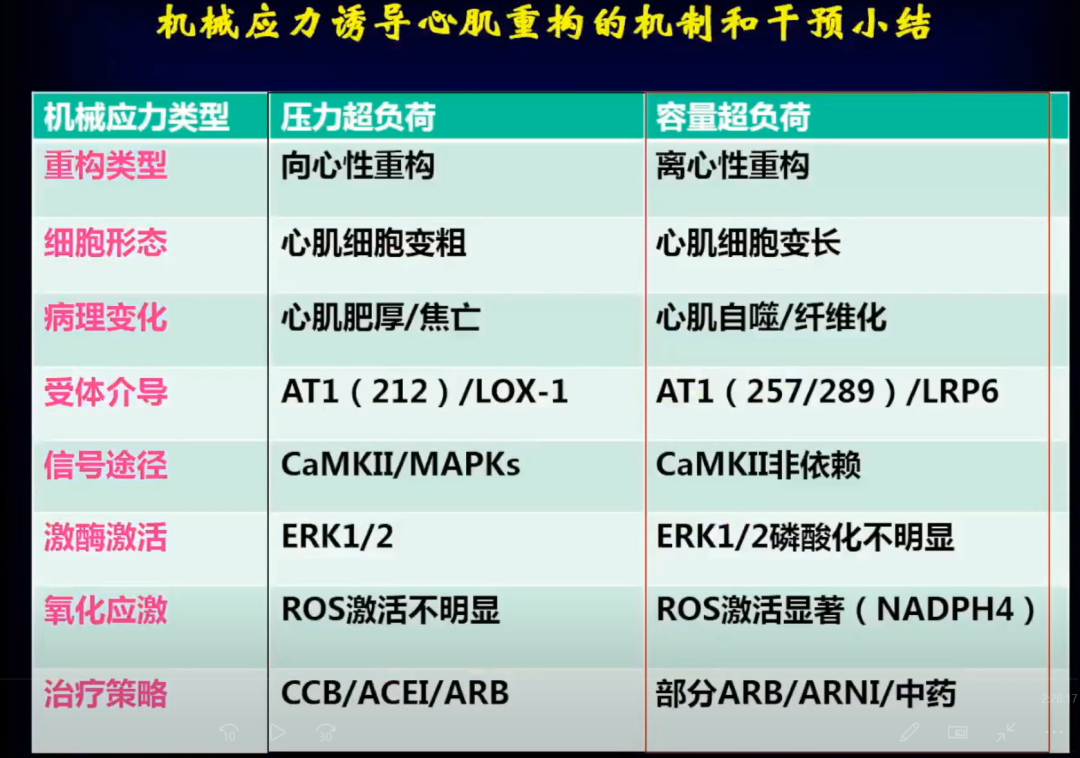
机械应力负荷增加是心肌重构的始发因素,并且很多心血管疾病与机械应力负荷增加关系密切,如高血压、瓣膜病、心肌梗死等。机械应力负荷主要包括压力超负荷和容量超负荷,二者通过不同的病理生理机制导致了不同的心脏重构表型。目前,高血压心肌重构的临床和技术方面研究很多,而且在临床上关于压力超负荷导致的心肌重构有很多的治疗药物进行干预。
容量超负荷多见于瓣膜反流,由于模型、研究手段等原因限制,导致这方面的研究很少。针对瓣膜反流,目前没有药物干预,基本都是手术干预,所以对于不能手术的情况和手术后如何进行深入研究发现其中的一些机制并进行有效干预,这些是我们目前需要关注的方向。
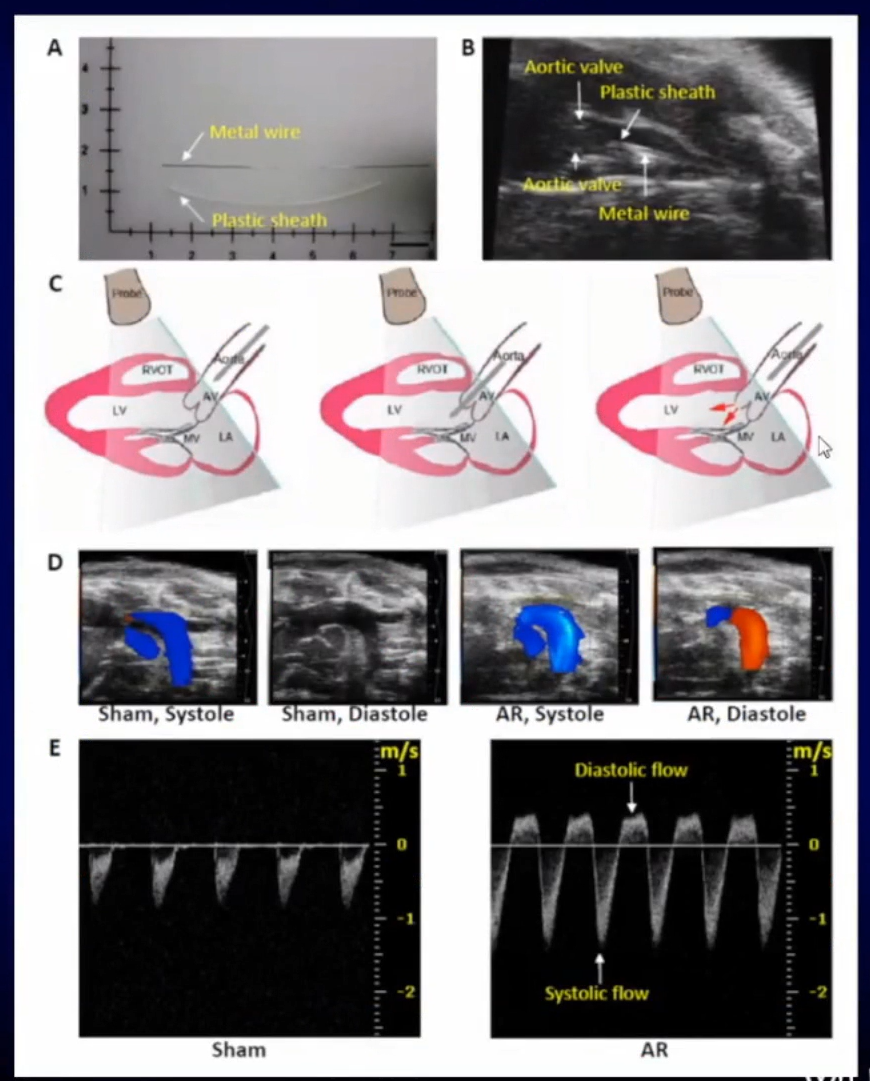
邹云增教授团队曾在国内首创超声引导下小鼠主动脉瓣返流致心脏容量超负荷模型的制作。
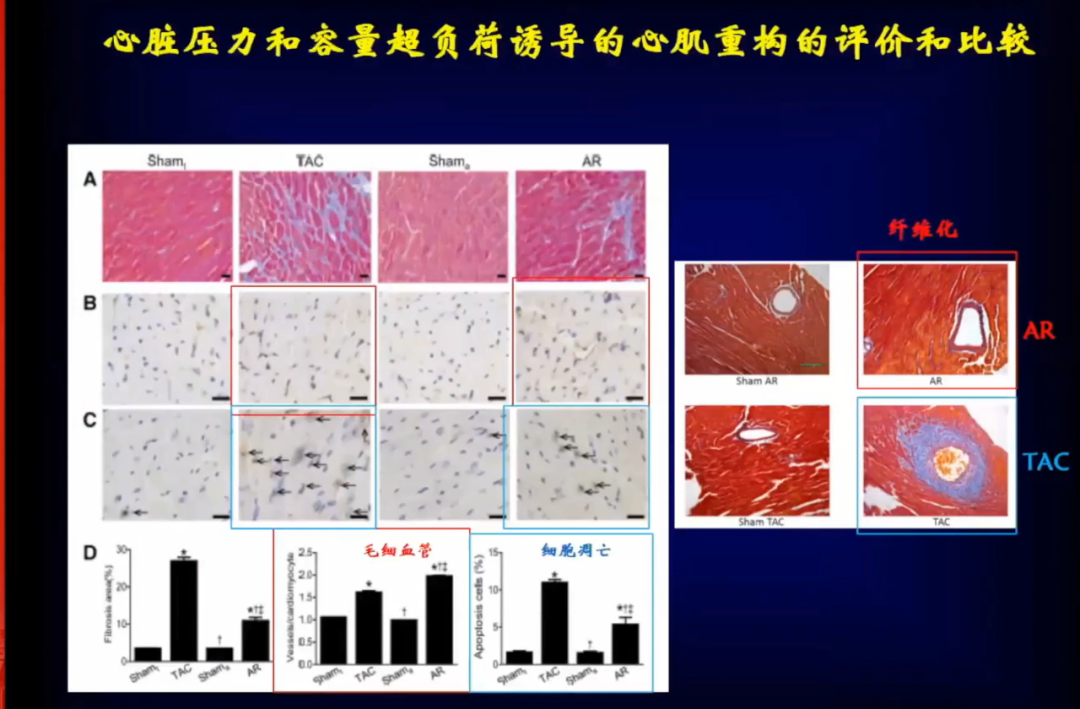
心脏压力和容量超负荷导致的心肌重构在很多方面存在差别,除了形态有区别包括组织学改变,如心肌间质纤维化空间分布完全不同,毛细血管数量、细胞凋亡数量都存在很大差别。
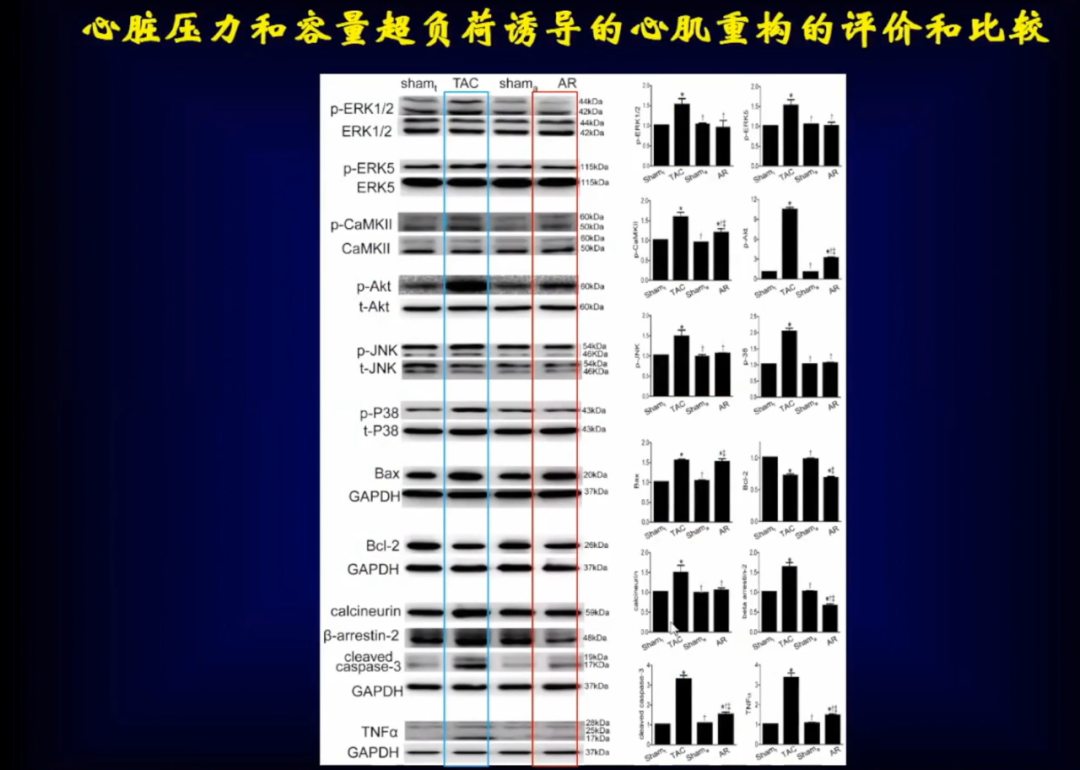
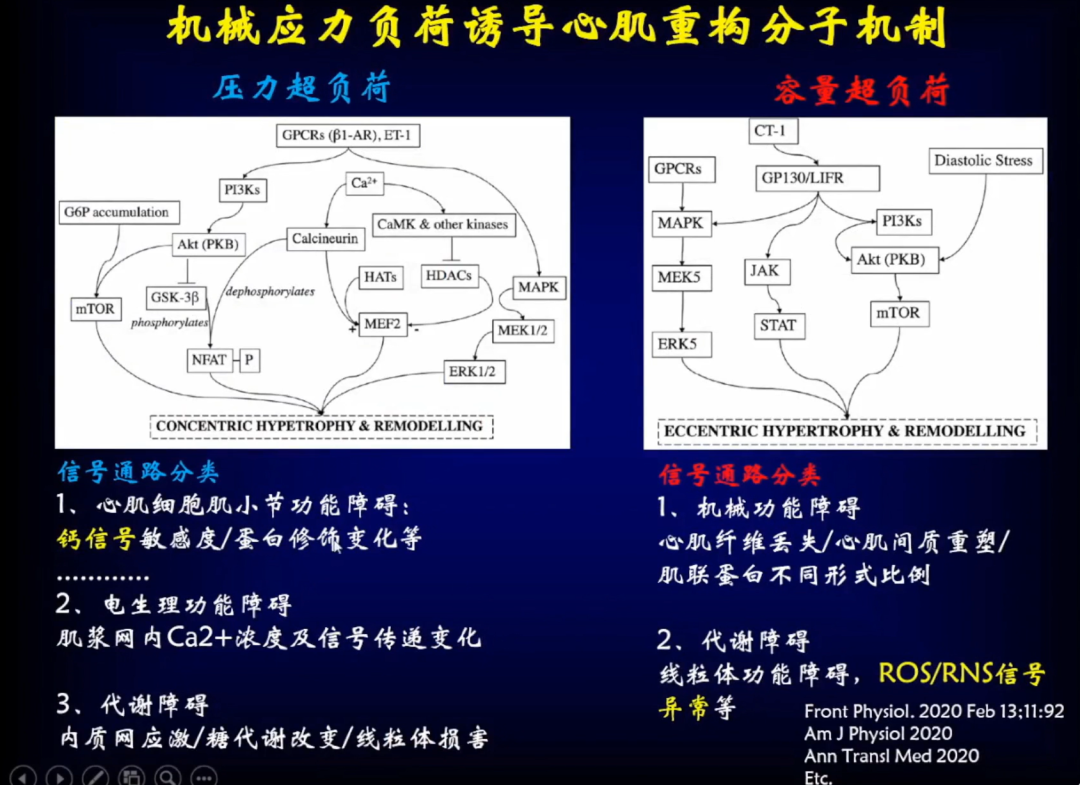
压力超负荷和容量超负荷是两类不同的机械应力,通过不同的分子而导致不同的表型。
压力超负荷的信号通路包括:
1、心肌细胞肌小节功能障碍:钙信号敏感度/蛋白修饰变化等;
2、电生理功能障碍:肌浆网内Ca2+浓度及信号传递变化;
3、代谢障碍:内质网应激、糖代谢改变、线粒体损害。
容量超负荷的信号通路包括:
1、机械功能障碍:心肌纤维丢失、心肌间质重塑、肌联蛋白不同形式比例;
2、代谢障碍:线粒体功能障碍、ROS/RNS信号异常等。
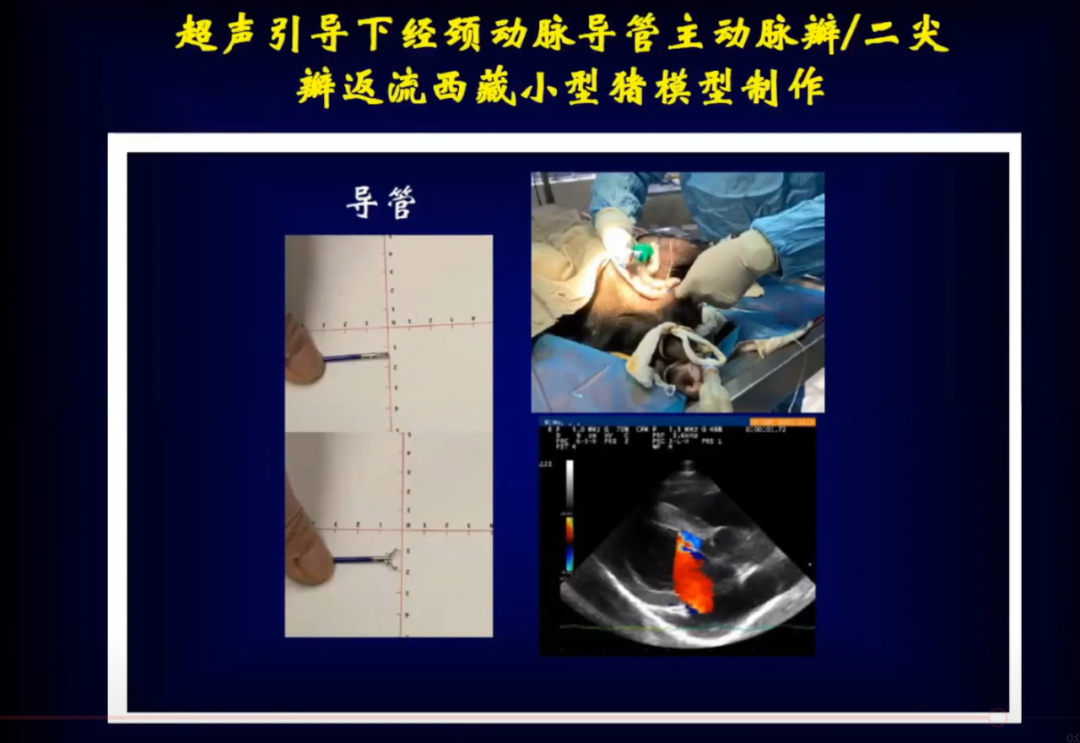
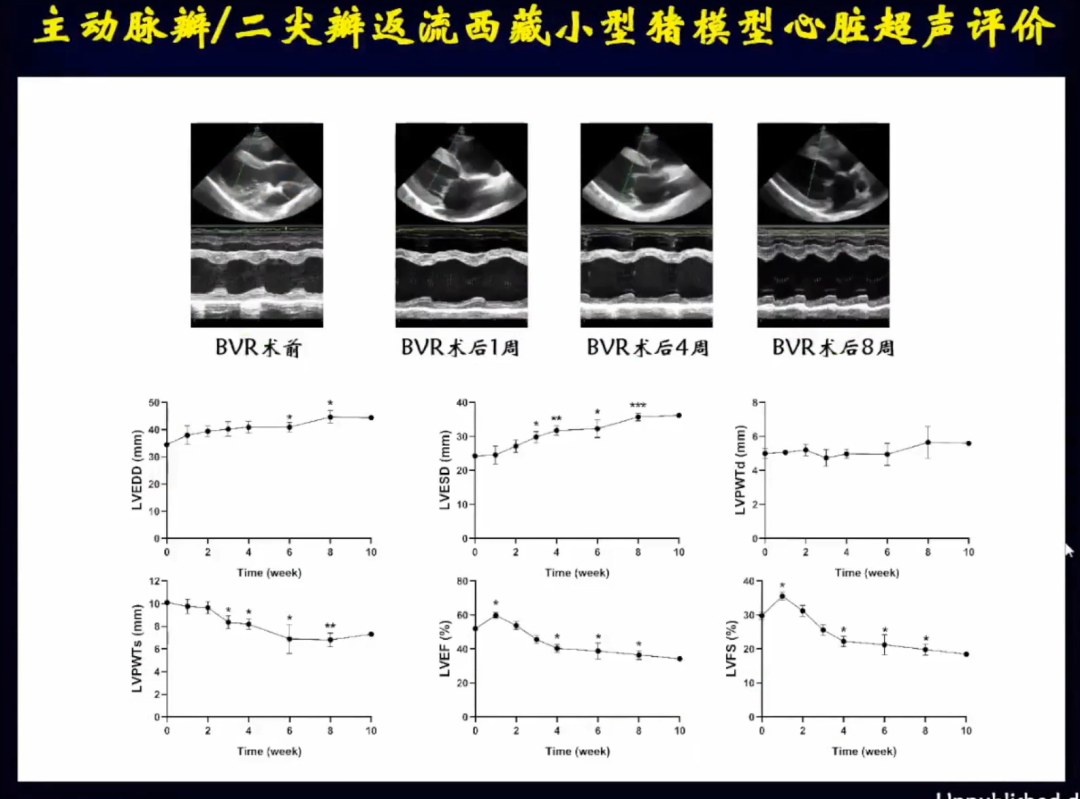
针对瓣膜反流心肌重构缺乏有效治疗的问题,考虑先应用动物实验进行探索,除了小鼠研究外,邹云增教授团队制作了超声引导下经劲动脉导管主动脉瓣合并二尖瓣返流小型猪模型。
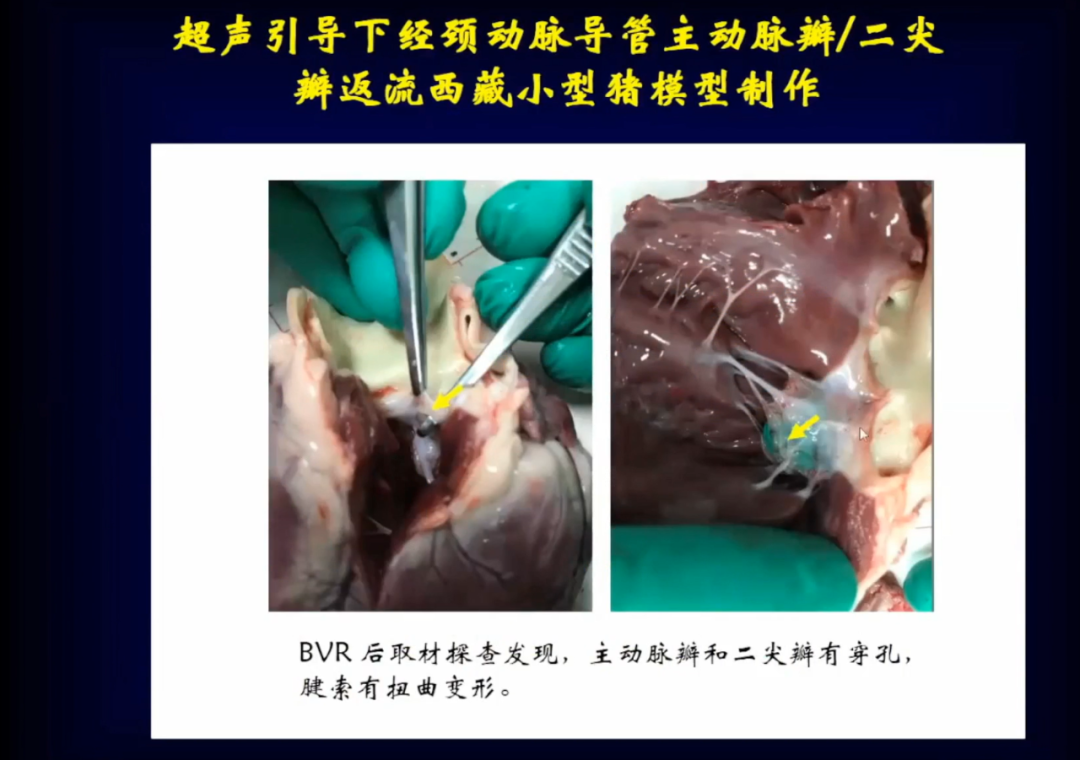
通过解剖学可以看到瓣膜损伤情况,BVR后取材探查发现,主动脉瓣和二尖瓣有穿孔,腱索有扭曲变形。
超声评价反流稳定性,通过随访可以看到,经BVR术后小猪的主动脉瓣和二尖瓣返流情况非常稳定。
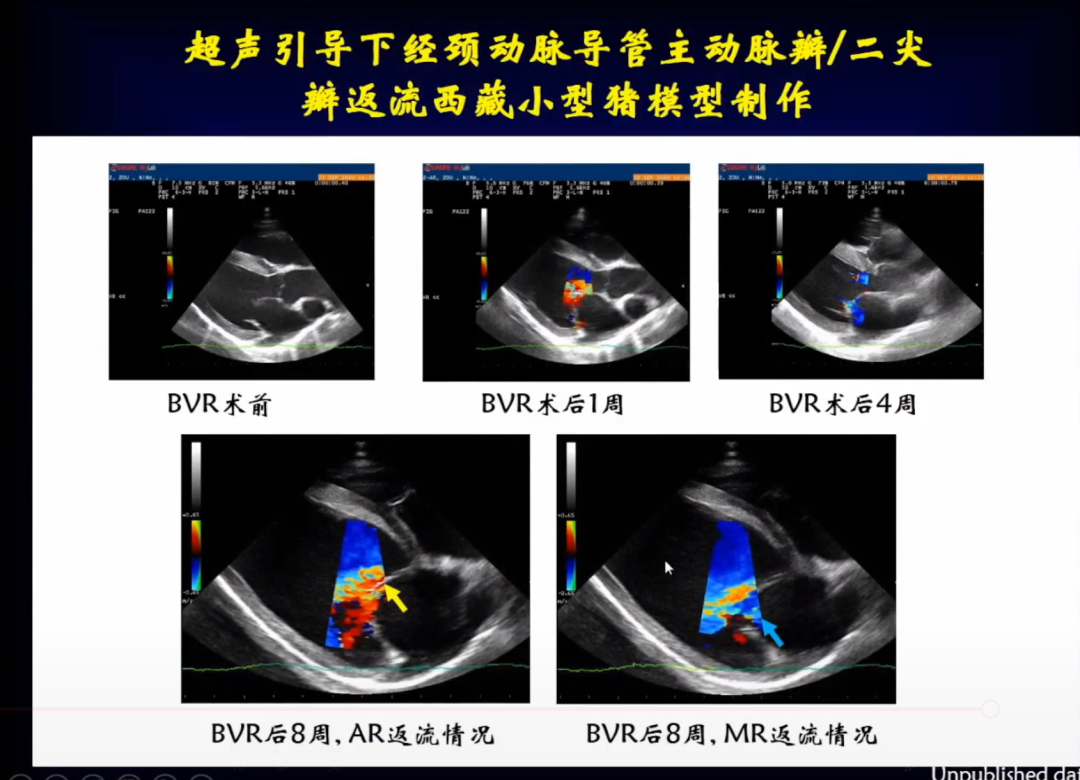
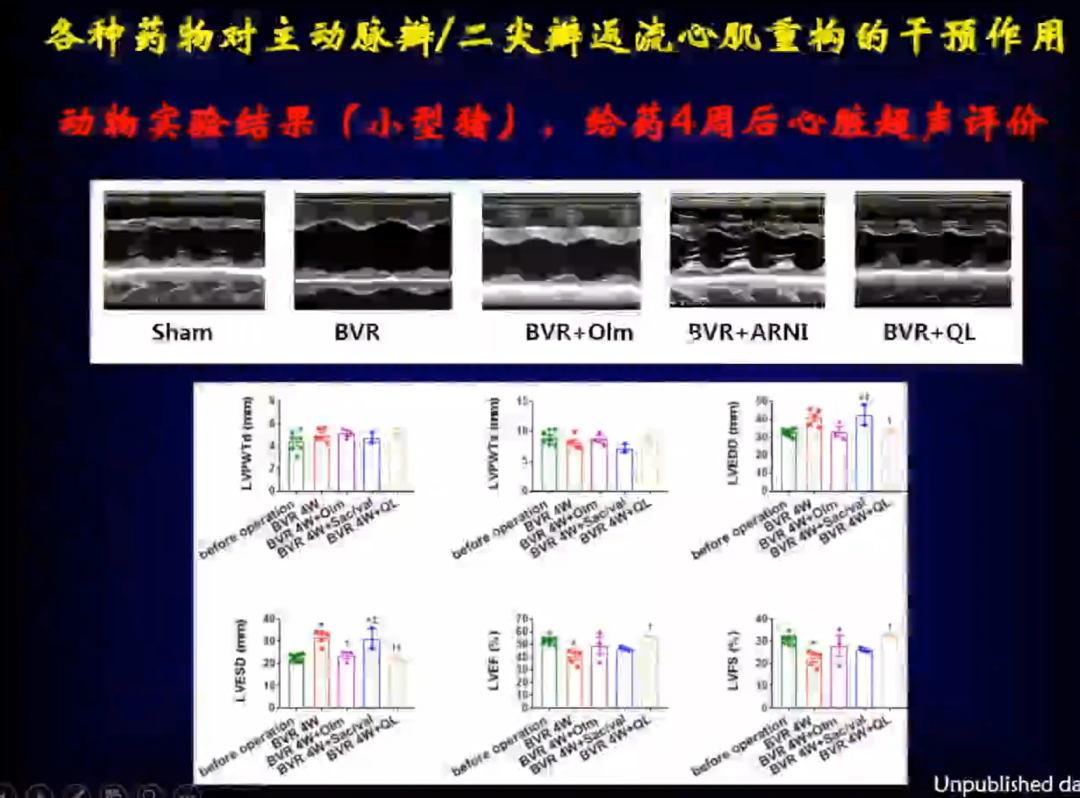
随着时间的推移小猪左室的收缩末期和舒张末期内径、LVEF值、LVFS值均发生改变,符合离心性心肌重构表型的改变。
针对瓣膜反流心肌重构曾尝试应用CCB和ACEI治疗主动脉瓣膜返流,但效果并不好。

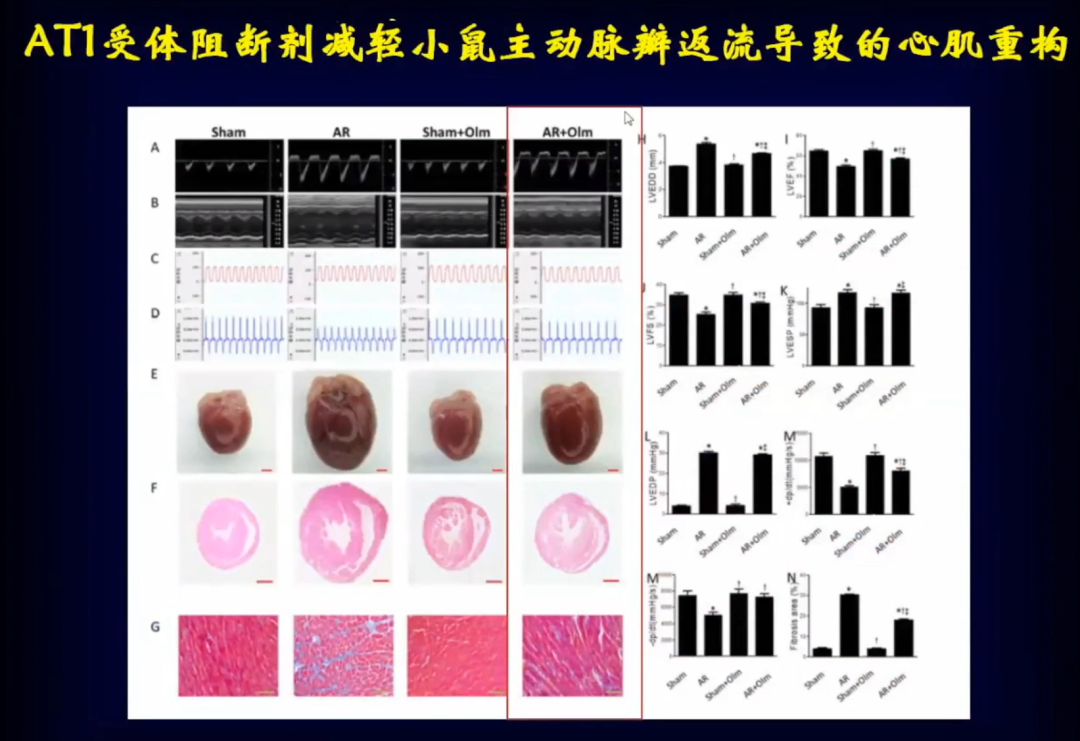
邹云增教授团队之前的研究发现,AT1受体可以作为机械应力感受器,能够感受机械应力增加导致心肌重构,特别是在高血压中。

邹云增教授团队在小鼠模型中通过7种ARBAT1受体阻断剂的筛选发现其中的奥美沙坦在不影响血压的前提下对主动脉瓣反流导致的心肌重构有明显的抑制作用。
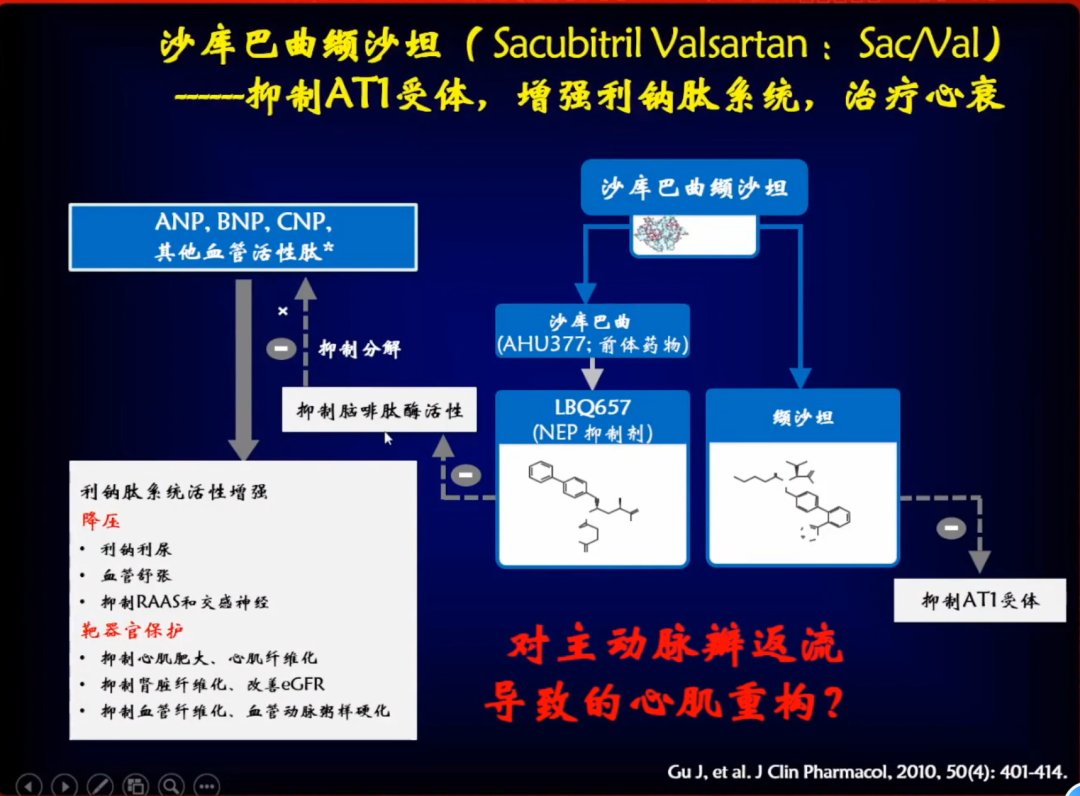
沙库巴曲缬沙坦是一种AT1受体阻断剂和脑啡肽酶活性抑制剂,所以该药物对主动脉瓣反流导致的心肌重构是否有效,也是一种需要考虑到的药物。
芪苈强心治疗心力衰竭的效果非常好,但是对机械应力负荷导致的心肌重构是否有效需要进一步讨论。

早期的研究发现,在高血压压力超负荷导致的心肌重构中使用了芪苈强心后,可以明显的抑制心肌肥厚,这就提示了芪苈强心有可能对机械应力负荷导致的心肌重构有效。
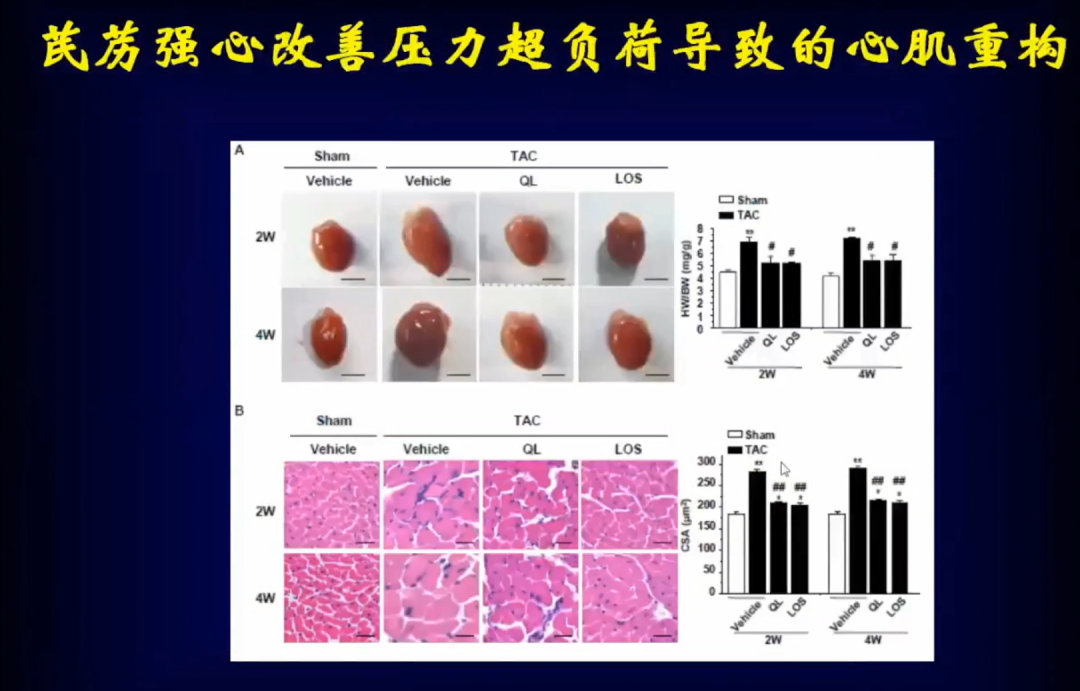
通过进一步研究发现,芪苈强心可以抑制AT1受体表达,这也提示了芪苈强心有可能对主动脉瓣反流导致的心肌重构有效。

邹云增教授团队在主动脉瓣/二尖瓣返流心肌重构的大型动物模型中早期使用奥美沙坦、沙库巴曲缬沙坦、芪苈强心三种药物,评价干预效果。

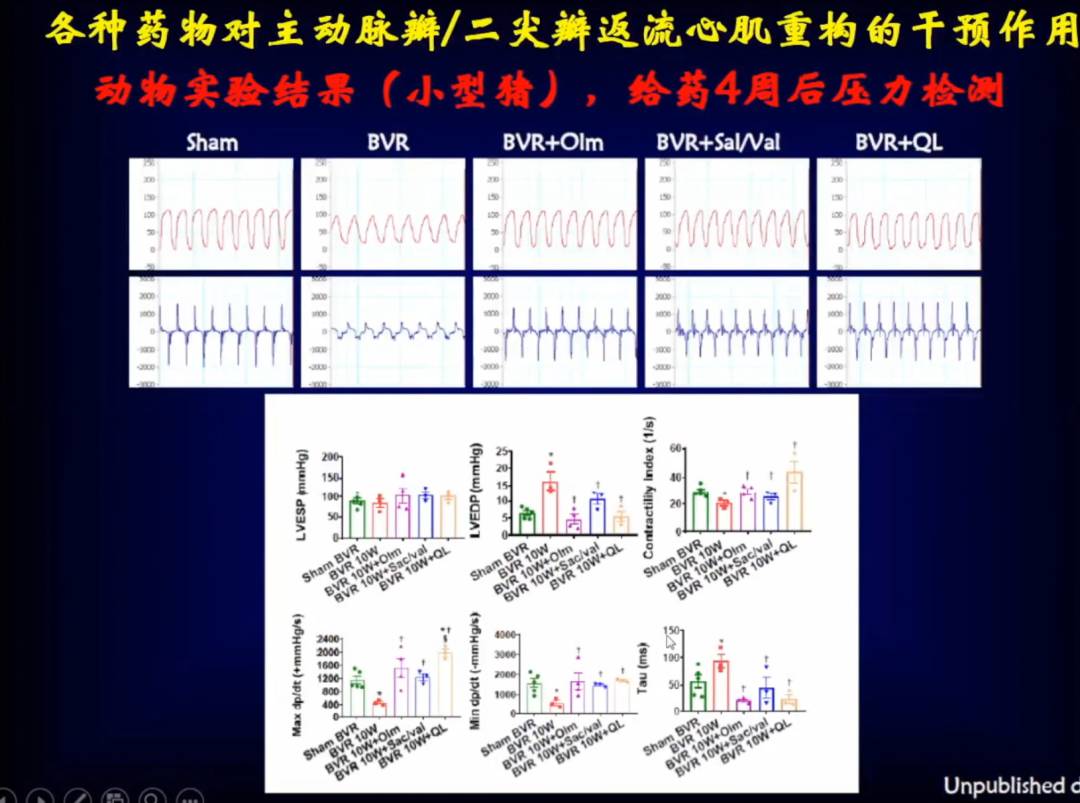
从结果来看,使用三种药物后,左室舒张末期和舒张末期内径、LVEF值、LVFS值均得到了明显的改善,血液流动力学也得到了明显的改善。
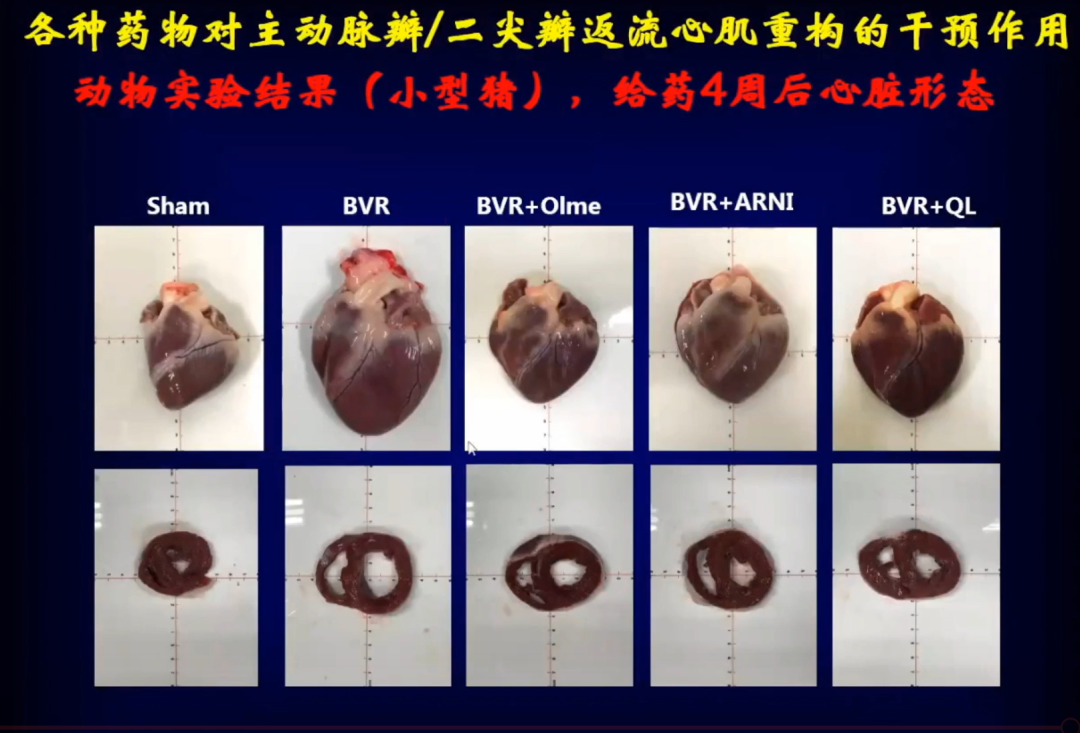
取出小猪心脏后可以看到,用药前心脏明显变大,而用药后心脏明显缩小,三种药物都有减小心脏作用。
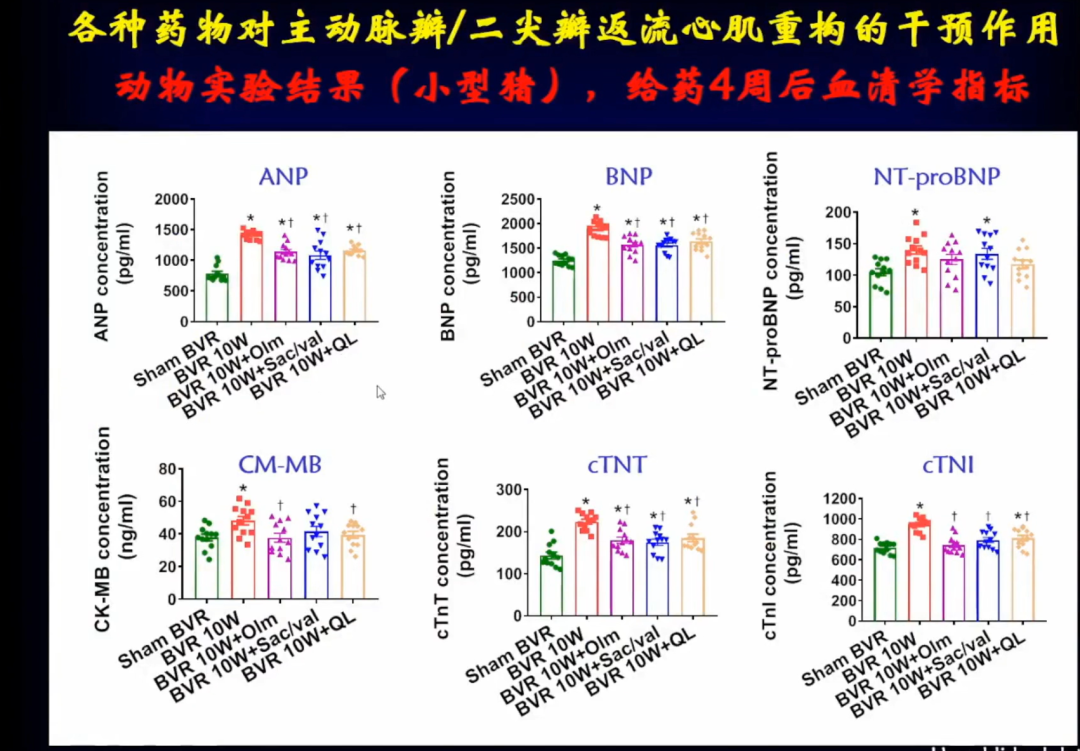
在瓣膜损伤模型当中6类血清学指标是升高的,在给药4周后血清学指标明显降低,所以三种药物对血清学指标也有明显作用。
邹云增教授团队对小猪心肌组织组织学分析找到了一些新的靶点,针对这些新的靶点会继续进行新的研究。

小结:压力超负荷和容量超负荷通过不同的病理生理机制导致了不同的心脏重构表型。奥美沙坦、沙库巴曲缬沙坦、芪苈强心三种药物在不影响血压的情况下,对瓣膜反流导致的心肌重构有明显的作用。
最近发现,部分心衰患者因精神问题会使用抗精神病药物,如奥氮平,这些患者在使用这类抗精神病药物后对心脏会有一些影响。
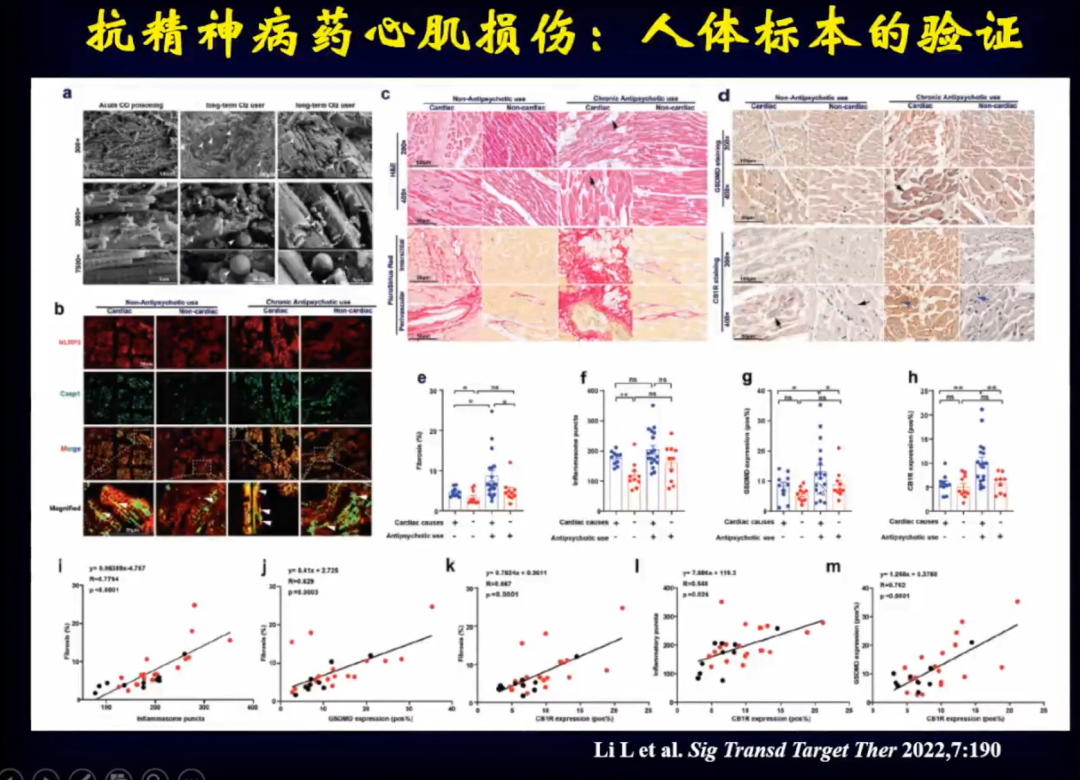
进一步通过法医学,对一部分服用过奥氮平自杀的人的进行尸检,检查他们的心脏发现有大量的心肌重构损伤。
于是邹云增教授团队对奥氮平是否会导致心肌重构、如何导致心肌重构进行了研究,结果发表于2022年6月NETURE子刊。

在小鼠身上使用奥氮平发现其心电图改变非常明显QT间期延长,解剖后发现心脏明显扩大。对小鼠心脏进行转录组学分析,发现调控心肌细胞焦亡的转录因子明显升高。这提示了心肌细胞焦亡可能在奥氮平导致的心肌重构当中发挥了重要作用。
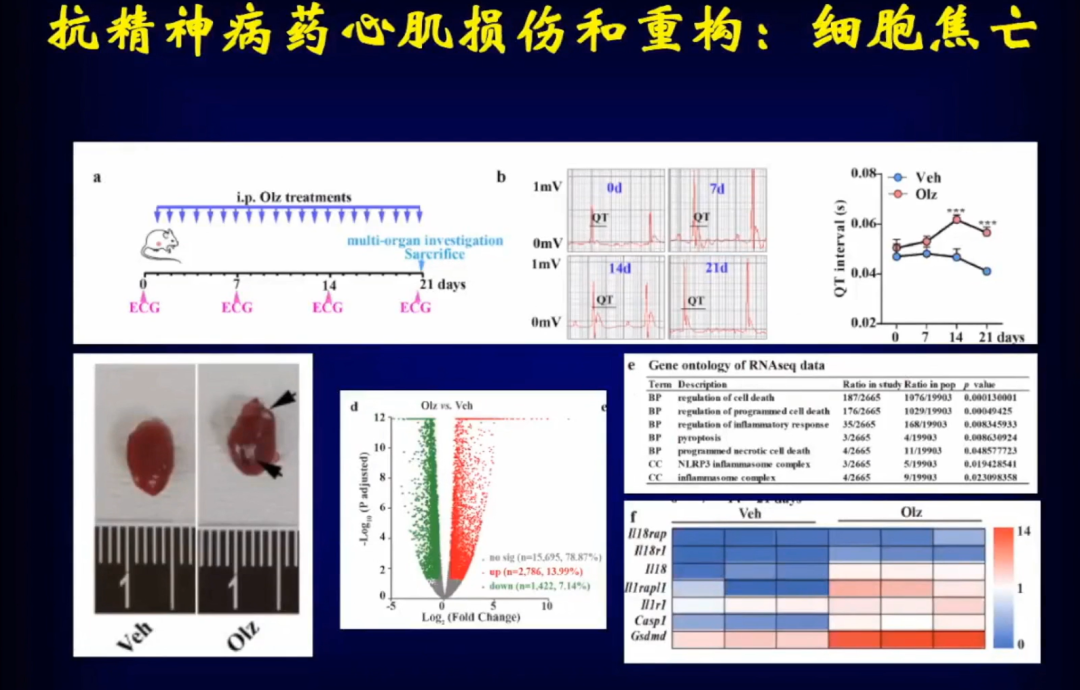
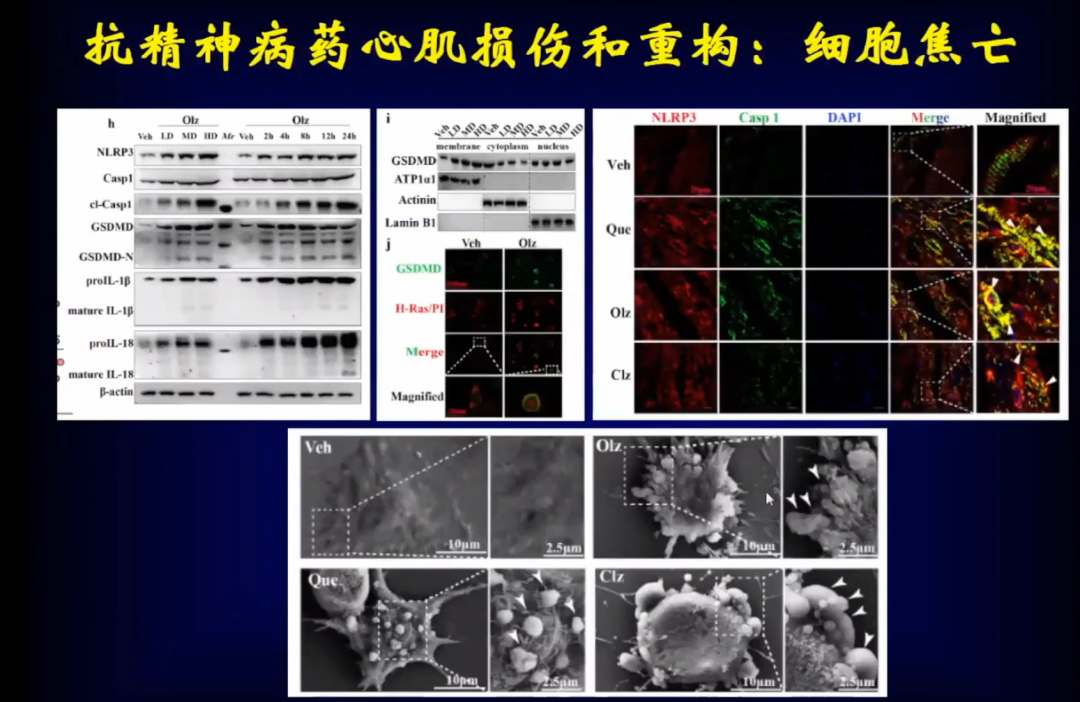
进一步通过组织学检测也证实了,使用奥氮平后大量的心肌细胞发生了焦亡,通过电镜进一步看到使用奥氮平后心肌组织发生了明显的心肌细胞焦亡。
为确定心肌细胞焦亡是否是导致心肌重构的原因,邹云增教授团队应用了抑制焦亡的药物MCC950,在使用药物后发现小鼠QT间期明显缩短,心肌重构被明显逆转。
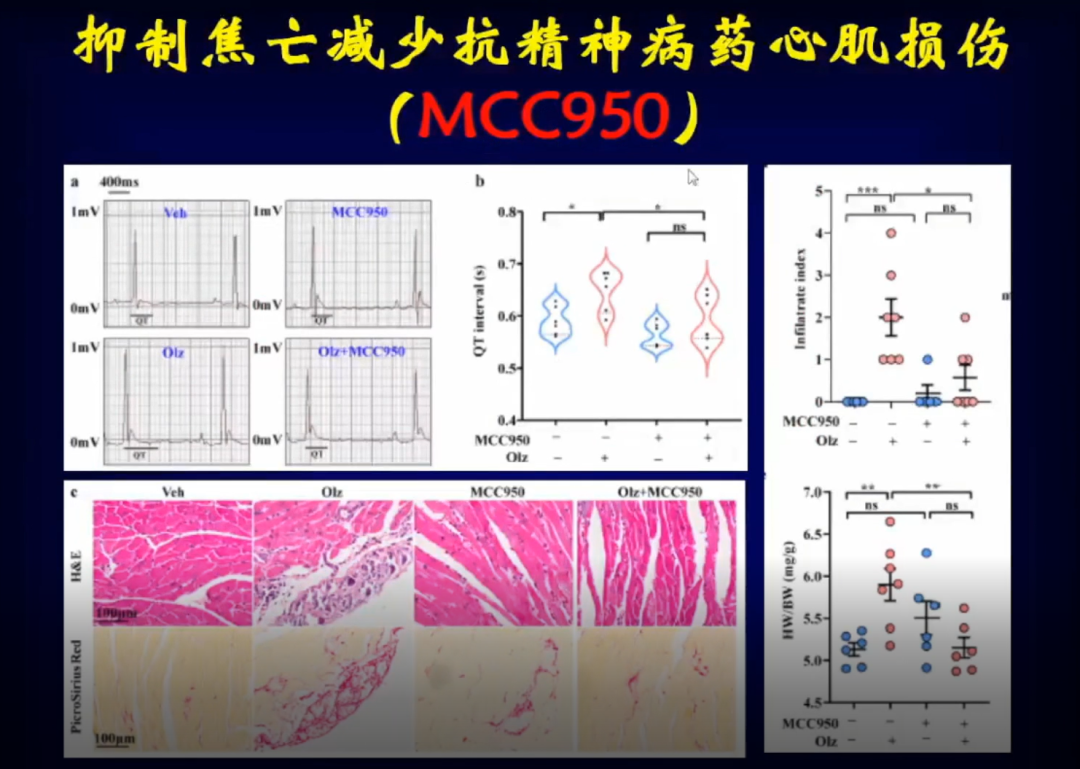
将小鼠NLRP3-KO炎症小体敲除后,再使用奥氮平等抗精神病药物后发现,小鼠心肌细胞焦亡明显减少,左室功能明显恢复,左室组织学改变明显减少。
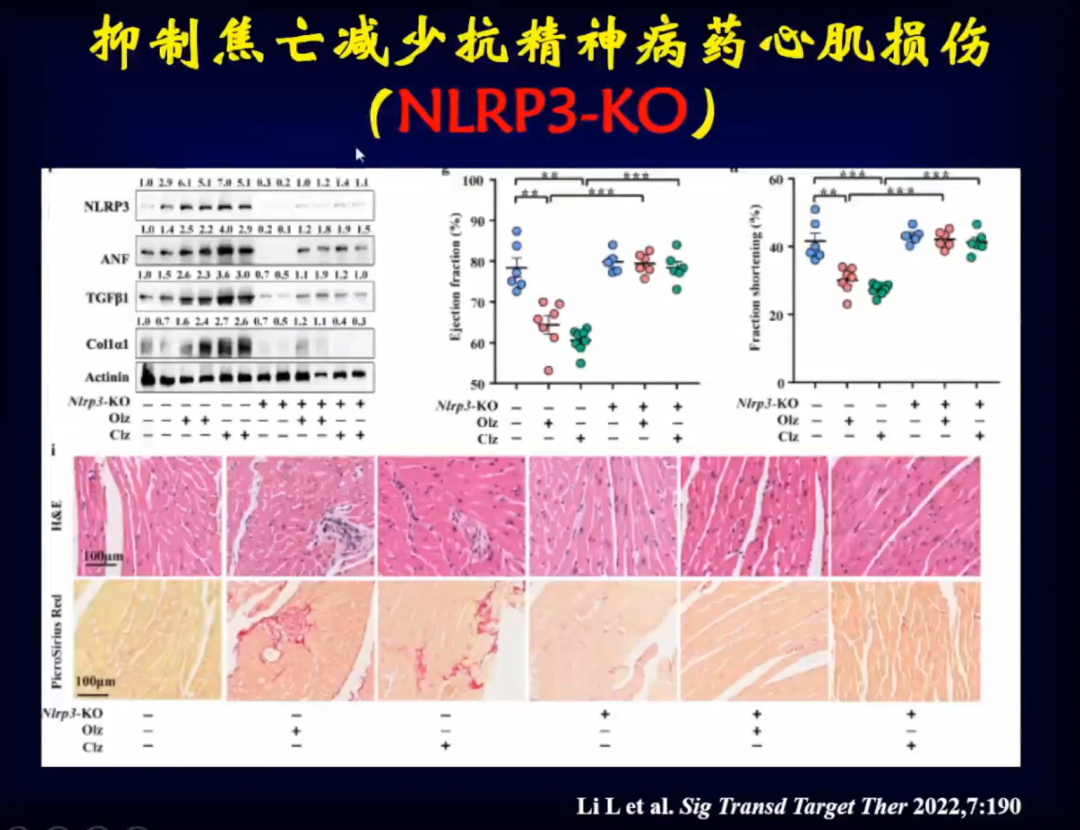
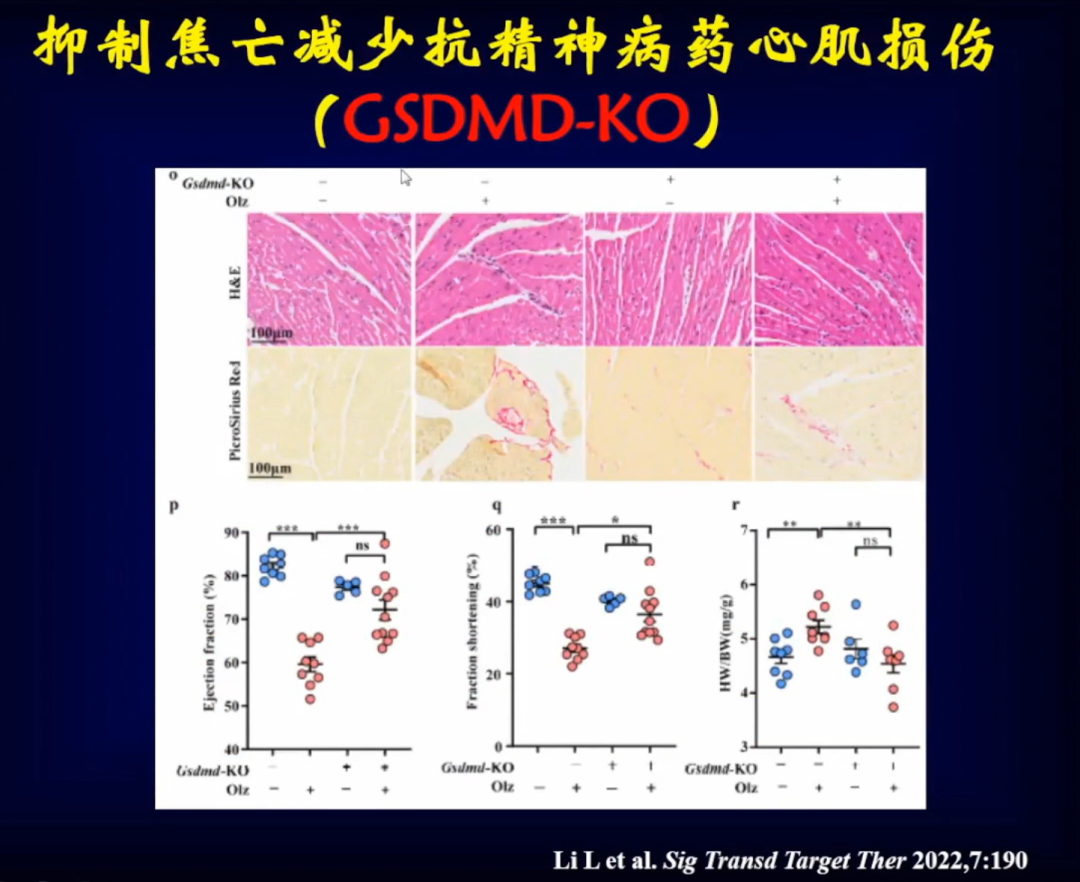
将小鼠GSDMD-KO敲除后,再使用奥氮平,发现小鼠心肌重构和心脏功能都发生明显的改善。
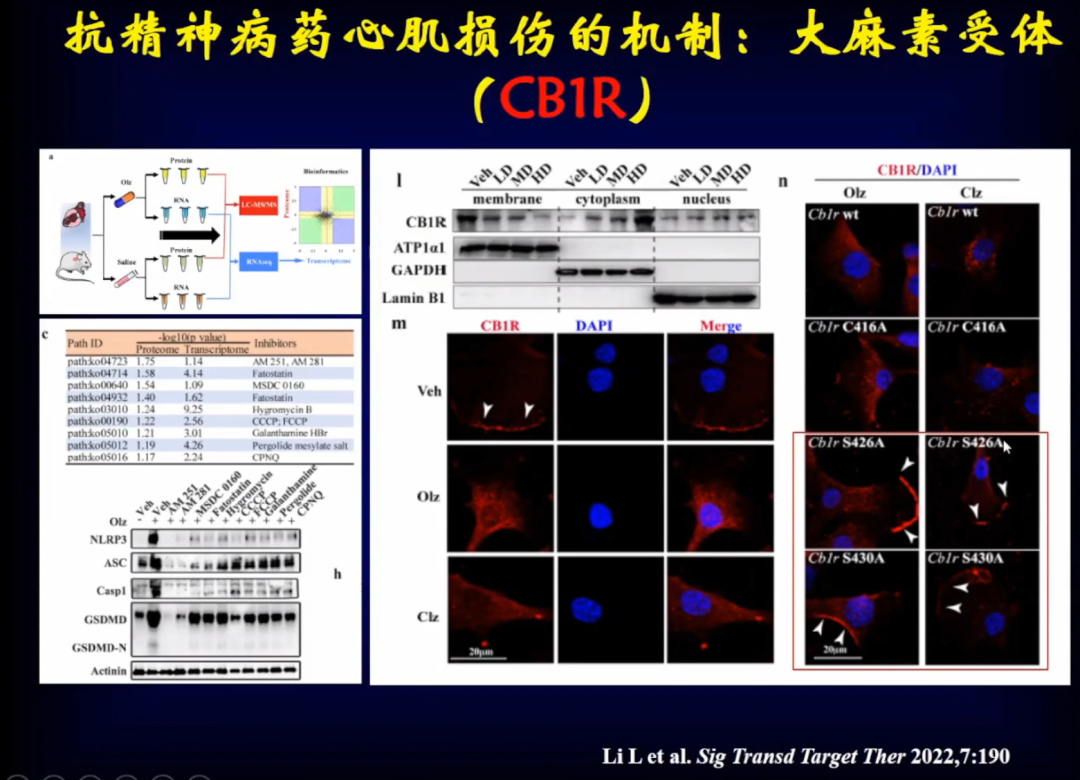
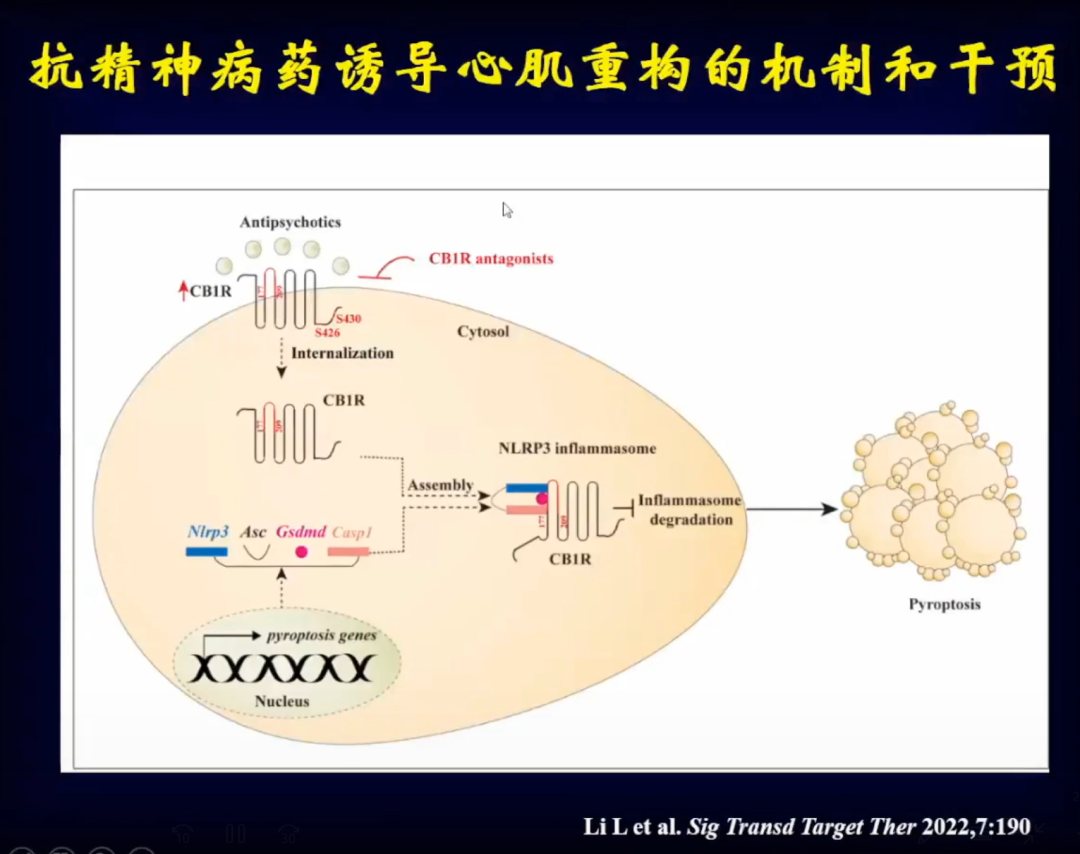
奥氮平是怎么导致心肌细胞焦亡的?研究发现在心脏组织当中有大量奥氮平,同时发现了大麻素受体(CB1R),通过转录组学分析发现CB1R明显增高。使用CB1R抑制剂后,心肌细胞焦亡明显减少,因此CB1R可能是调节心肌细胞焦亡的很重要的受体。通过染色看到使用奥氮平后,CB1R在心肌细胞内明显高表达。将CB1R两个位点突变后,发现心肌细胞不再焦亡。
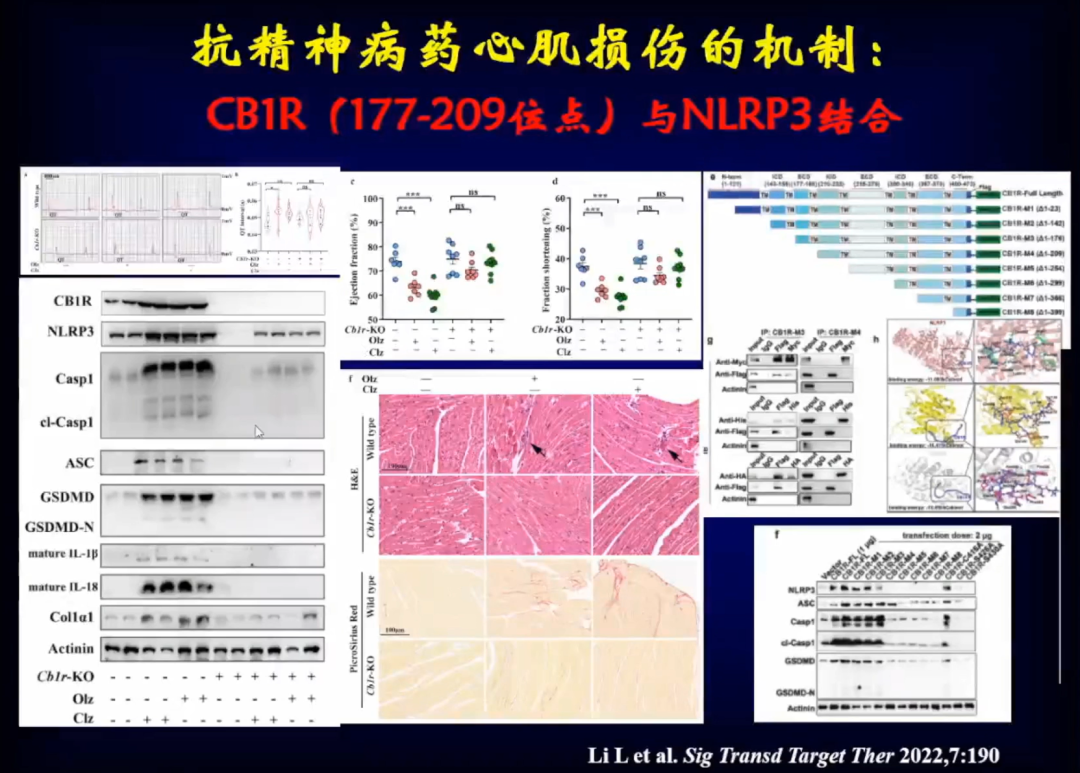
通过进一步研究,发现将CB1R(177-209位点)与NLRP3结合会产生细胞焦亡。
通过人体标本验证发现,应用奥氮平后人体心肌内的大麻素受体会被明显激活,大麻素受体被激活后会激活炎症小体,进而导致心肌细胞焦亡。
这是CB1R受体示意图,现在有一些大麻素受体抑制剂,但是副作用都很大,现在正在继续寻找针对这些活性位点的化合物,来阻断一些药物导致的心肌重构问题。
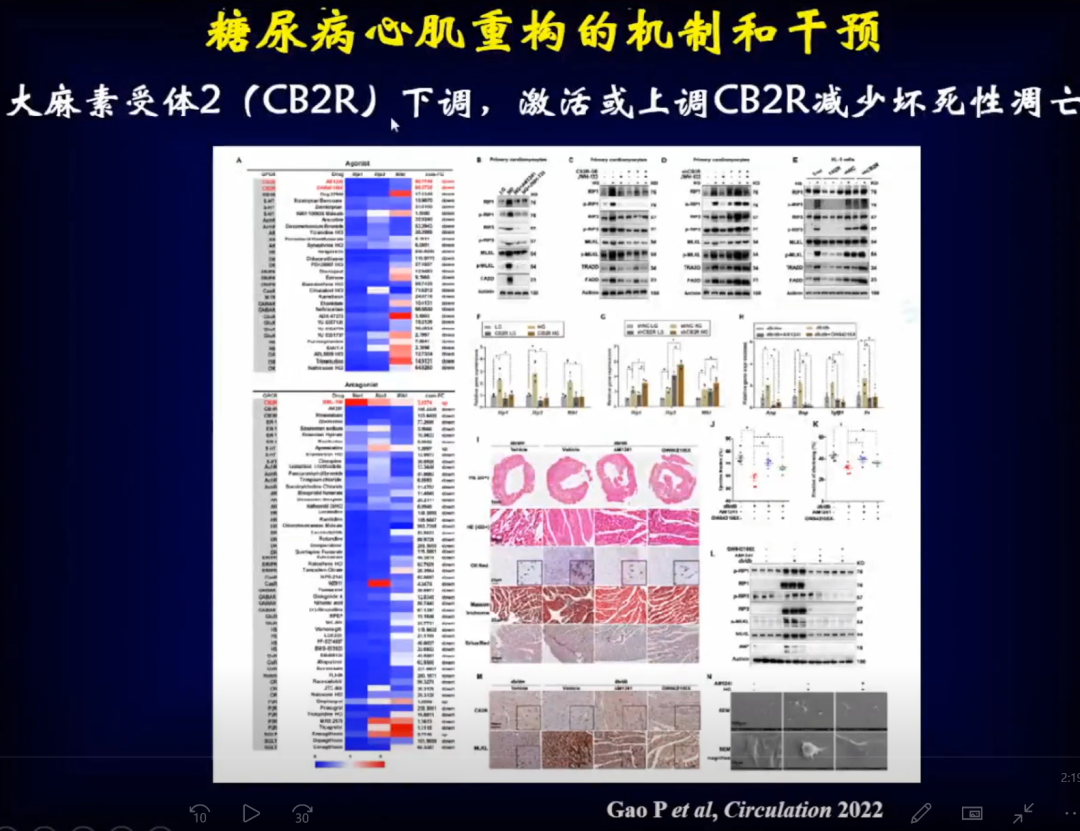
近日一篇发表在Circulation的研究发现,在糖尿病心肌病患者体内,大麻素受体2(CB2R)明显降低,进而引起心肌损伤,特别是在糖尿病后期这个现象尤为明显。
进一步研究发现,糖尿病心肌病患者体内,CB2R明显降低,并且糖尿病心肌损伤后期心肌细胞坏死性凋亡增多。
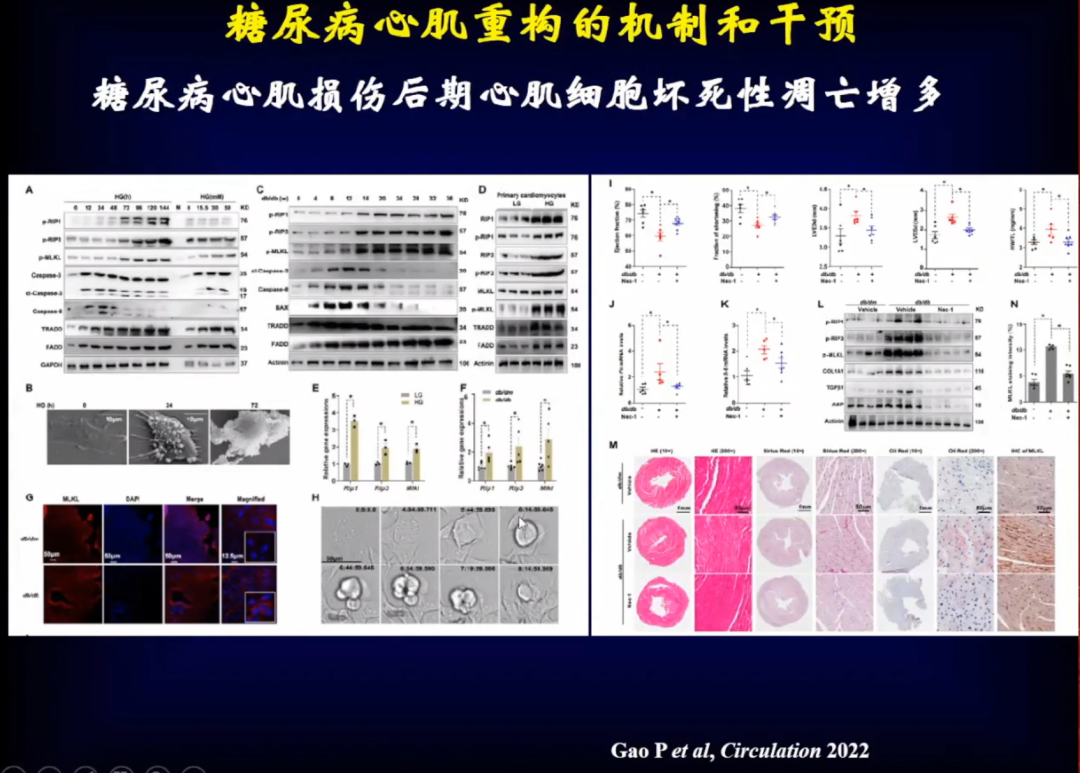
将CB2R激活或上调后,心肌细胞坏死性凋亡明显减少。
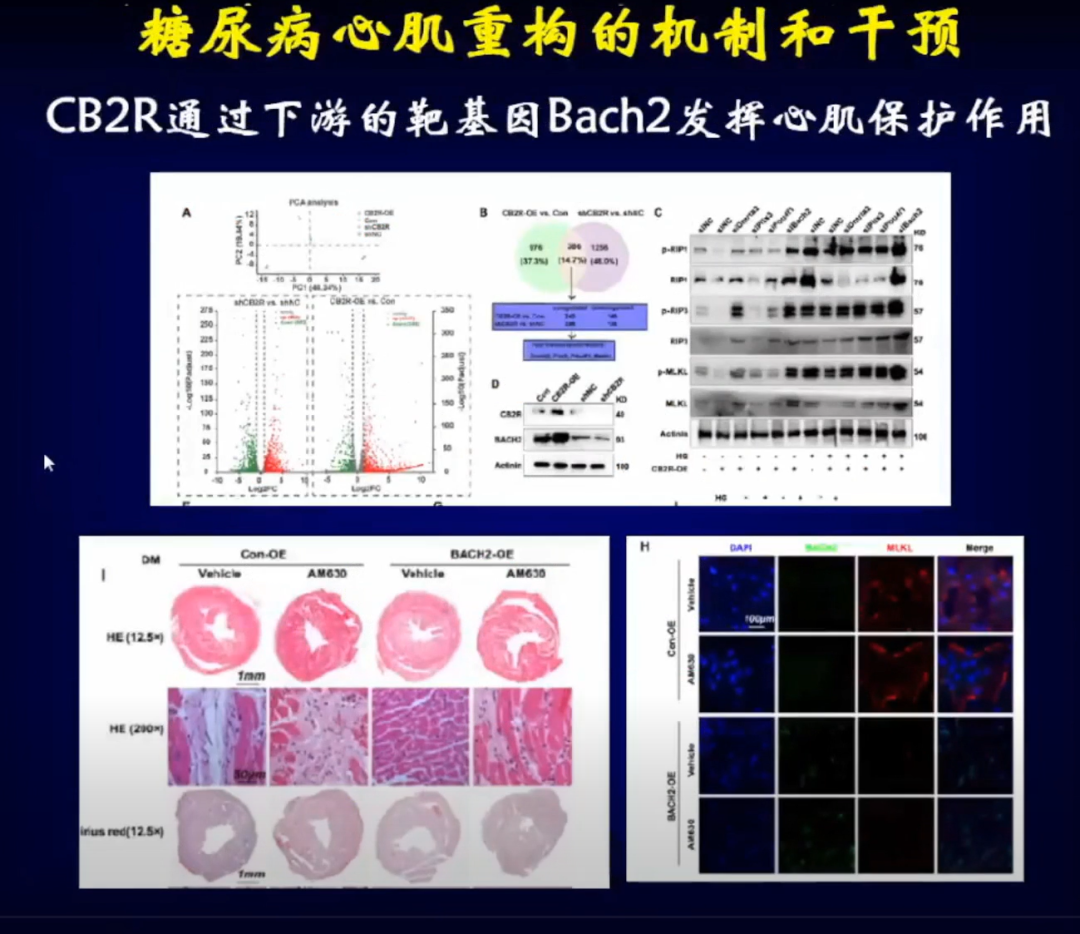
进一步分析,发现CB2R可以通过下游的靶基因Bach2发挥心肌细胞的保护作用。
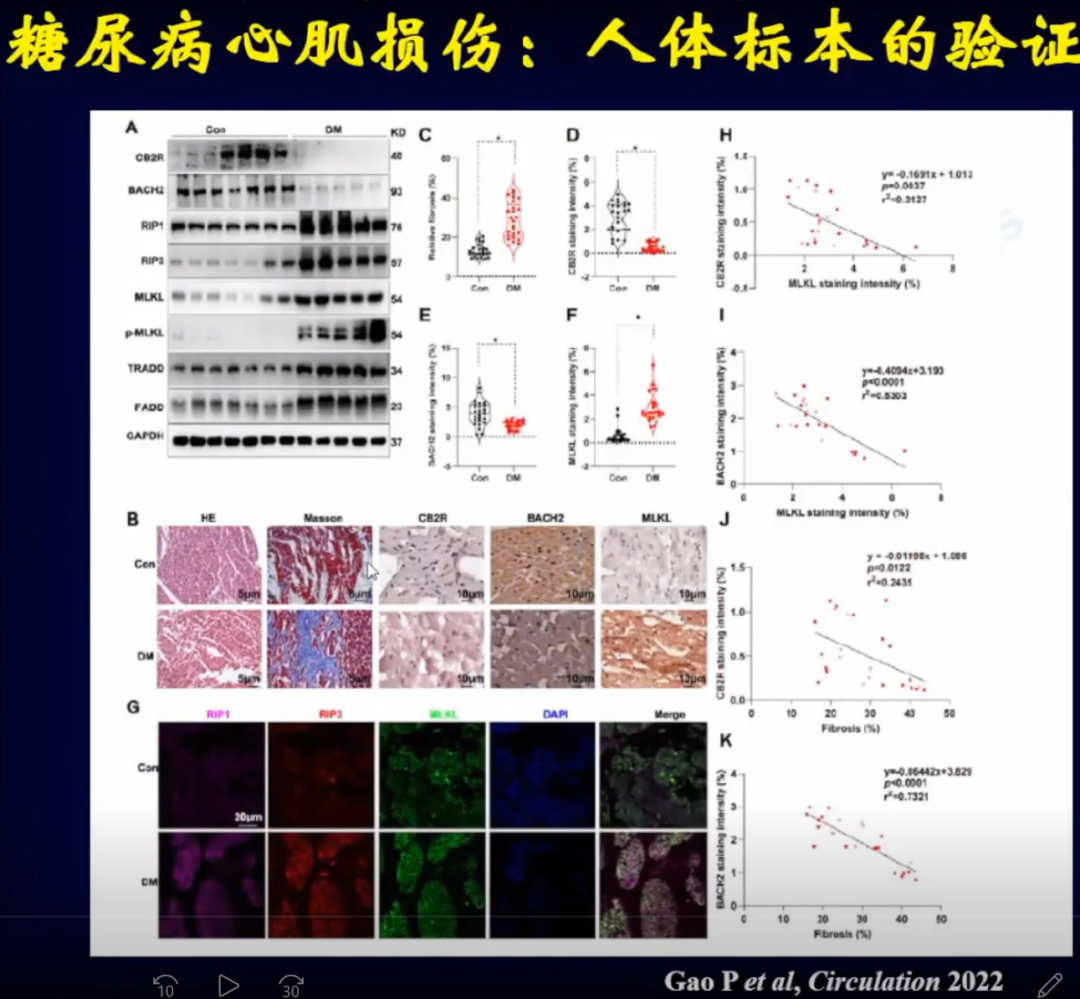
邹云增教授团队将以上研究结果应用与人体标本验证,证实人体内也会出现上述情况。
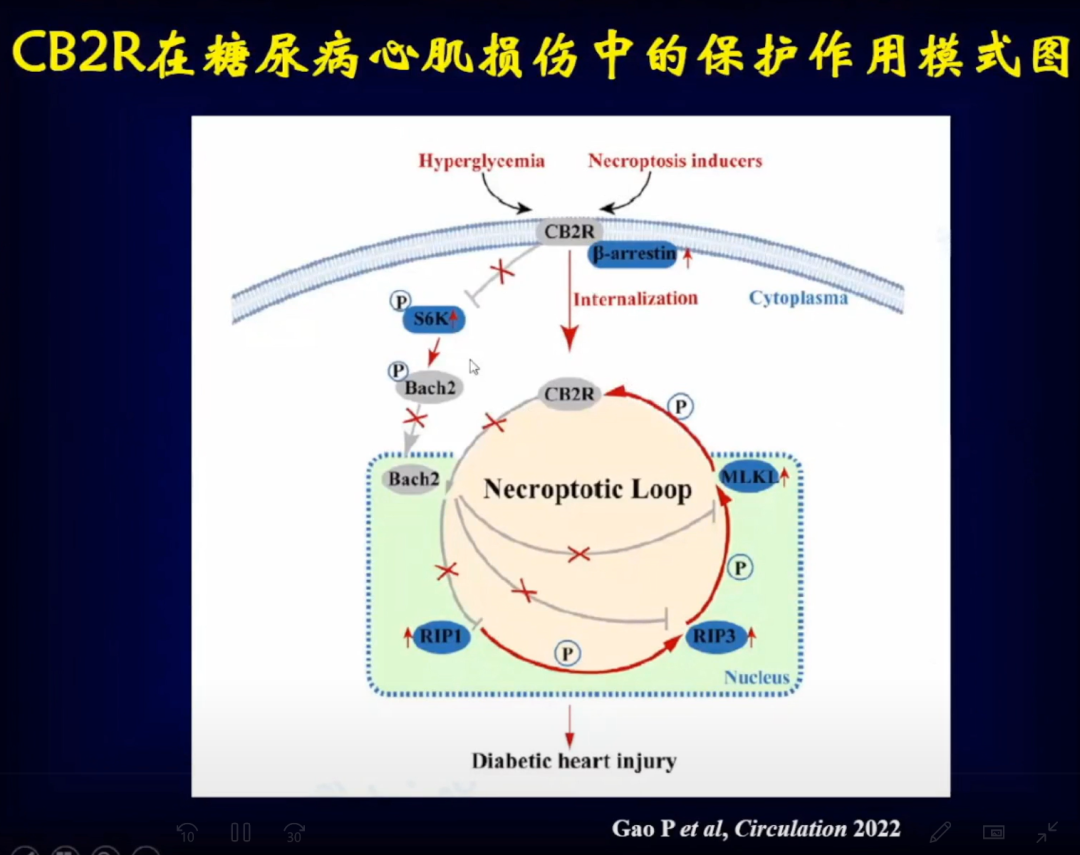
大麻素受体非常重要,但是在心血管疾病中对其重视不够,大麻素受体在心血管疾病中的研究很少。邹云增教授团队研究发现了CB1R介导心肌细胞以及药物导致心肌细胞的焦亡,从而导致心肌重构,CB2R的下调介导了糖尿病导致的心肌重构。针对这两个受体将来会开发新的干预手段,可能对心血管疾病有一定的干预作用。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









赞
53