ATVB 哈尔滨医科大学孙长颢教授团队揭示内皮细胞自噬通过外泌体调控细胞间交流保护动脉粥样硬化的分子机制
2024-07-20 论道心血管 论道心血管 发表于上海
研究揭示了内皮细胞自噬保护动脉粥样硬化的外泌体途径,为相关疾病的治疗提供了新的思路及靶点。
心血管疾病是造成全球死亡的主要原因之一,是我国乃至全球亟待解决的重大公共卫生问题。动脉粥样硬化是心血管疾病最主要的病理基础,其病理过程涉及多种细胞参与,包括内皮细胞、平滑肌细胞、免疫细胞等。不同类型血管细胞之间的细胞通讯在维持血管稳态和调节动脉粥样硬化发生发展中发挥重要作用。然而,调控血管细胞间通讯的生物学机制以及这种生物学机制是否可以用于治疗动脉粥样硬化仍然未知。
2024年7月3日,哈尔滨医科大学公共卫生学院营养与食品卫生学教研室孙长颢教授团队在Arteriosclerosis, Thrombosis, and Vascular Biology上发表了题为“Endothelial Autophagy Promotes Atheroprotective Communication Between Endothelial and Smooth Muscle Cells via Exosome-Mediated Delivery of miR-204-5p”的研究论文,揭示了内皮细胞自噬保护动脉粥样硬化的外泌体途径,为相关疾病的治疗提供了新的思路及靶点。

为了明确内皮细胞自噬在动脉粥样硬化中的作用,作者检测了高脂喂养ApoE-/-小鼠主动脉不同区域的内皮细胞自噬变化,发现在高脂喂养16周后,LC3在主动脉高剪切力区的内皮细胞中增加,而在低剪切力区基本检测不到。作者进一步利用雷帕霉素和携带Atg7短发夹RNA的腺相关病毒(AAV-sh-Atg7)分别激活和抑制高脂喂养的ApoE-/-小鼠内皮细胞自噬。结果发现,雷帕霉素注射后,主动脉大体和窦部脂质斑块显著减少,同时改善了内皮细胞功能障碍和凋亡;相反,在注射AAV-sh-Atg7后观察到高脂喂养诱导的动脉粥样硬化负担和内皮细胞凋亡进一步加重。
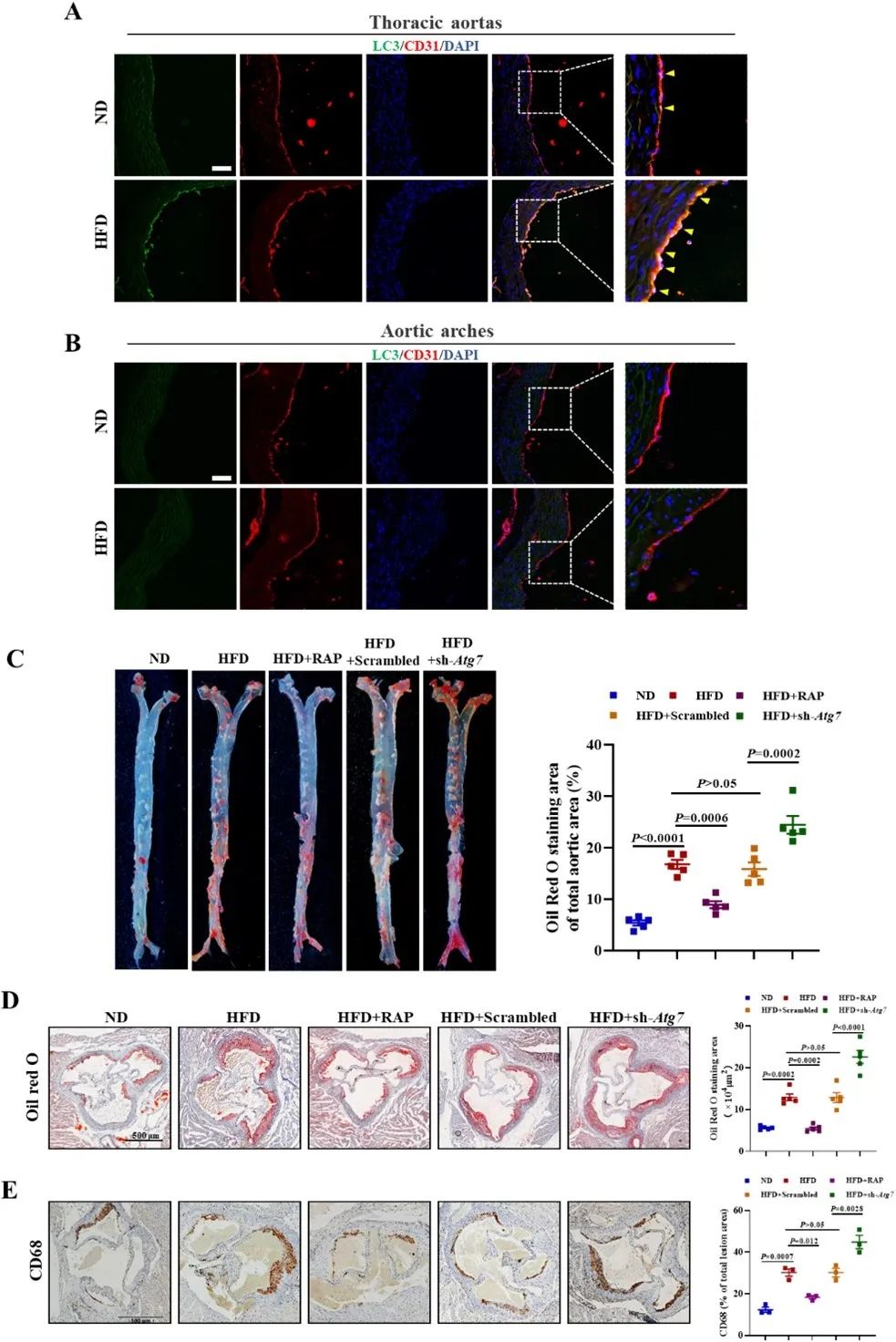
为了探索内皮自噬通过调控外泌体miRNA对内皮细胞凋亡的影响及机制,作者进行了血管miRNA微阵列检测分析,发现miR-204-5p在高脂喂养小鼠主动脉中显著增加。重要的是,激活内皮自噬通过将内皮细胞中积累的miR-204-5p装载到多囊泡体中并由外泌体分泌,从而缓解了内皮功能障碍和凋亡。分子机制研究发现,miR-204-5p通过靶向调控BCL2的表达,进而影响内皮细胞凋亡。同时,作者发现,miR-204-5p在冠状动脉粥样硬化性心脏病患者血管内皮细胞中也明显增加,且其表达水平与内皮细胞凋亡水平呈显著正相关。
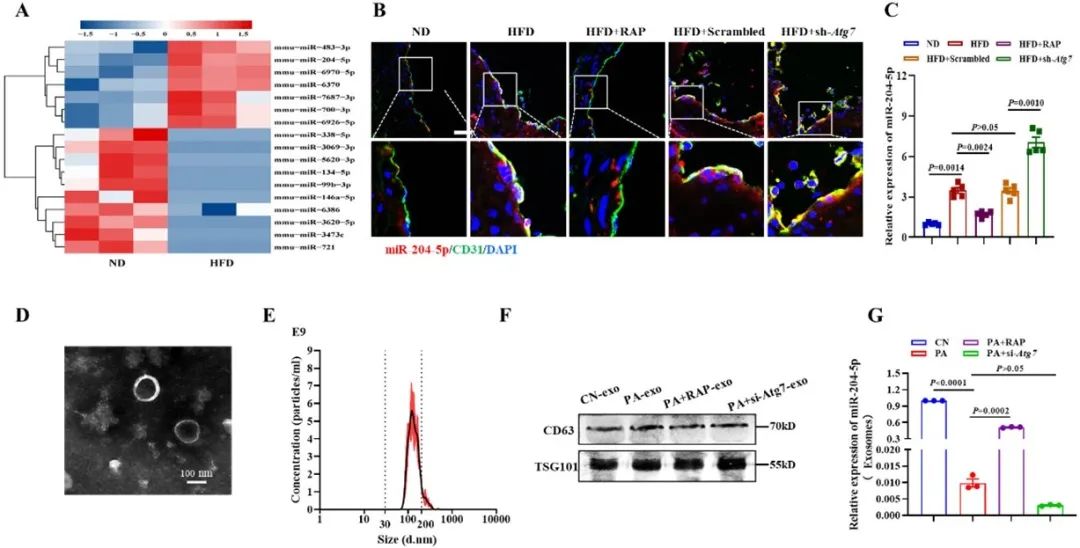
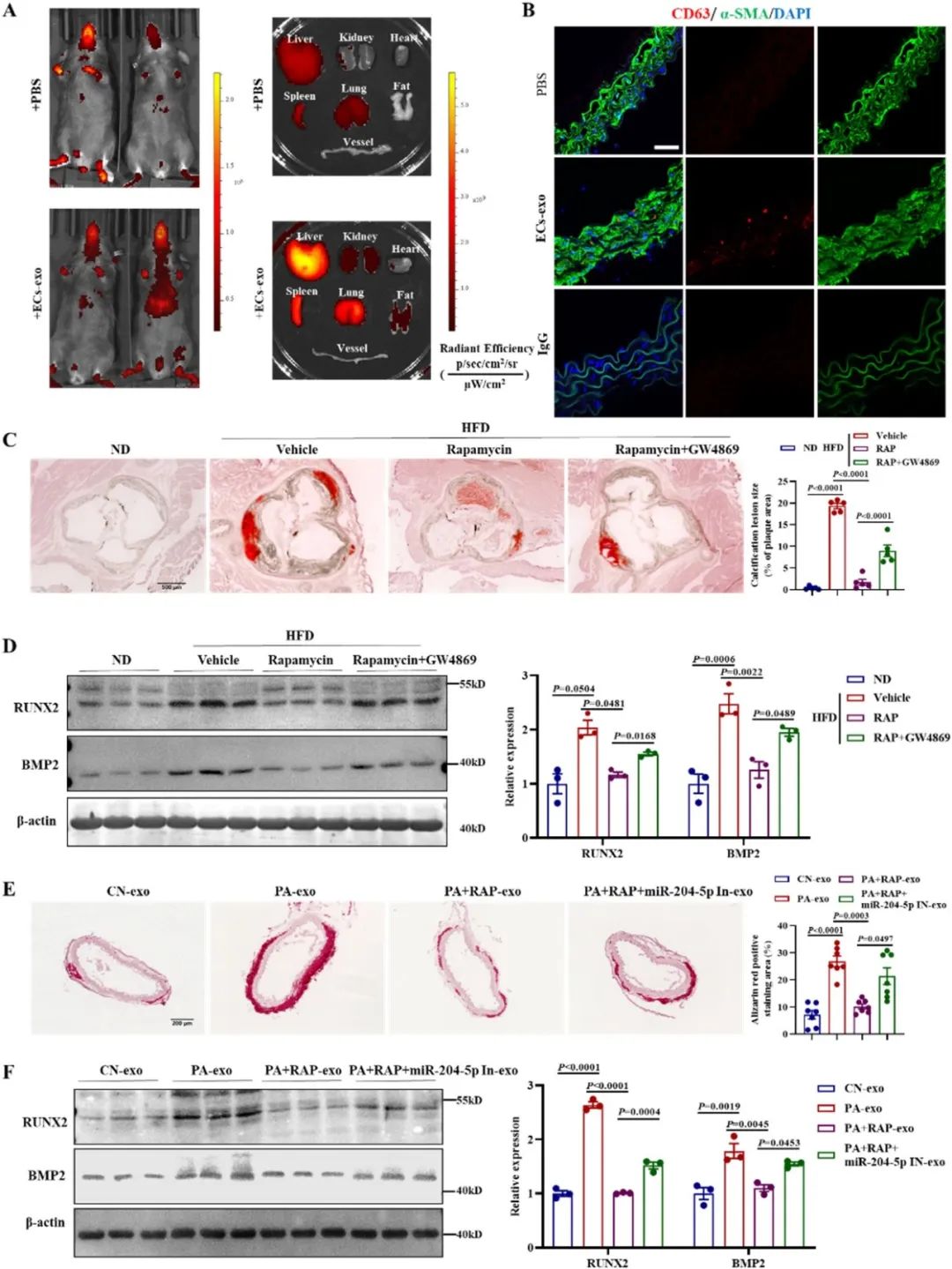
考虑到内皮细胞外泌体对平滑肌细胞表型的调控作用,作者研究了内皮细胞来源的外泌体miR-204-5p对平滑肌细胞钙化的影响。作者首先通过体内成像系统和细胞-外泌体共培养实验,发现自噬激活的内皮细胞释放的外泌体miR-204-5p能有效进入到血管平滑肌细胞中,并通过调节RUNX2等蛋白缓解血管平滑肌细胞钙化。此外,应用外泌体和miRNA抑制剂,分别抑制内皮细胞外泌体和miRNA的分泌,进一步明确激活内皮细胞自噬通过外泌体miR-204-5p减轻血管平滑肌细胞钙化。
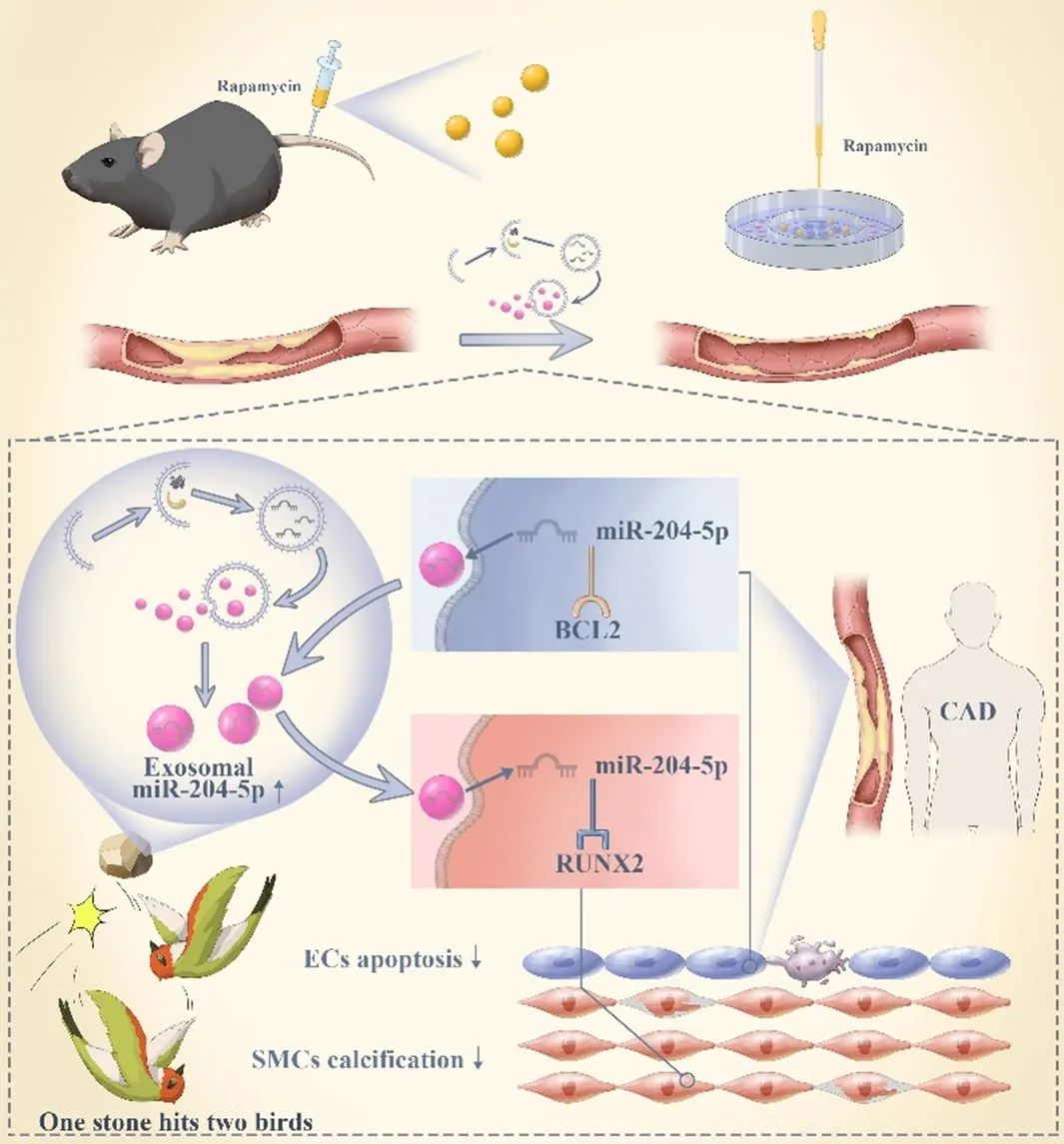
综上所述,该研究揭示了激活内皮细胞自噬通过外泌体促进动脉粥样硬化保护性通讯,在治疗动脉粥样硬化中,发挥“一石二鸟”的作用,为动脉粥样硬化性血管疾病的治疗提供新的思路与潜在靶点。
哈尔滨医科大学公共卫生学院博士生田珍、教授宁华以及博士生王心玥为该文章共同第一作者,孙长颢教授和韩天澍教授为通讯作者。该工作得到国家自然科学基金资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.319993
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#动脉粥样硬化# #外泌体# #内皮细胞自噬#
98