杭师大刘俊秋/沈万华教授团队Sci. Adv.:光催化MOFs高效产H₂O₂激活神经钙离子信号和调控动物行为
2024-04-24 BioMed科技 BioMed科技 发表于陕西省
研究员首次开发了基于小分子光催化剂的金属有机框架(DCSA-MOFs),通过激光高时空分辨地照射在细胞内的局部区域,能在细胞、组织和离体器官三个层面精准调控Ca2+信号,最终控制动物的行为。

近日,杭师大材化学院刘俊秋教授团队/生环学院沈万华教授团队携手合作,在生物Ca2+信号激活的交叉研究领域取得突破性进展,相关研究成果以题为“Photocatalytic manipulation of Ca2+ signaling for regulating cellular and animal behaviors via MOF-enabled H2O2 generation”发表于Science子刊Science Advances。
作为细胞内的第二信使,H2O2具有毒性低、半衰期长和扩散距离远等特性,能通过氧化细胞内质网上肌醇三磷酸受体(IP3Rs)的巯基来打开该离子通道,从而释放内质网中的Ca2+。目前已开发的H2O2递送系统无论是直接递送,还是通过葡萄糖过氧化物酶或金属过氧化物原位产生H2O2都存在提前泄露或持续释放的缺陷,并不适合神经的可控激活。利用远程无线调控的手段,研制具有开关响应特性的“H2O2发生器”不仅能避免H2O2过量释放带来的细胞损伤,同时还能实现细胞Ca2+信号的精准激活。然而“H2O2发生器”相关的概念目前罕有报道。
针对该研究现状,杭师大刘俊秋教授团队/沈万华教授团队首次开发了基于小分子光催化剂的金属有机框架(DCSA-MOFs),通过激光高时空分辨地照射在细胞内的局部区域,能在细胞、组织和离体器官三个层面精准调控Ca2+信号,最终控制动物的行为。DCSA-MOFs无需有毒的有机牺牲试剂,仅以生物体系中充足的氧气和水为底物,在光照条件下高效产生H2O2;在激活IP3Rs后使Ca2+从内质网中快速流出,从而激活细胞Ca2+信号。这种调控方式具有精度性高(亚细胞器水平),可重复激活和开关可控性。该研究提供了一种非遗传性的光学调控技术,具有如下优势:(1)IP3Rs在多种细胞中广泛表达,极大地扩展了应用范围;(2)H2O2能安全高效地刺激IP3Rs,并在刺激结束后快速扩散到溶液中,降低对细胞造成的损伤;(3)光催化反应只消耗H2O和O2,避免了负载剂的消耗和H2O2的泄漏;只在光照条件下进行,具有开关可控的特性;(4)DCSA-MOFs在细胞内稳定存在,可用于神经Ca2+信号的长期调控。
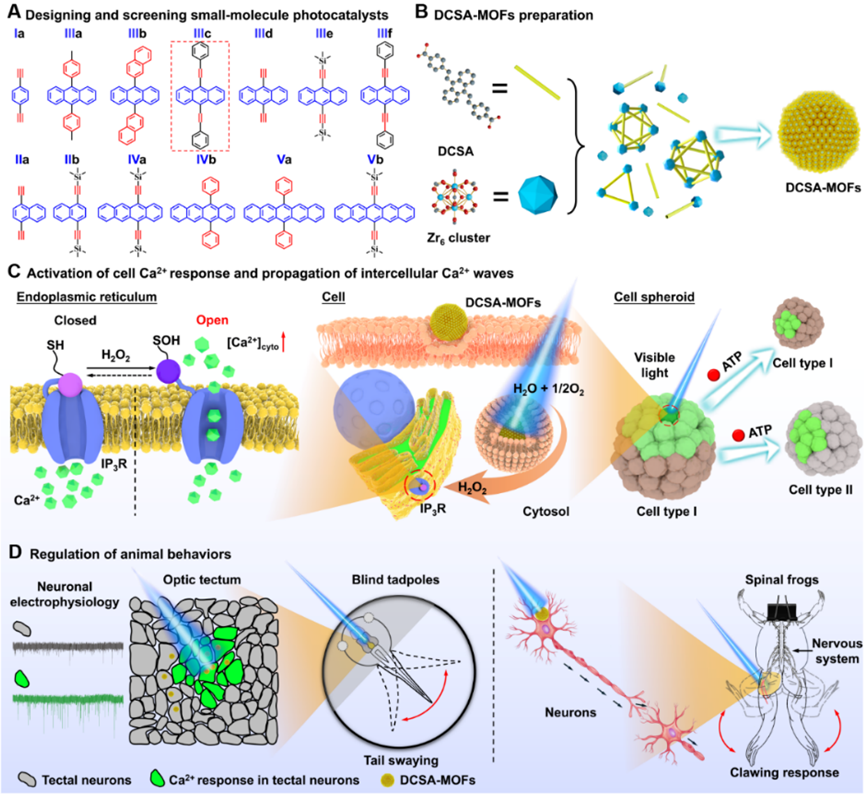
图1. DCSA-MOFs的制备、细胞Ca2+信号调控、动物神经激活和运动行为调控。
研究者们共设计了13种具有不同主链苯环个数和侧链取代基结构的小分子光催化剂,结合密度泛函理论计算,筛选出了具有最高催化活力的IIIc。其衍生物9,10-Di(p-carboxystyryl)anthracene (DCSA)与Zr6簇配位后,能高密度地封装光催化剂,提高其在水中的分散性,并避免因分子聚集诱导的猝灭效应而导致的光活性降低。DCSA-MOFs可快速被细胞摄取或粘附在神经元细胞膜表面;在可见光照射下,DCSA分子发生电荷分离,生成的电子通过二电子水还原反应(2e- ORR)快速地在纳米颗粒周围形成较高局部浓度的H2O2,从而激活细胞Ca2+信号。该调控方式成功地激活了至少10种细胞系,避免使用遗传工程手段,因此具有很高的通用性。受激细胞还能通过分泌ATP分子或通过间隙连接扩散的方式在细胞间快速传播Ca2+波,从而实现细胞通讯。
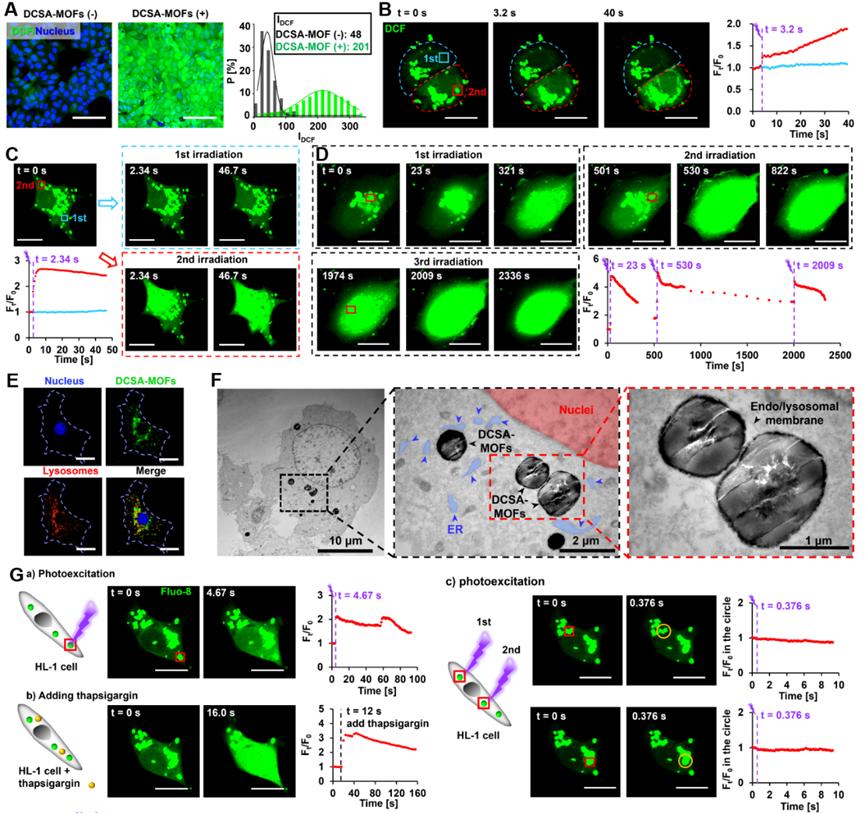
图2. DCSA-MOFs在细胞内的分布、光催化提升细胞ROS水平和Ca2+信号激活。
在此基础上,研究者们使用DCSA-MOFs成功使致盲的白化非洲爪蛙蝌蚪恢复对光照的感知。在脑室注射DCSA-MOFs后,通过光催化产生H2O2成功激活了视顶盖神经元,模拟了视觉信号的输入。视顶盖神经元将信号投射到后脑和网状脊髓神经元,并进一步激活脊髓中的运动神经元和中枢模式发生器来控制蝌蚪的尾部运动。将蝌蚪的头包埋在低熔点的琼脂糖后用405 nm激光照射,可以观测到蝌蚪尾巴开始摇摆。通过测量反应延迟期、摇摆频率和持续时间参数来评估蝌蚪的光照回避行为。当去掉双眼和嗅球时,平均延迟期约为14.9 s,明显长于对照蝌蚪(约2.7 s)和没有眼睛的蝌蚪(约3.4 s)。令人兴奋的是,在没有眼睛和嗅球的蝌蚪中,DCSA-MOFs显著地将反应延迟时间降低到正常水平(约3.3 s)。因此,研究者成功地利用激光照射来控制蝌蚪的视觉回避行为。
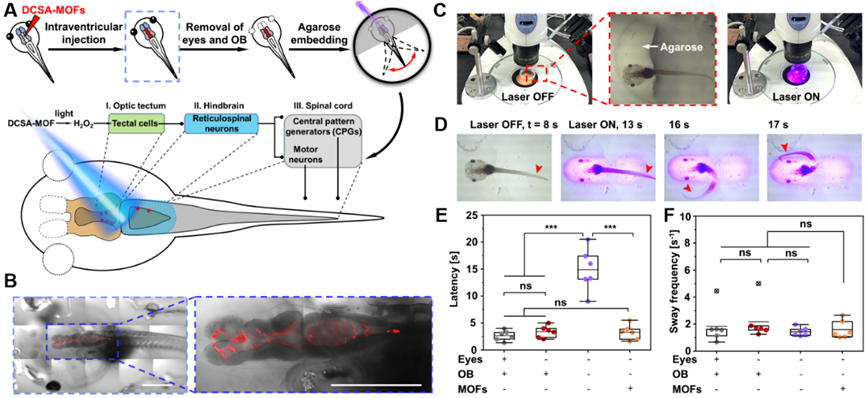
图3. DCSA-MOFs激活致盲的白化非洲爪蛙蝌蚪中的视顶盖神经元,调控尾部运动。
在该研究工作中,张哲瑞博士(杭师大和中南大学联培)为论文的第一作者,骆瑜豪硕士(杭师大生环院)为论文的共同一作。杭师大材化学院刘俊秋教授、祝鼎成副教授、生环学院沈万华教授为论文的共同通讯作者。杭师大材化学院为第一完成单位。该工作得到国家自然科学基金,科技部重点研发计划、杭州市创新团队等项目的资助与支持。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adl0263
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Ca2+信号# #MOFs#
81