Front Immunol :糖尿病肾病肠道菌群的特异性改变——系统综述和荟萃分析
2022-08-16 从医路漫漫 MedSci原创
DKD是糖尿病最常见的微血管并发症,也是终末期肾病(ESRD)的主要原因,其全因死亡率比无肾病的糖尿病患者高约30倍,给患者和国家带来了巨大的经济负担。

背景:国际糖尿病联盟(IDF)2021年发布的数据显示,全球约有5.37亿20-79岁的成年人被诊断为糖尿病,到2045年将达到7.83亿。大约20%-40%的糖尿病患者会发展为糖尿病肾病(DKD) 。DKD是糖尿病最常见的微血管并发症,也是终末期肾病(ESRD)的主要原因,其全因死亡率比无肾病的糖尿病患者高约30倍,给患者和国家带来了巨大的经济负担。在DKD,包括肾小球肥大、系膜扩张、肾小管间质纤维化和炎症在内的严重病理损伤的发病机制尚未完全阐明,传统治疗如降血压、降血糖和调脂已被证明无法阻止进行性肾脏损伤。
人类肠道微生物组被描述为控制人类健康的“第二基因组”,它通过基因、中间体和代谢活动影响人类的代谢和免疫功能。最近的研究表明,肠道微生物菌群失调中较低的α多样性和促炎环境的特征通过激活和增殖胰腺引流淋巴结T细胞,特别是糖尿病性CD8+ T细胞,促进了胰岛素炎症状态,这可能促进遗传易感个体发生1型糖尿病(T1D)的风险。在2型糖尿病(T2D)的情况下,肠道微生物分类群可以作为疾病诊断和预测缓解的生物标志物,它们与饮食成分相互作用以调节炎症,影响肠道通透性、葡萄糖和脂质代谢、胰岛素敏感性和整体能量稳态,涉及T2D的病理生理学。DKD是糖尿病最常见、最严重的并发症之一,其肠道菌群的新兴作用引起了广泛关注,被认为是影响DKD发生发展的重要因素。研究表明,肠道微生物群通过激活关键的核受体(如G蛋白偶联受体TGR5和法尼类X受体),以及产生胰高血糖素样肽1 (GLP-1)和YY肽(PYY) 来维持能量平衡和葡萄糖稳态,从而介导胆汁酸的合成、修饰和摄取。
在DKD患者紊乱的肠道微生物群中,革兰氏阴性菌的过度表达伴随着有效免疫刺激剂脂多糖(LPS)的血清水平显著升高,这与炎症标记物相关,如白细胞介素6 (IL-6)、C反应蛋白(CRP)和肿瘤坏死因子-a (TNFa) 。同时,含有脲酶的细菌的扩张导致肠腔中氨浓度和pH值增加,导致肠渗透性增强,使吲哚和对甲酚等物质转移到血液中,并代谢为尿毒症毒素,从而诱导肾脏损伤。此外,肠道微生物菌群失调可通过激活肾素-血管紧张素系统导致肾小球基底膜增厚和足细胞足突消失,并通过胆固醇稳态的破坏导致肾小管间质损伤在临床前模型中DKD的进展。而肠道微生物群干预,如益生菌补充、抗生素给药和粪便微生物群移植可以部分改善DKD的肾功能和病理。这些证据表明,针对DKD特定微生物类群的干预可能是预防和治疗DKD的有效策略。因此,应确定具体的致病机制,以更好地管理DKD。
尽管在不同人群中进行的大量病例对照研究或横断面研究已经描述了DKD肠道微生物群的特征,但在DKD和健康对照(HC)之间描述微生物差异的结果并不一致。例如,辛晓红等人发现的α多样性显著高于HC,而鲍等人发现的α多样性显著降低。另一方面,与HC相比,在DKD的两项研究中,Lachnospira属、Rothia属和Lachnoclostridium属的丰度发生了逆转。简而言之,当确定DKD肠道微生物群特征时,DKD和HC之间的肠道微生物群差异在不同的研究中缺乏明显的可重复性。
目的:因此,我们进行了系统回顾和荟萃分析,以剖析DKD和HC患者肠道微生物群中细菌多样性、微生物类群相对丰度和细菌代谢物的差异,从而确定与DKD密切相关的关键类群,并为预防和治疗DKD提供潜在的细菌靶点。
方法:检索PubMed、Web of Science、Cochrane、中国生物医学数据库、中国国家知识网和Embase进行病例对照或横断面研究,比较从开始到2022年2月8日DKD患者和健康对照(HC)的肠道微生物群,对DKD和HC之间的α多样性指数进行随机/固定效应荟萃分析,提取β多样性指数和肠道微生物群的相对丰度,并进行定性总结。
结果:共纳入16项研究(578例DKD患者和444例HC患者)。与HC患者相比,DKD患者的细菌丰富度显著降低,多样性指数降低但无统计学意义,并伴有明显的β多样性。在DKD患者中,变形菌门、放线菌门、拟杆菌门、科氏杆菌科、肠杆菌科和韦荣氏菌科、肠球菌属、柠檬酸杆菌属、埃希氏菌属、克雷伯氏菌属、阿克曼氏菌属、萨特累拉菌属、不动杆菌属和大肠杆菌属的相对丰度增加,而厚壁菌门、拉希氏菌科、Roseburia属、普雷沃菌属和双歧杆菌属的相对丰度减少。
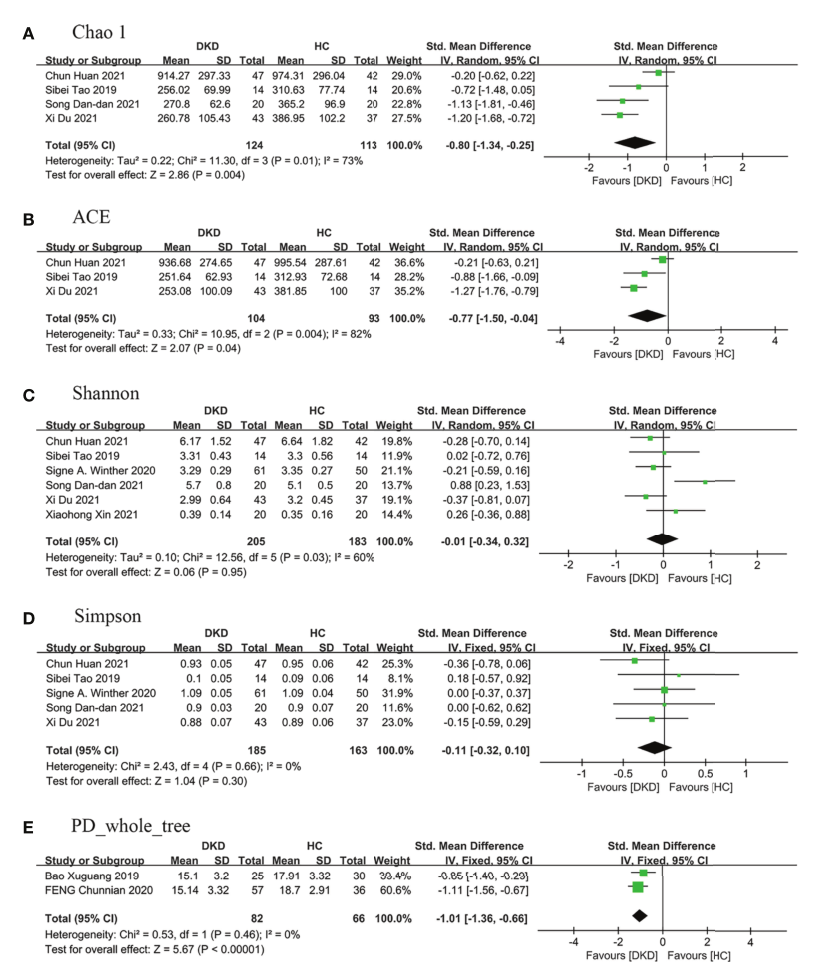
图1 与HC患者相比,DKD患者肠道微生物群中α多样性的森林图。(A) Chao1指数,(B) ACE指数,(C)香农指数,(D)辛普森指数,(E)PD _全树指数。a和B代表丰富度,C、D、E代表均匀度。DKD,糖尿病肾病;HC,健康对照。
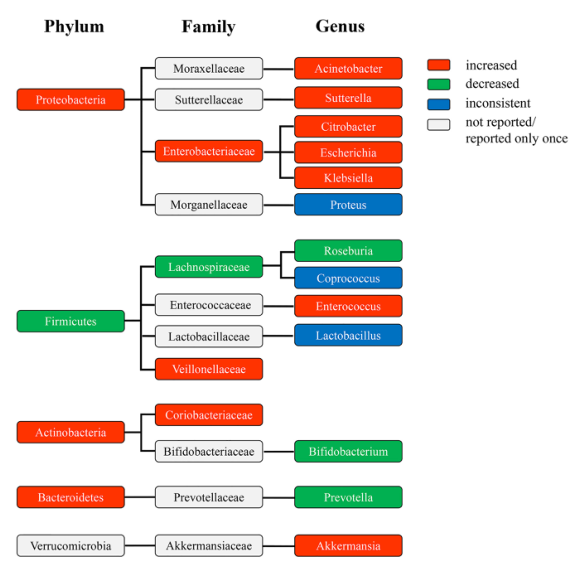
图2 与HC患者相比,DKD患者在门、科和属水平上差异丰富的分类群的系统发育图。颜色表示门、科和属水平上的不同细菌变异。红色,丰度增加。绿色,丰度下降。蓝色,丰度不一致。灰色,大量未报告或仅报告一次。DKD,糖尿病肾病;HC,健康对照。
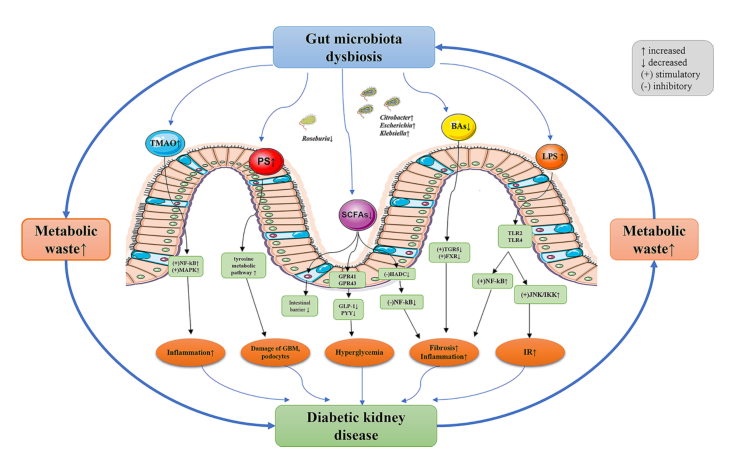
图3 道生态失调和DKD之间的潜在机制。DKD患者肾小球滤过率降低导致代谢废物积聚,通过肠壁进入肠腔,导致肠道生态失调。DKD患者肠道菌群的组成和功能发生显著变化,导致肠道上皮屏障功能被破坏。肠道微生物群代谢物进入血液,并通过多种途径进一步加剧DKD的进展。三甲胺-N-氧化物TMAO;PS,硫酸苯酯;SCFAs,短链脂肪酸;胆汁酸;LPS,脂多糖;NF- kB,核因子κ-B;MAPK,丝裂原活化蛋白激酶;g蛋白偶联受体(GPRs),如GPR41和GPR43GLP-1,胰高血糖素样肽-1;PYY,肽YY;HADC,组蛋白去乙酰化酶;TGR5,武田G蛋白受体5;FXR,法尼基X受体;TLR,toll样受体;JNK,c-Jun氨基末端激酶;IKK,伊卡帕布激酶;IR,胰岛素抵抗;GBM,肾小球基底膜;DKD,糖尿病肾病。
结论:DKD患者的肠道菌群以埃希氏菌属、柠檬酸杆菌属、克雷伯氏菌属、罗斯伯氏菌属缺失为特征的特异性特征,这可能是其相应的科和门分类群以及细菌多样性和组成发生变化的主要原因。这些微生物类群可能与DKD密切相关,有望成为DKD管理的目标。
原文出处:Wang Y, Zhao J, Qin Y,et al.The Specific Alteration of Gut Microbiota in Diabetic Kidney Diseases-A Systematic Review and Meta-Analysis.Front Immunol 2022;13
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#系统综述#
77
#荟萃分析#
80
#特异性#
145
#荟萃#
81
#肠道菌#
143
学习了
0
好文章,谢谢分享。
108