Cell:我国科学家揭示吃了受感染食物后呕吐的神经通路
2022-11-19 生物谷 生物谷
吃了被污染的食物后有呕吐的冲动是身体摆脱细菌毒素的自然防御反应。然而,我们的大脑在检测到病菌后如何启动这一生物反应的过程仍然难以捉摸。
吃了被污染的食物后有呕吐的冲动是身体摆脱细菌毒素的自然防御反应。然而,我们的大脑在检测到病菌后如何启动这一生物反应的过程仍然难以捉摸。
在一项新的研究中,来自中国北京生命科学研究所、清华大学、广州医科大学、中国科学技术大学、首都医科大学和复旦大学的研究人员首次绘制了小鼠从肠道到大脑的防御反应的详细神经通路。这一发现可能有助于科学家们为接受化疗的癌症患者开发更好的抗恶心药物。相关研究结果发表在2022年11月10日的Cell期刊上,论文标题为“The gut-to-brain axis for toxin-induced defensive responses”。

许多食源性细菌被摄入后在宿主体内产生毒素。大脑在感觉到它们的存在后,将启动包括呕吐和恶心在内的一系列生物反应以摆脱这些毒素,并对味道或外观相同的食物产生厌恶。
论文共同通讯作者、北京生命科学研究所的Peng Cao博士说,“但是关于这种信号如何从肠道传输到大脑的细节并不清楚,因为科学家们无法在小鼠身上研究这个过程。”啮齿动物不能呕吐,可能是因为它们的食道很长,而且与它们的身体大小相比,肌肉力量较弱。因此,科学家们一直在研究狗和猫等其他动物的呕吐,但这些动物没有得到全面的研究,因此未能揭示恶心和呕吐的机制。
Cao和他的团队注意到,虽然小鼠不会呕吐,但它们会干呕---这意味着它们也会有呕吐的冲动,但不会吐出来。该团队发现,在接受了葡萄球菌肠毒素A(Staphylococcal enterotoxin A, SEA)后,小鼠出现了不正常的张嘴现象,其中SEA是一种由金黄色葡萄球菌产生的常见细菌毒素,也会在人类身上导致食源性疾病。
接受SEA的小鼠张嘴的角度比在对照组小鼠观察到的要宽,因为对照组小鼠接受的是盐水。此外,在张嘴期间,接受SEA处理的小鼠的隔膜肌肉和腹部肌肉同时收缩,这是在狗呕吐时观察到的模式。在正常呼吸期间,动物的隔膜肌肉和腹部肌肉会交替收缩。
Cao说,“干呕的神经机制与呕吐的神经机制相似。在这个实验中,我们成功地建立了一种研究毒素引起的小鼠干呕的模式,通过这种模式,我们可以在分子和细胞水平上研究大脑对毒素的防御反应。”
在接受SEA处理的小鼠中,这些作者发现肠道中的SEA激活了肠腔内壁上的肠嗜铬细胞(enterochromaffin cell)释放神经递质血清素。释放的血清素与位于肠道的迷走神经感觉神经元上的受体结合,后者将这些信号沿着迷走神经从肠道传送到脑干的迷走神经背侧复合体中的特定类型的神经元----Tac1+DVC神经元。当Cao和他的团队使Tac1+DVC神经元失活时,与Tac1+DVC神经元活动正常的小鼠相比,经SEA处理的小鼠干呕的情况更少。
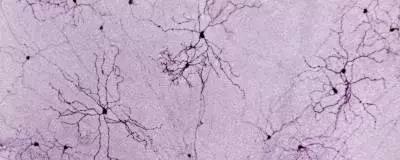
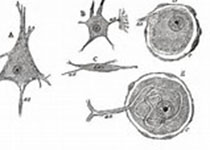
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.001。
此外,该团队还研究了化疗药物是否会激活相同的神经通路,其中这些药物也会诱发患者出现恶心和呕吐等防御性反应。他们给小鼠注射了阿霉素(doxorubicin),即一种常见的化疗药物。这种药物使小鼠干呕,但当他们让它们的Tac1+ DVC神经元或它们的肠嗜铬细胞的血清素释放失活时,它们的干呕行为就明显减少。
Cao说,目前一些针对接受化疗药物治疗的患者的抗恶心药物,如格拉司琼(Granisetron),是通过阻断血清素受体而发挥作用的。这项新的研究有助于解释格拉司琼发挥作用的原因。
Cao说,“通过这项新的研究,我们如今能够更好地了解恶心和呕吐的分子和细胞机制,这将有助于我们开发更好的药物。”
下一步,Cao和他的同事们希望探索毒素如何作用于肠嗜铬细胞。初步研究显示,肠嗜铬细胞并不直接感知毒素的存在。这一过程可能涉及肠道中受损细胞的复杂免疫反应。
Cao说,“除了食源性病菌外,人类还遇到了很多病原体,我们的身体也配备了类似的机制来驱逐这些有毒物质。例如,咳嗽是我们身体清除冠状病毒的尝试。针对大脑如何感觉到病原体的存在并启动反应以摆脱它们,这是一个新的和令人兴奋的研究领域。”他补充说,未来的研究可能会发现新的和更好的靶标用于开发药物,包括抗恶心药物。
参考资料:
Zhiyong Xie et al. The gut-to-brain axis for toxin-induced defensive responses, Cell, 2022, doi:10.1016/j.cell.2022.10.001.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言