EClinicalMedicine:FDA采用替代终点批准新药上市,值得商榷!
2020-05-10 MedSci MedSci原创
在多种原始研究类型中,随机对照试验(RCT)是证据级别最高的设计。一方面,观察性研究以及某些特定人群的临床试验的数据,常常衍生出多元甚至相反的学术观点。此时高质量的、大规模RCT就成了公允的最佳解决方
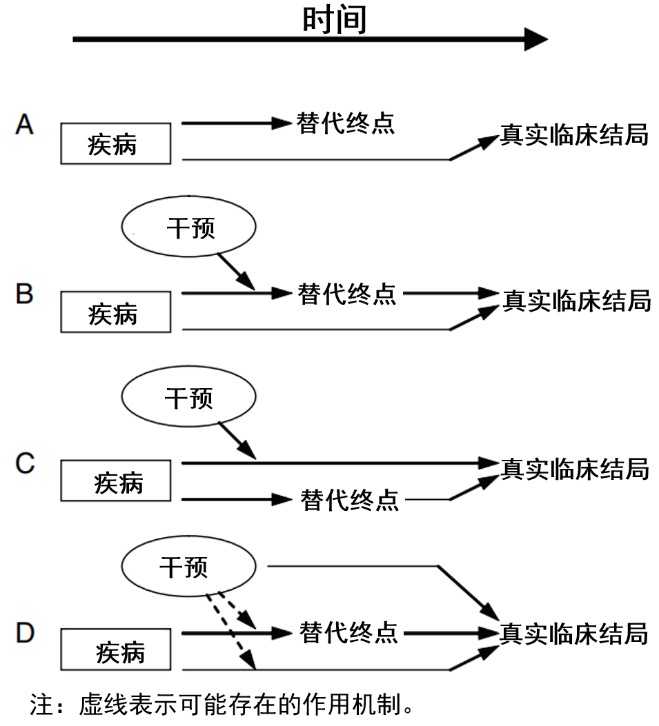
在多种原始研究类型中,随机对照试验(RCT)是证据级别最高的设计。一方面,观察性研究以及某些特定人群的临床试验的数据,常常衍生出多元甚至相反的学术观点。此时高质量的、大规模RCT就成了公允的最佳解决方案。另一方面,临床试验的设计也不能空穴来风,尤其是硬终点临床试验的开展,通常都须立足于前期小规模、探索性研究所提供的证据。 但是,受限于人力物力等因素,现实中很多研究只能退而求其次,选择与临床硬终点事件有关的生物标志物作为替代终点(软终点)。这一切的前提是,临床科学家们相信:能够使异常的生物标志物恢复正常的药物或者治疗,应该会对临床实践产生改善。 替代终点在多大程度上是真正有用的工具,能够用于获得监管部门的批准,尤其是对于癌症治疗药物。关键在于,如果替代终点最终得以验证,证实根据替代终点,能够可靠地预测生存期改善,那么患者才可能最终受益。 替代终点助力药品加速批准,降低临床开发成本 替代终点是作为代替直接评估患者在临床试验中的感觉、机能或生存期的中间终点(intermediate endpoints)。在肿瘤学临床试验中,患者感觉(生活质量)、患者寿命(总体生存期,OS)改善等指标,属于临
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#DIC#
57
#新药上市#
98
#CIN#
67
#clinical#
62
#Medicine#
57
#Med#
54
替代终点?
111