Aging Cell: 华中科大鲁友明团队揭示AD早期记忆衰退的突触相关分子机制
2023-01-25 brainnew神内神外 brainnew神内神外 发表于安徽省
突触相关分子机制在维持记忆精准性中扮演重要角色。

突触是神经元之间在功能上发生联系,进行信息传递的关键部位,而突触功能障碍是阿尔茨海默病(AD)的重要神经病理学特征。近日,华中科技大学鲁友明教授团队在Aging Cell上发表了一篇讲述突触功能障碍导致早期AD记忆精准性下降的文章,该研究显示在小鼠模型中,通过沉默miR-128或破坏miR-128与STIM2的结合会导致STIM2表达升高,进而恢复突触功能,挽救AD小鼠的记忆障碍。该研究揭示了突触相关的分子机制在维持记忆精准性中扮演的角色,为AD早期的记忆衰退提供新的思路。
(一) AD模型小鼠早期存在MC细胞的突触功能障碍
早期有报道显示,齿状回的MC细胞 (mossy cells,一种兴奋性神经元) 可直接支配SST细胞(表达生长抑素的细胞),进而控制记忆的精准性。本研究数据表明,在AD 早期确实存在MC细胞突触末端释放的神经递质减少,提示从MC到SST细胞的突触传递功能障碍可能是AD早期记忆不精确的原因。
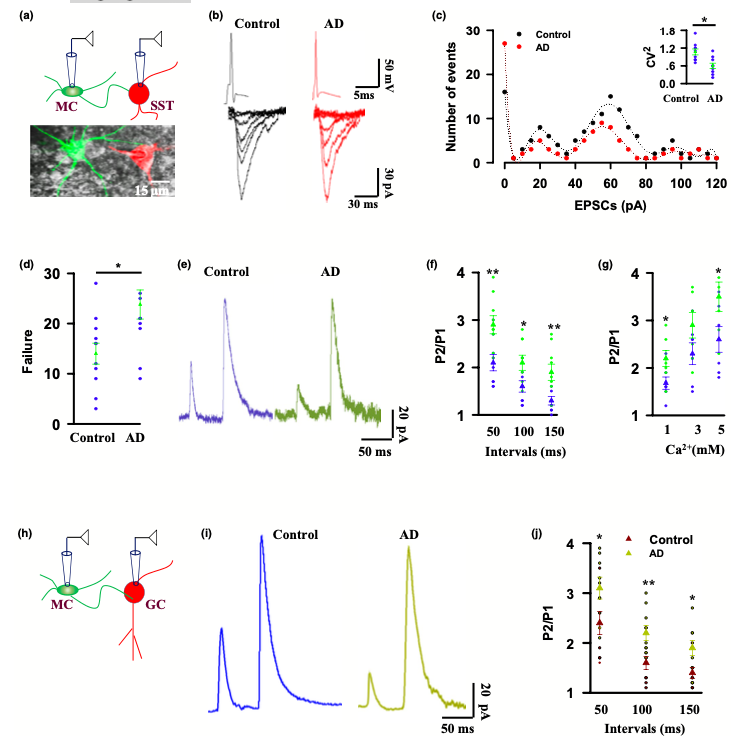
图1. MC细胞的突触功能障碍
(二) 在AD模型小鼠早期,MC的激活可以挽救小鼠记忆的不精确
该团队发现激活MC细胞,可以恢复记忆的精确性,进一步从反面验证AD早期突触变性和记忆不精确之间的因果关联。
(三) 在AD模型小鼠早期,MC的激活可以挽救LTP
LTP指突触传递的长期增强,是学习和记忆的细胞基础。该研究进一步表明AD早期MC和SST细胞之间突触传递的LTP受损,且这种损伤可被逆转。
(四) 在AD模型小鼠早期抑制miR-128可恢复STIM2翻译
为了进一步探讨其内在分子机制,该团队着重关注了突触基因表达的变化。STIM2涉及突触释放神经递质相关Ca2+调节过程,STIM2可检测内质网中Ca2+稳态并参与Ca2+的细胞事件。由此该团队干预了miR-128的表达。在沉默miR-128后,发现可促进STIM2蛋白的表达,从而完全恢复AD小鼠中从MC到SST细胞的突触传递作用。且破坏miR-128与STIM2结合的LNA-STIM2具有相同的作用。
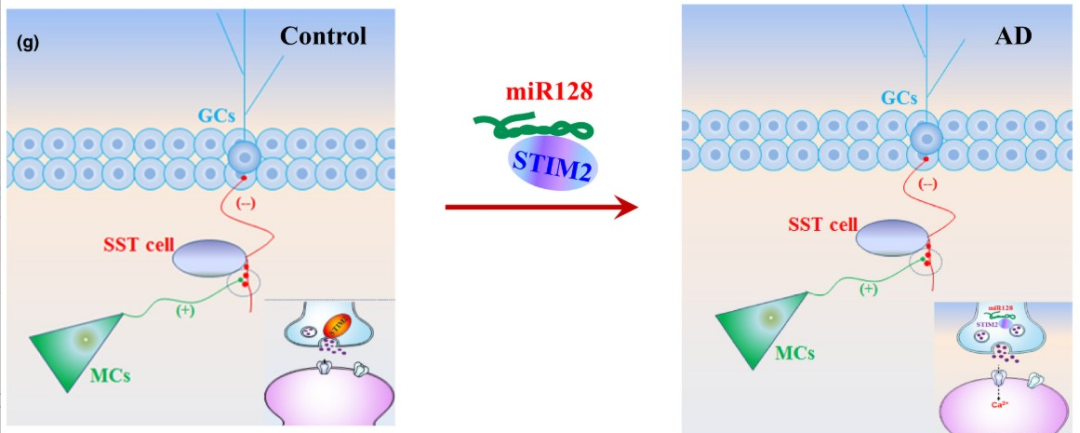
图2. STIM2工作机制图
目前认为AD的特征性改变是:进行性记忆减退,随后丧失广泛的认知功能。长期以来一直认为Aβ的沉积和tau蛋白异常聚集是神经元变性的原因。然而本研究表明记忆丧失最初是由突触功能障碍引起,而非神经元死亡。本研究通过大量行为测试表明:记忆不精确是AD最早的神经系统症状,且此种症状与突触传递功能障碍有关,并进一步确定突触变性的分子机制,为之后AD的干预型治疗提供新的思路。
编译作者:小飞侠 (Brainnews创作团队)
参考文献:
Deng M, Zhang Q, Wu Z, et al. Mossy cell synaptic dysfunction causes memory imprecision via miR-128 inhibition of STIM2 in Alzheimer's disease mouse model [published online ahead of print, 2020 Mar 28]. Aging Cell. 2020;e13144. doi:10.1111/acel.13144
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言