英国批准默沙东新冠口服药物molnupiravir,开创新冠治疗的新时代!
2021-11-04 网络 网络
11月4日,默沙东/Ridgeback宣布英国药品和保健产品监管局(MHRA)已在英国批准molnupiravir (MK-4482, EIDD-2801)上市,用于治疗轻至中度COVID-19成人患
11月4日,默沙东/Ridgeback宣布英国药品和保健产品监管局(MHRA)已在英国批准molnupiravir (MK-4482, EIDD-2801)上市,用于治疗轻至中度COVID-19成人患者。Molnupiravir是全球首个获批用于治疗成人轻度至中度COVID-19的口服抗病毒药物,这些患者经SARS-CoV-2诊断测试呈阳性且至少存在一个发展为严重疾病的风险因素。
另外,在10月11日,也向FDA递交了EUA,将在11月30日左右决定,大概率也会审批通过,见:FDA将召开咨询委员会会议,以讨论默克和Ridgeback的COVID-19口服疗法molnupiravir)。

此次批准主要基于III期MOVe-OUT研究的数据。初次治疗的患者分别服用molnupiravir和安慰剂,molnupiravir治疗组在29天内的住院/死亡比例为7.3%(28/385),安慰剂对照组为14.1%(53/377),p=0.0012。molnupiravir治疗组的住院和死亡风险降低了50%,而且在29天内未见患者死亡报告,安慰剂对照组报告8例患者死亡(见:默沙东治疗新冠肺炎口服特效药Molnupiravir取得良好效果,降低住院或死亡率50%,未来可能是治疗新冠的决定性药物之一)。
安全性方面,Molnupiravir治疗组任何不良事件的发生率与安慰剂组相似(35% vs 40%),药物治疗相关不良事件发生率同样具有可比性(12% vs 11%)。而且Molnupiravir组因为不良事件终止治疗的患者比例更低(1.3% vs 3.4%)。
Molnupiravir (MK-4482/EIDD-2801)是埃默里大学下属的非营利组织DRIVE(Drug Innovations at Emory )发现的一款核苷类似物,抑制SARS-CoV-2复制的活性比瑞德西韦高3-10倍,在多个临床前的SARS-CoV-2病毒感染预防、治疗和预防传播模型中均显示了活性。
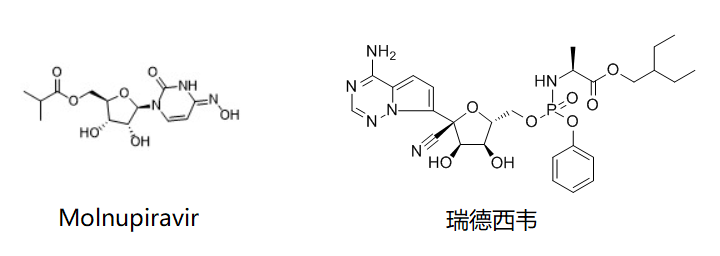
Molnupiravir目前由默沙东和Ridgeback公司共同开发,Ridgeback从默沙东获得了首付款,未来还将基于临床开发和注册进展获得里程金。两家公司未来将平分药物销售后的利润。
今年6月9日,默沙东曾与美国政府签订了一项采购协议,一旦获得FDA的紧急使用授权或者正式批准,将向美国政府提供170万疗程的molnupiravir药物。默沙东同时也已经与全球其他政府签订了关于molnupiravir的采购供货协议,目前正与更多的政府沟通之中。
默沙东承诺,如果Molnupiravir获得紧急使用授权或上市批准,将及时在全球范围内供应Molnupiravir,并计划根据世界银行的国家收入标准实行分级定价方法,以反映各个国家或地区为应对这场大流行病向公共卫生提供资金的相对能力。
作为其承诺将广泛向全球供应的一部份,默沙东此前宣布,公司已经与成熟的仿制药制造商签订了Molnupiravir的非独家自愿许可协议,以便在100多个中低收入国家(LMIC)获得上市批准或紧急使用授权后加快Molnupiravir的供应。
接下来令人关注便是辉瑞PF-07321332和日本盐野义s217622,而罗氏及其合作伙伴Atea开发的AT-527已经失败。详细见:全球五大口服治疗新冠病毒感染药物研发进展,未来是抗新冠病毒主要力量
当然,中国开拓药业的普克鲁胺的作用仍然存在争议,也需要等待3期临床研究的结果;另外,另一款抗乙肝的新药乐复能也3期临床试验中,出显示出降低重症和死亡58%的良好效果(见:乐复能治疗重症新冠肺炎III期临床试验数据公布,降低重症病人的呼吸衰竭和死亡率58.3%),同样也值得关注,只是乐复能通过雾化吸入给药,相对而言,没有口服药方便。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#口服药物#
96
#口服药#
77
#默沙东#
0
#创新#
86
#新时代#
92
👍
95
真不错
100
默里大学下属的非营利组织DRIVE(Drug
99