Neuron:再取进展!中国科学院严军团队揭示调控昼夜节律稳定性的神经机制
2023-05-15 iNature iNature 发表于四川省
该研究结果表明SCN CCK神经元对哺乳动物生物钟的稳健性和可塑性至关重要。
哺乳动物视交叉上核(Suprachiasmatic Nucleus,SCN)可以在不同环境下产生强大的昼夜行为,但其潜在的神经机制尚不清楚。
2023年5月11日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)严军研究组题在Neuron 在线发表了题为“Cholecystokinin neurons in mouse suprachiasmatic nucleus regulate the robustness of circadian clock”的研究论文,该研究发现小鼠SCN中胆囊收缩素(CCK)神经元的活动先于不同光周期下行为活动的发生。CCK神经元缺陷小鼠表现出自由奔跑时间缩短,在恒定光下出现快速分裂或心律失常。
与血管活性肠多肽(VIP)神经元不同,CCK神经元并不直接对光敏感,但它们的激活可以引发由VIP神经元介导的相提前和对光诱导的相延迟。在长光周期下,CCK神经元对SCN的影响大于VIP神经元。最后,该研究发现慢反应的CCK神经元控制着时差期间的恢复速度。总之,该研究结果表明SCN CCK神经元对哺乳动物生物钟的稳健性和可塑性至关重要。
另外,2020年2月17日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)严军研究组题在Nature Neuroscience 在线发表题为“Spatiotemporal single-cell analysis of gene expression in the mouse suprachiasmatic nucleus”的研究论文,通过单细胞测序技术对小鼠昼夜节律中枢——视交叉上核进行了系统性的细胞分型,发现了新的神经元亚型,揭示了这些细胞亚型的基因表达在昼夜节律过程中和光照刺激下的差异,同时在单细胞水平完整重构了各亚型细胞的三维空间分布,为研究哺乳动物昼夜节律的神经机制奠定了重要的基础。

内源性昼夜节律钟驱动着各种生物中广泛的生理过程和行为的日常振荡。在分子水平上,昼夜节律是由哺乳动物的Per1/2/3、Cry1/2、Bmal1和CLOCK等核心时钟基因组成的负转录-翻译反馈回路产生的。尽管大多数个体细胞都拥有生物钟,但动物的显性昼夜节律活动受到外部环境线索的影响。光被认为是影响昼夜节律的最重要的环境因素。生物钟被24小时的明暗循环所束缚,但在环境的季节性变化下继续发挥作用。因此,生物钟的稳健性和可塑性对动物的生存至关重要。大多数动物的昼夜活动呈双峰分布,分别在黎明和黄昏时出现两个活动回合。
昼夜节律行为的季节适应性表现为长、短光周期下这两个活动周期的调整。在长时间的恒光(LL)下,动物活动可以逐渐分裂为两个自由运行的部分。基于这些观察,Pittendrigh和Daan提出了两个独立但耦合的振荡,即晚上(E)和早晨(M)振荡,分别控制这两个活动回合。然而,目前尚不清楚是简单的E和M振荡子还是耦合振荡子网络驱动了哺乳动物的E和M昼夜节律行为并控制了季节性可塑性。
视交叉上核(SCN)由约20000个细胞组成,被认为是哺乳动物的主昼夜节律起搏器。光信息从内在光敏视网膜神经节细胞(ipRGCs)进入SCN,并且SCN内的细胞间耦合对于产生同步振荡以控制下游行为至关重要。以往对SCN的研究主要集中在神经肽释放神经元上,包括位于SCN腹侧和核心区的血管活性肠多肽(VIP)和胃泌素释放肽(GRP)神经元,以及位于SCN背壳区的精氨酸加压素(AVP)神经元。这表明VIP神经元接受直接视网膜输入,在光携带通路的相位重置和细胞生物钟同步中起重要作用,而AVP神经元也被证明在SCN网络内的细胞间偶联中起重要作用。
据报道,神经肽转换有助于哺乳动物的光周期。同时,神经递质GABA与SCN的季节性可塑性有关。由于几乎所有的SCN神经元都具有GABA,因此尚不清楚SCN神经元的哪些亚型参与了生物钟的季节性可塑性。在先前对大脑切片上的SCN的研究中,位于不同SCN亚区的神经元的Per2荧光素酶表达已被证明在不同的阶段振荡。长日光周期和光照可增加SCN神经元的相色散,减弱细胞间的偶联。然而,这些差异相细胞的身份和潜在的机制仍然未知。到目前为止,CCK神经元在SCN中的昼夜节律功能尚不清楚。
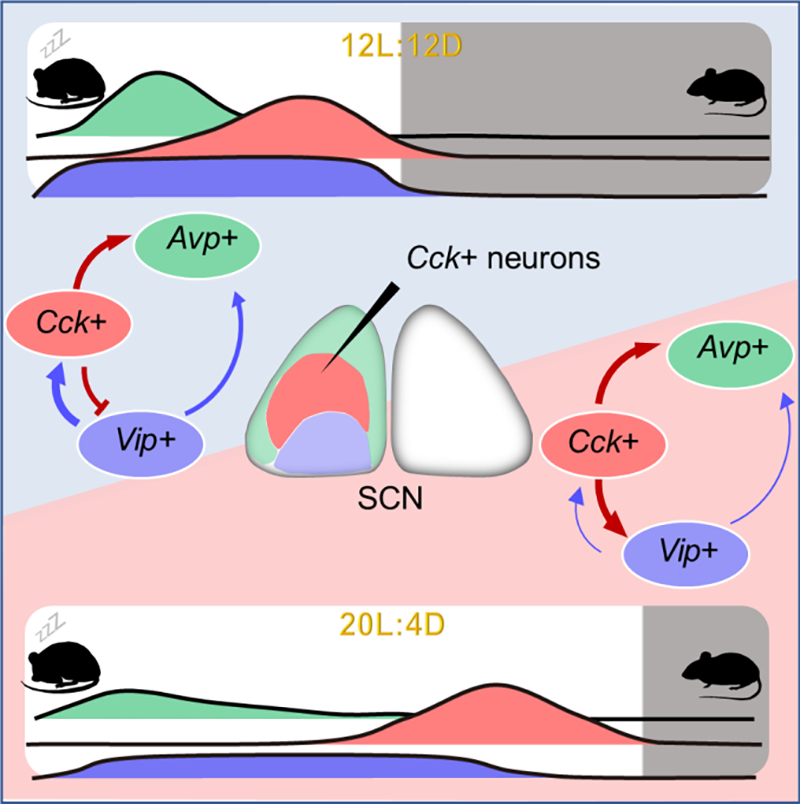
CCK神经元调节哺乳动物昼夜节律机理示意图(图源自Neuron )
该研究通过对自由活动动物体内钙活性和行为活动的监测,发现不同光周期下,SCN中的CCK神经元的钙活性在活动开始前达到峰值,而VIP神经元的钙活性在长日光周期下则均匀分布在整个光相。LL作用下,CCK神经元钙离子活性保持振荡状态,VIP神经元钙离子活性失去节律性。该研究发现CCK神经元缺乏导致自由运行周期缩短,昼夜节律行为不稳定,特别是在长日照和光照条件下。
该研究发现尽管CCK神经元不直接对光敏感,但CCK神经元的激活可以使生物钟提前,抵消光的延迟效应,从而稳定长时间光周期下的生物钟。在长日照条件下,VIP神经元对SCN网络的影响明显减弱,而CCK神经元对SCN网络的影响增强。最后,该研究发现CCK神经元活动对明暗周期突变的反应明显慢于VIP神经元,抑制CCK神经元可以显著缩短时差反应的恢复时间。总之,该研究发现SCN中的CCK神经元赋予小鼠生物钟所需的稳健性和可塑性。
该研究在中科院脑智卓越中心严军研究员的指导下,由脑智卓越中心的谢路成博士、熊洋洋博士和马丹宜博士共同完成,并得到了严军研究组陈玖、施凯雯以及复旦大学附属中山医院神经外科杨乔乔博士的帮助。该工作获得科技部、基金委、中科院、上海市等项目的资助。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(23)00301-X
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言