Haematologica:朗妥昔单抗(Loncastuximab tesirine)治疗复发/难治性弥漫性大B细胞淋巴瘤:2期LOTIS-2研究的长期疗效和安全性
2023-09-03 daikun MedSci原创 发表于上海
该研究旨在评估朗妥昔单抗(Loncastuximab tesirine)治疗复发/难治性弥漫性大B细胞淋巴瘤的疗效和安全性,朗妥昔单抗继续在CR患者中表现出持久的长期反应,具有可控的安全性和耐受性。
在新诊断的弥漫性大B细胞淋巴瘤(DLBCL)中,一线治疗对大约60%的患者具有潜在的疗效。此外,发现初次一线免疫化疗后24个月内无事件生存(定义为无疾病进展,复发,新抗癌治疗或死亡)的新诊断DLBCL患者的总生存期(OS)与年龄和性别匹配的普通人群相当,提示长期反应可能表明DLBCL患者的积极结果。然而,高达40%的患者对干细胞移植(SCT)或嵌合抗原受体T细胞(CAR-T)治疗后复发/难治性(R/R)DLBCL的一线治疗或复发患者无反应或对二线治疗难治的患者预后不良,治疗选择有限。虽然R/R DLBCL的治疗选择数量正在增加,但并非所有患者都有资格,能够轻松获得或能够耐受许多这些疗法。仍然需要具有可控安全性和耐受性的有效且可获得的疗法,这已经证明了R/R DLBCL长期疾病控制的潜力。
朗妥昔单抗Loncastuximab tesirine(Loncastuximab tesirine lpyl[Lonca])是一种抗体-药物偶联物,包含人源化抗CD19单克隆抗体,该抗体通过可切割接头与有效的吡咯苯并二氮杂卓(PBD)二聚体烷基化细胞毒素SG3199偶联。与CD19抗原结合后,Lonca被内化,接头被切割,PBD二聚体迅速释放。PBD二聚体在DNA小沟中形成持续的DNA交联,导致肿瘤细胞凋亡。2021年4月,Lonca获得美国食药品监督管理局的加速批准,作为治疗成人R/R大B细胞淋巴瘤患者的单一药物,经过两种或两种以上的全身治疗,包括未另外指定的DLBCL,DLBCL来自低度淋巴瘤和高度B细胞淋巴瘤(HGBCL)
在关键的2期LOTIS-2研究(数据截止日期:2020年4月6日;中位随访时间:7.3个月[范围0.3-20.2])的初步分析中,Lonca表现出单药抗肿瘤活性,并且在经过严重预处理的R/R DLBCL患者中具有可接受的安全性,总有效率(ORR)为48.3%,完全缓解(CR)率为24.1%。在先前提出的随访分析中(数据截止日期:2021年3月1日;中位随访时间:7.8个月[范围0.3-31.0]),ORR与初步分析相同,一名部分缓解(PR)的患者转换为CR,最终CR率为24.8%。观察到对Lonca的持久反应,中位缓解时间(DOR)为13.4个月,未达到CR患者的中位DOR;没有检测到新的安全信号。
在这里,介绍了在2期LOTIS-2研究中用Lonca治疗的R/R DLBCL患者的最新长期疗效和安全性数据,包括对持久性CRs患者亚组的分析。

方法:该研究对所有患者和完全缓解(CR)患者的亚组进行分析,包括无事件(无进展性疾病或死亡)的CR患者≥1年和≥2年,从第1周期,治疗的第1天开始。Lonca每3周给药一次(2个周期为0.15 mg/kg;后续周期为0.075 mg/kg)。
研究结果:截至最终数据截止日期(2022年9月15日;中位随访时间:7.8个月[范围0.3-42.6]),145名患者中有70名(48.3%)获得了总体缓解。36例(24.8%)患者达到CR,其中16例(44%)和11例(31%)分别无事件≥1年和≥2年。在所有治疗人群中,中位总生存期为9.5个月;中位无进展生存期为4.9个月。在CR患者中,未达到中位总生存期和无进展生存期,24个月总生存率和无进展生存率分别为68.2%(95%CI:50.0-81.0)和72.5%(95%CI:48.2-86.8)。
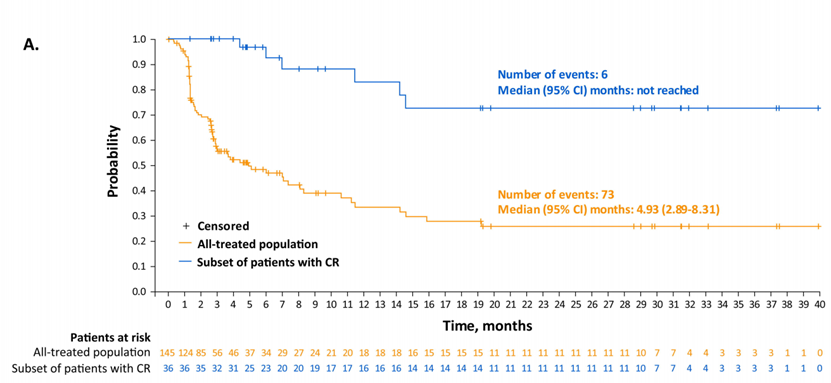
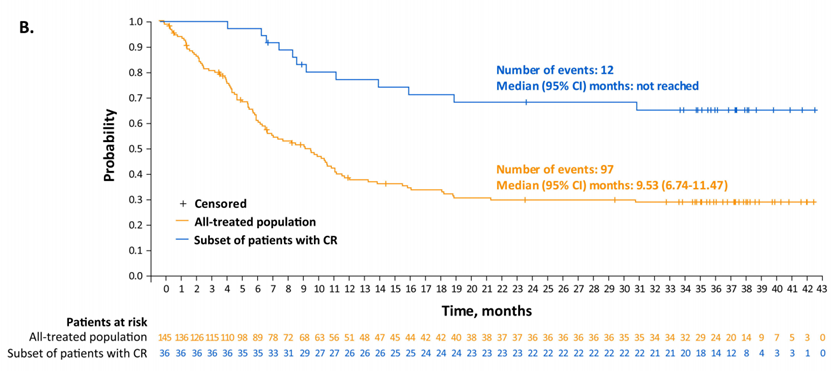
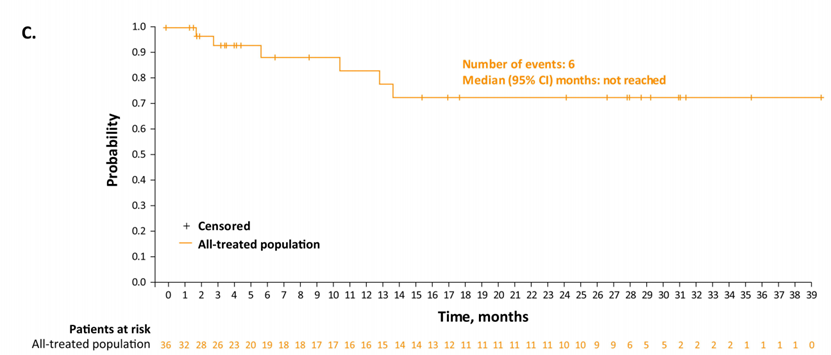
结论:没有发现新的安全问题。随着进一步的随访,Lonca继续在CR患者中表现出持久的长期反应,具有可控的安全性和耐受性。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言