Cancer Res:刘明耀课题组在GPCR介导的免疫微环境调控中取得重要进展
2018-07-08 BioArt BioArt
免疫疗法是近年来兴起的对抗恶性肿瘤的变革性手段,在多种肿瘤的临床治疗中初步显现令人振奋的效果。然而,对于目前的大多数免疫疗法,其临床响应率还停留在20%左右的低水平。尤其是在实体瘤的治疗中,包括免疫检查点(Immune checkpoint)阻断疗法和嵌合抗原受体T细胞技术(chimeric antigen receptor T cell, CART)疗法在内的免疫治疗手段仍然存在不小的局限性。
免疫疗法是近年来兴起的对抗恶性肿瘤的变革性手段,在多种肿瘤的临床治疗中初步显现令人振奋的效果。然而,对于目前的大多数免疫疗法,其临床响应率还停留在20%左右的低水平。尤其是在实体瘤的治疗中,包括免疫检查点(Immune checkpoint)阻断疗法和嵌合抗原受体T细胞技术(chimeric antigen receptor T cell, CART)疗法在内的免疫治疗手段仍然存在不小的局限性。
目前肿瘤免疫疗法最主要的局限性体现在难以逾越肿瘤微环境的免疫抑制障碍。肿瘤微环境中存在PD-L1等T细胞抑制信号的大量表达,伴随局部氧及营养成分缺乏的恶劣环境,往往使肿瘤特异性效应T细胞表现出功能耗竭和浸润减少的现象;最重要的是,抑制性细胞如调节性T细胞(Treg)、髓系来源抑制细胞(MDSC)、M2型巨噬细胞以及IL-10、TGF-β等免疫抑制分子在肿瘤微环境中发挥着强烈而独特的免疫抑制作用。此外,复杂的免疫细胞互作网络也使肿瘤微环境成为限制免疫疗法效果发挥的一道坚硬壁垒。探究对肿瘤微环境具有调节或重塑作用的活性分子并揭示其作用机制,以此为基础开发新型的肿瘤免疫疗法已成为近年来肿瘤免疫领域的重要关注点和关键突破方向。
7月2日,Cancer Research在线发表了华东师范大学刘明耀教授团队在肿瘤免疫方向的题为Inhibition of Rspo-Lgr4 facilitates checkpoint blockade therapy by switching macrophage polarization的研究成果,首次揭示G蛋白偶联受体(GPCR)家族成员Lgr4在肿瘤免疫调节中的关键作用,提出并验证了以Lgr4为作用靶点的肿瘤免疫治疗策略。该工作的一大亮点是创造性地将Lgr4阻断剂与PD-1抗体联用,在小鼠LLC肺癌和B16F10黑色素瘤模型中取得了让人欣喜的治疗效果。
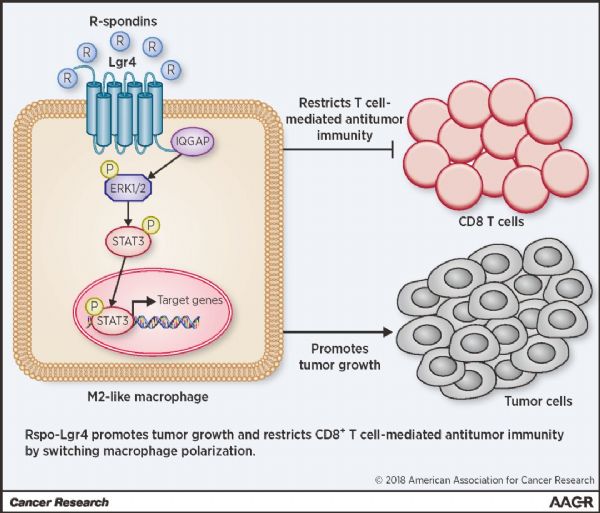
Lgr4是富含亮氨酸基序的GPCR家族成员(Leucine-rich repeat containing G protein-coupled receptor 4, Lgr4),与属于同一家族的Lgr5和Lgr6一起,多年来被认为是通过结合R-spondin分泌蛋白,促进和放大经典的wnt/β-catenin 信号通路,广泛在个体和器官发育乃至肿瘤细胞转移方面发挥重要调控作用。Lgr4调控范围之广,作用之强,长久以来一直吸引着众多领域内学者的浓厚兴趣,围绕Lgr4的生理病理调控作用也已经发表过不少重量级的工作,然而关于Lgr4对于免疫系统的调控作用仍是个未解之谜。
作为长期以来专注于GPCR信号转导研究与新药研发工作的学者,刘明耀教授团队多年来持续在Lgr4的功能和应用研究中开展着出色的工作。近年来极具代表性的发现是首次揭示Lgr4作为RANKL蛋白的受体在哺乳动物的噬骨/成骨平衡过程中发挥关键作用,以此为基础开发了基于Lgr4受体封闭的骨质疏松治疗手段,该研究成果已于2016年发表在Nature medicine杂志上。而在较早之前的一项研究当中,刘明耀教授团队就发现Lgr4可以通过cAMP/PKA/CREB信号通路调控固有免疫系统中TLR2/4介导的模式识别功能。在上述两项工作中,研究的对象都指向了同一类型的细胞—巨噬细胞(破骨细胞实为骨骼中寄居的巨噬细胞)。而巨噬细胞作为肿瘤组织中浸润程度较高的免疫细胞,具备高度的异质性和可塑性,已被证明与肿瘤血管新生、上皮间质转换(EMT)、肿瘤细胞远端转移、T细胞功能抑制密切相关。因此,该团队成员提出了假设:Lgr4可通过调控肿瘤相关巨噬细胞的功能进而在肿瘤微环境的重塑和抗肿瘤免疫应答中发挥重要作用。
基于上述假设,团队成员首先在Lgr4敲除的骨髓来源巨噬细胞中证明Lgr4是维持巨噬细胞经典激活(M1,促炎型)和替代激活(M2型,抑炎型)两种功能极化状态的“稳定器”,Lgr4的敲除引起巨噬细胞中M2相关基因的表达下调,与此同时,M1相关基因表达上调,巨噬细胞表现为强烈的促炎表型。
鉴于巨噬细胞功能性极化与肿瘤发生的密切关系,作者在Lgr4条件敲除(巨噬细胞特异性)的小鼠中分别建立了诱变剂诱发和皮下移植的肺癌模型,发现随着Lgr4在巨噬细胞中表达的消失,小鼠中肿瘤的生长被强烈地抑制,且存活时间也得到显着延长;并且在Lgr4条件敲除小鼠的肿瘤组织中发现存在大量M1型巨噬细胞和活化的CD8+ T细胞浸润。而在另外建立的小鼠B16F10黑色素瘤模型中也发现了非常一致的现象。这就证实了Lgr4的存在有利于M2型肿瘤相关巨噬细胞功能和表型的维持,并且这种调控作用对于获得性免疫系统中CD8+ T细胞的募集以及肿瘤微环境的维持是至关重要的。进一步地,作者们证实了Lgr4是通过激活ERK/STAT3信号通路这一作用机制而发挥对巨噬细胞M2方向分化的正调控作用。
为了进一步探索Lgr4与巨噬细胞表型调控在肿瘤治疗中的应用潜力,课题组成员通过皮下给药的方式将Lgr4的胞外段蛋白以及Rspondin1(Lgr4配体)抗体注射到荷瘤小鼠体内,发现Lgr4胞外段蛋白和Rspondin1(Lgr4配体)抗体均能显着抑制了鼠LLC肺癌以及B16F10黑色素瘤的生长;并显着提高肿瘤微环境中M1型巨噬细胞的比例以及CD8+ T细胞的浸润和激活水平,证明Lgr4的阻断有效改变了肿瘤微环境的细胞构成,抑制肿瘤的发生发展。
在此基础上,研究者们使用Lgr4阻断剂与临床上已经成功应用的PD-1抗体联用,分别对LLC和B16F10肿瘤模型小鼠进行单药和联药治疗实验。有意思的是,对于LLC肺癌模型,单独使用PD-1抗体的疗效非常有限,而一旦与Lgr4胞外段蛋白联用,则表现出显着的肿瘤抑制效果;而在B16F10黑色素瘤模型中,Lgr4胞外段蛋白也显着促进了PD-1抗体的治疗效果;进一步的肿瘤内分析也显示Lgr4阻断剂与PD-1抗体联用明显促进了抗肿瘤免疫细胞的浸润,甚至使原先属于“冷”肿瘤的LLC肺癌变为“热”肿瘤,增强了其对免疫检查点抑制剂治疗的敏感性。
综上所述,刘明耀教授团队的发现揭示了G蛋白偶联受体Lgr4在肿瘤免疫及肿瘤微环境调节中的作用机制,扩展了人们对Lgr4生理功能调控作用的认识,同时为当前炙手可热的肿瘤免疫疗法提供了又一行之有效的作用靶点和治疗策略。未来联合嵌合抗原受体T细胞技术和基因编辑技术,该研究成果将具备巨大的临床转化应用潜力。据悉,刘明耀教授团队已就该发现完成了相关的专利申请。
原始出处:
Tan B, Shi X, Zhang J,et al.Inhibition of Rspo-Lgr4 facilitates checkpoint blockade therapy by switching macrophage polarization.Cancer Res. 2018 Jul 2. pii: canres.0152.2018. doi: 10.1158/0008-5472.CAN-18-0152. [Epub ahead of print]
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#重要进展#
75
#GPCR#
105
#PCR#
60