超10款有望“治愈”肿瘤疫苗已在路上,或开创癌症治疗新时代
2024-12-22 梅斯肿瘤新前沿 MedSci原创 发表于陕西省
下面小编就结合全球肿瘤疫苗的研发管线,盘点一下研发进度相对靠前的部分肿瘤疫苗。
近年来,全球肿瘤疫苗的研发领域迎来了前所未有的发展浪潮。随着科技的飞速进步,特别是随着人工智能、mRNA疫苗技术的崛起,肿瘤疫苗作为癌症预防与治疗的新兴手段,正逐步从实验室走向临床应用,为全球癌症患者带来了新的希望。下面小编就结合全球肿瘤疫苗的研发管线,盘点一下研发进度相对靠前的部分肿瘤疫苗。值得注意的是,树突状细胞DC疫苗DCVax-L三期已经成功,mRNA疫苗mRNA-4157已经启动三期临床,有望在2025年上市。
DCVax-L:树突状细胞(DC)疫苗
该候选疗法是一种个性化的免疫疗法,由患者自身肿瘤样本中的树突细胞和抗原(生物标记物)制成。
适应症:胶质母细胞瘤
临床进展:三期结果达到积极顶线结果
三期结果显示:新诊断的GBM患者(n=232)随机化后的中位总生存期(mOS)为19.3个月(手术后22.4个月),而对照组随机化后的mOS为16.5个月(HR=0.80, p=0.002);48个月生存率为15.7% vs. 9.9%, 60个月生存率为13% vs. 5.7%。
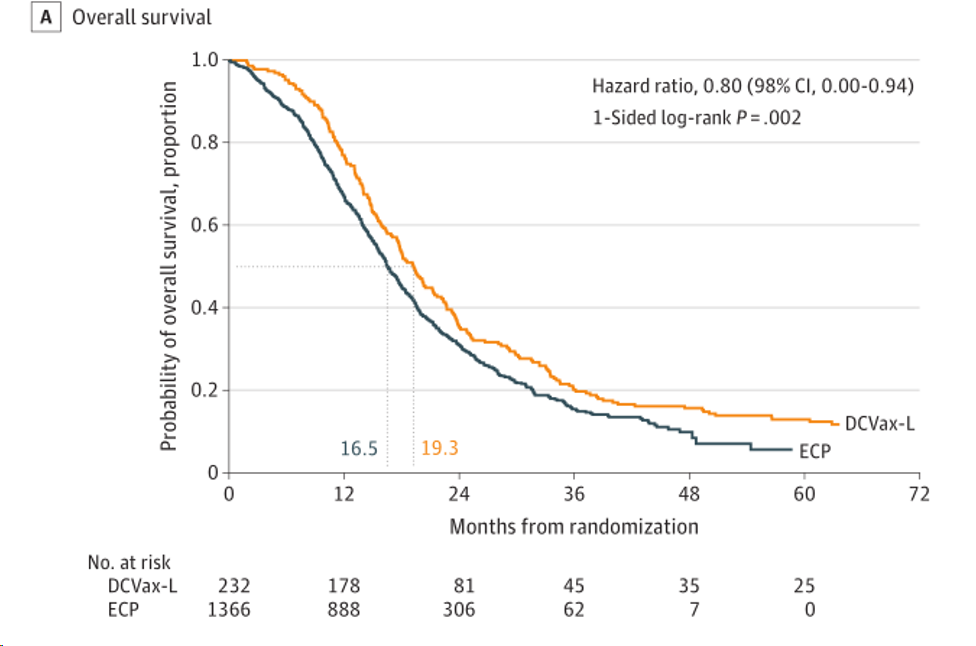
新诊断胶质母细胞瘤患者的总生存率
复发性GBM (n=64)的mOS为复发后13.2个月vs. 7.8个月(HR = 0.58, p<0.001);复发后24个月和30个月生存率分别为20.7% vs.9.6%,11.1% vs.5.1%。
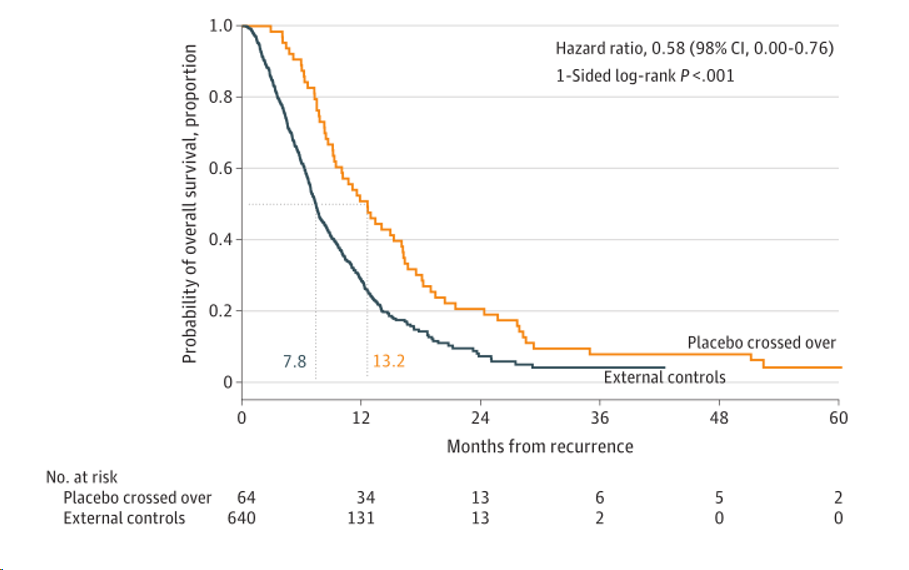
复发胶质母细胞瘤患者的总生存率
在新诊断的伴有MGMT甲基化的GBM患者中,使用DCVax-L治疗的mOS为30.2个月(手术后33个月),而对照组为21.3个月(n=199) (HR=0.74, p=0.027)。
目前国内DC疫苗领域也取得了重大的突破,恒瑞源正研发的MASCT-I已经进入临床Ⅱ期,启辰生生物、康德赛医疗、立康生命、中生康元及恒赛生物等公司的DC候选药物也已经步入了一期临床,其中多款候选药物并展现出了良好的早期疗效。
PDS0101:HPV阳性癌症疫苗
简介:PDS0101是一种针对人乳头瘤病毒(HPV)的新型研究性免疫疗法,专为HPV阳性癌症设计。通过强烈刺激T细胞攻击,该疫苗展现出显著的抗癌潜力。可与其他免疫疗法和癌症治疗联合使用,以增强治疗效果。
临床进展:2期临床
在2024年欧洲肿瘤内科学会(ESMO)大会上发布的研究显示,癌症疫苗PDS0101联合PD-1免疫药物K药,显著提高了HPV16阳性的复发或转移性头颈鳞状细胞癌(HNSCC)患者的治疗效果。在53名PD-L1阳性(指标预示免疫治疗可能有效)的患者中,接受新型HPV疫苗PDS0101联合K药治疗的患者,平均生存时间为30个月。
Bria-IMT:乳腺癌联合免疫治疗方案
简介:Bria-IMT 方案是使用同种异体全肿瘤细胞疫苗联合检查点抑制剂 (checkpoint inhibitors, CPIs) 的联合免疫治疗。皮内给予经辐照的 SV-BR-1-GM 乳腺癌细胞能够分泌GM-CSF,并通过HLA-I和HLA-II分子提呈肿瘤相关抗原(TAAs),从而直接激活抗肿瘤免疫反应。
作用机制:间接和直接刺激人体自身的抗癌细胞,包括激活CD4+和CD8+ T细胞,增强抗肿瘤免疫反应。
临床进展:3期
1/2期临床试验显示,BRIA-IMT 治疗显示出较好的安全性,同时使得多药治疗无效的进展/转移性乳腺癌患者获益。研究者在接受3期制剂患者中观察到更好的疗效和生存率。该制剂已应用于正在进行中的3期临床试验,
BNT116:非小细胞肺癌mRNA免疫疗法
简介:BNT116是由BioNTech公司开发的基于mRNA技术的癌症疫苗,专用于治疗非小细胞肺癌(NSCLC)。
工作原理:通过编码NSCLC细胞经常表达的抗原,触发免疫反应,激活免疫系统识别和攻击癌细胞。
临床进展:1/2期试验正在进行中
2023 年公布的一项针对该疫苗用于 NSCLC 治疗的 I 期试验结果发现,89% 既往接受过 3 种以上的治疗 18 例 NSCLC 患者接受 BNT116 治疗后,6 例患者达到疾病稳定(SD),中位疾病控制时间为 1.53 个月。
ELI-002 7P:KRAS突变型癌症肽疫苗
简介:ELI-002 7P是由Elicio Therapeutics开发的治疗性癌症疫苗,旨在刺激针对七种最常见的KRAS突变的免疫应答。
给药方式:利用专有AMP平台,有效传递到淋巴结。
临床进展:2期试验
1期试验显示,该疫苗具有良好的耐受性,显著降低了肿瘤生物标志物,引发了强烈的T细胞反应,减少了患者的复发和死亡风险,。
BNT111:现货型、表达黑色素瘤相关抗原的mRNA癌症疫苗
临床进展:一项随机2期临床试验正在进行中,以评估其与cemiplimab联合治疗对PD1/PD-L1抑制剂耐药/复发、不可切除的III或IV期黑色素瘤患者的效果。
BNT122:个性化mRNA疫苗
简介:BNT122是由BioNTech和基因泰克联合开发的个性化mRNA癌症疫苗
给药方式:通过mRNA表达患者肿瘤中的新抗原,使用脂质纳米颗粒(LNP)静脉注射给药。
临床进展:临床试验显示,该疫苗能够激活并持续刺激患者体内的T细胞,降低癌症复发风险。目前正在进行多项2期临床试验,包括评估其在高风险肌层浸润性尿路上皮癌、切除后的胰腺导管腺癌、结直肠癌和一线晚期黑色素瘤中的疗效。
BNT123:编码HPV16抗原mRNA疫苗
临床进展:目前正在全球范围内进行一项随机2期临床试验,以评估其与PD1抑制剂pembrolizumab联合治疗PD-L1+、HPV16+头颈部鳞状细胞癌的疗效。
mRNA-4157(V940):高危黑色素瘤的个性化mRNA疫苗
简介:mRNA-4157(V940)是由Moderna和默沙东联合开发的个性化mRNA癌症疫苗,专为高危黑色素瘤患者设计。
疫苗设计:包含编码多达34种新抗原的单一合成mRNA分子,根据每位患者肿瘤独特的DNA序列突变特征设计而成。
联合疗法:与PD-1抑制剂帕博利珠单抗联合使用,进一步提高患者免疫系统的能力。
临床进展:三期临床(全球进展最快的mRNA疫苗之一)
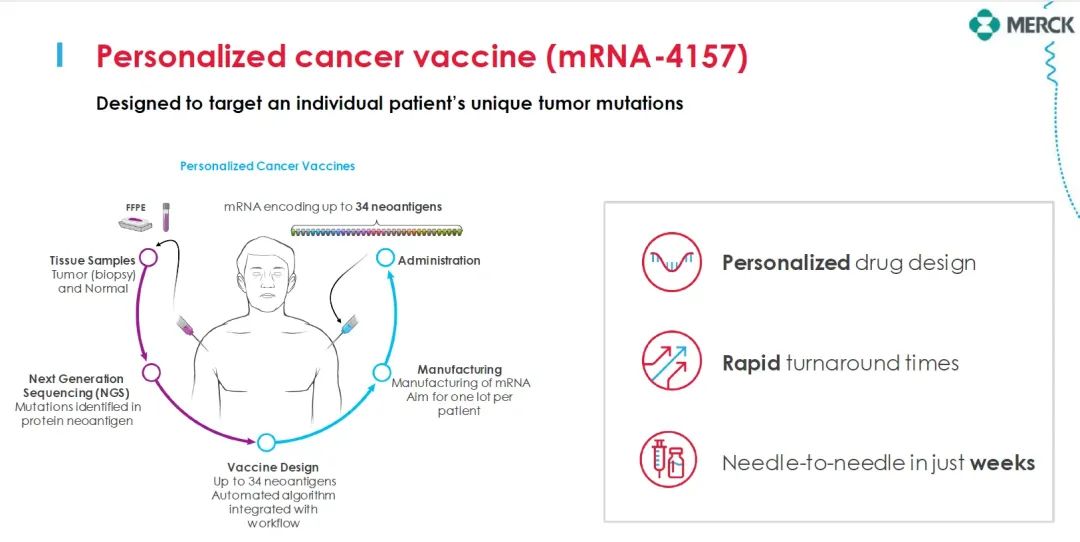
1/2期临床结果显示,在中位随访期34.9个月中,与Keytruda单药相比,mRNA-4157与Keytruda联合治疗可使患者的复发或死亡风险降低49%,远处转移或死亡风险降低62%。获得美国FDA突破性疗法认定,有望成为首款上市的mRNA肿瘤疫苗,最早或将于2025年问世!
SCIB1:黑色素瘤质粒DNA疫苗
简介:SCIB1是由Scancell ImmunoBody公司开发的基于质粒DNA的癌症疫苗,专用于治疗黑色素瘤。
疫苗设计:编码来自黑色素瘤抗原酪氨酸酶相关蛋白-2(TRP-2)和糖蛋白100(GP100)的CD8和CD4表位。
独特之处:靶向树突状细胞,引起更广泛的免疫作用来抗击肿瘤。
临床进展:1/2期。
最新公布的数据显示,SCIB1联合双免疫疗法Opdivo+Yervoy的一线治疗在晚期不可切除黑色素瘤患者(n=13)中的总反应率(ORR)达到85%。
VBI-1901:复发性胶质母细胞瘤的病毒样颗粒疫苗
简介:VBI-1901是由VBI Vaccines Inc.开发的创新癌症疫苗免疫疗法,专门针对复发性胶质母细胞瘤(GBM)。
疫苗设计:利用包膜病毒样颗粒(eVLP)技术,靶向两种高度免疫原性的巨细胞病毒(CMV)抗原。
临床进展:2b期数据显示,该疫苗将GBM患者中位总生存期延长了5个月(疫苗组12.9:对照组8个月),疾病控制率更是从0跃升至40%。这一突破性成果使FDA授予其快速通道指定和孤儿药资格。
DOC1021:胶质母细胞瘤的树突细胞疫苗
简介:DOC1021是由Diakonos Oncology开发的树突细胞疫苗,用于治疗胶质母细胞瘤(GBM)。
疫苗设计:通过模仿病毒感染患者的癌症标志物,利用人体发现和杀死受感染细胞的能力。
独特之处:采用“双重加载”技术,刺激新型病毒识别和反应途径。
临床进展:临床试验正在进行中,评估其疗效和安全性。
GNOS-PV02:晚期肝细胞癌的DNA新抗原疫苗
简介:GNOS-PV02是由Genexine公司开发的个性化DNA新抗原疫苗,用于治疗晚期肝细胞癌(HCC)。
疫苗设计:包含一个DNA质粒,编码多达40个从患者肿瘤样本中确定的新抗原。
给药方式:与编码细胞因子白介素-12(IL-12)的DNA质粒共配方,通过皮内注射和体内电穿孔给药。
临床进展:1/2期临床试验结果显示,该试验达到了安全性和免疫原性的主要终点,以及基于缓解率的疗效次要终点。在36名晚期肝癌患者中,有11名(30.6%)对该疫苗与KY药联合疗法产生缓解,这大约是过去对照药物缓解率的两倍。其中3例患者达到了CR,8例患者达到了部分缓解(PR)。数据截止时,患者的mOS为19.9个月。

▲GNOS-PV02治疗晚期肝癌患者的临床结果
Galinpepimut-S:WT1靶向的癌症疫苗
简介:Galinpepimut-S(GPS)是由SELLAS Life Sciences Group开发的靶向WT1(Wilms肿瘤蛋白)的癌症疫苗。
疫苗设计:由4条多肽链构成,抗原表位多达25个,能够激发自身免疫系统对WT1抗原产生强烈的免疫反应。
临床进展:1期临床新数据显示,该试验达到了安全性和疗效的主要终点,Galinpepimut-S(GPS)联用纳武利尤单抗治疗恶性胸膜间皮瘤,患者的中位总生存期(OS)约为接受标准治疗的患者的2.5倍。接受联合疗法的患者的中位OS为70.3周,而接受标准治疗的复发/难治性患者的中位OS约为28周。对GPS没有免疫反应的患者的中位OS为9.0个月,对GPS有免疫反应的患者的中位OS为27.8个月。
结语
展望未来,全球肿瘤疫苗的研发之路虽然充满挑战,但随着各国科研人员的共同努力、新技术的不断涌现以及国际合作的不断深化,我们有理由相信,肿瘤疫苗将在癌症治疗中发挥越来越重要的作用,为全球癌症患者带来更加精准、高效的治疗方案。这一领域的持续进步,不仅将推动医学科学的发展,更将为人类健康事业作出重要贡献。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#肿瘤疫苗# #癌症治疗#
6