NAR:南开大学吕鑫屹团队发现Dot1l与Npm1协同抑制胚胎干细胞内源性逆转录病毒MERVL
2023-08-11 医药加学习班 医药加学习班 发表于上海
该论文证实了Dot1l通过其AT-hook结构域与组蛋白伴侣Npm1相互作用,且Dot1l与Npm1共同定位在MERVL上,并通过组蛋白H1及其变体抑制mESCs中的MERVL和2CLC状态。
内源性逆转录病毒(endogenous retrovirus, ERV)是一类含有LTR的转座元件,存在于多种生物的基因组中。长期以来,ERV被认为是没有功能的“垃圾DNA”,但随着研究的深入,人们逐渐认识到ERV在调控基因表达、维持基因组稳定性以及促进基因组进化等方面发挥的重要作用。在胚胎发育过程中,ERV的表达受到精准调控,例如在小鼠胚胎2细胞阶段,ERV3家族的MERVL呈动态高表达,因此MERVL也被认为是2细胞胚胎以及“2细胞样细胞”的标记,但随着2细胞阶段的退出,MERVL的表达逐渐被抑制,然而目前对于MERV的调控机制研究的并不深入。
组蛋白表观遗传修饰是目前已知的调控MERVL的途径之一,其中由赖氨酸甲基转移酶催化的赖氨酸甲基化修饰占据重要调控地位。赖氨酸甲基转移酶Dot1l(Disruptor of telomeric silencing 1-like,端粒沉默干扰子1-like,又称为KMT4)是一类不含有SET结构域的赖氨酸甲基转移酶,负责催化H3K79甲基化。Dot1l介导的H3K79甲基化与转录激活相关,通常被认为是常染色质和活跃表达基因的标记,与之矛盾的是,Dot1l对异染色质的形成同样至关重要,但目前尚不清楚Dot1l是否参与基因组其他区域(如逆转录转座子)的沉默,以及Dot1l如何在ESCs中发挥其抑制作用。

2023年7月31日,南开大学药物化学生物学国家重点实验室吕鑫屹课题组在Nucleic Acids Research 发表题为“Dot1l cooperates with Npm1 to repress endogenous retrovirus MERVL in embryonic stem cells”的研究论文,系统地解析了小鼠胚胎干细胞中Dot1l对于MERVL的抑制作用机制,该论文证实了Dot1l通过其AT-hook结构域与组蛋白伴侣Npm1相互作用,且Dot1l与Npm1共同定位在MERVL上,并通过组蛋白H1及其变体抑制mESCs中的MERVL和2CLC状态,首次揭示了Dot1l的非经典的转录抑制的新功能,进一步丰富了MERVL的调控网络。
该研究发现在mESCs E14中敲除Dot1l后可激活部分转座元件的表达,其中MERVL的激活最为显著,同时Dot1l的敲除能够显著上调大部分2细胞基因的表达。进一步的转录组分析揭示了Dot1l对基因和ERVs的全基因组抑制作用。作者通过ChIP-reChIP实验发现,Dot1l和其互作蛋白Npm1共同定位于MERVL上,并共同抑制MERVL的表达。通过构建Dot1l不同结构域缺突变体作者发现,Dot1l的甲基转移酶活性和AT-hook结构域对Dot1l的转录抑制至关重要,并且Dot1l通过其AT-hook结构域与组蛋白伴侣Npm1相互作用。
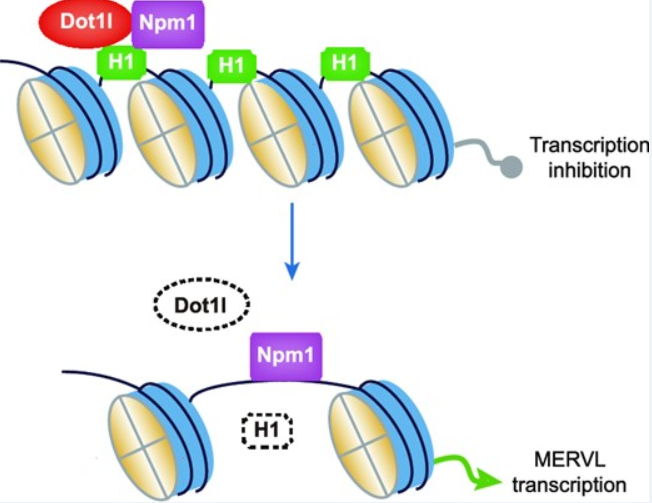
ESCs中Dot1l抑制MERVL和2-细胞样全能状态的示意图(图源自Nucleic Acids Research )
值得注意的是,作者发现Dot1l通过Npm1调节组蛋白H1及其变体,Dot1l的缺失影响Npm1与H1.2的相互作用,导致H1.2向MERVL的沉积减少。有意思的是,作者还发现,Dot1l通过泛素化调节组蛋白H1的稳定性,进而调控MERVL的表达。
总之,该研究证明了Dot1l的一个新的非经典的转录抑制的新功能,提出了一个新的调控MERVL的模型,即Dot1l通过Npm1控制组蛋白H1变体的表达和沉积,以抑制MERVL等内源性逆转录病毒。
据悉,该研究的通讯作者吕鑫屹为南开大学药物化学生物学国家重点实验室研究员,博士生赵欣、李晓敏、孙海洋为本论文的共同第一作者,南开大学刘林教授对本文也有重要贡献。
参考消息:
https://doi.org/10.1093/nar/gkad640
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







