Circulation 上海交通大学医学院附属仁济医院占贞贞团队揭示心肌梗死后修复型巨噬细胞代谢重编程新表观机制
2024-02-26 论道心血管 论道心血管 发表于上海
首次发现表观调控分子NPM1在心肌梗死后调节心脏修复的关键作用,阐明了NPM1通过表观重塑巨噬细胞代谢模式,进而调控心脏巨噬细胞的修复功能与表型转换的机制。
急性心肌梗死(MI)的发生会导致大量心肌细胞的丧失,并引发广泛的炎症反应。尽管早期的局部炎症有助于清除细胞碎片和启动心肌修复,但过度的炎症会导致大量可挽救的心肌细胞进一步损伤与丢失,阻碍心脏修复,加重不良心室重塑。修复型巨噬细胞可通过促进炎症消退、血管新生以及抑制不良的细胞外基质沉积,促进心脏修复。调节心脏修复型巨噬细胞功能表型可能是保护心脏不良重塑和梗死后心力衰竭的潜在干预策略。NPM1是胚胎发育中至关重要的蛋白,其功能涉及多种生物过程,包括核糖体生成、DNA损伤修复和参与染色质重塑等。NPM1基因突变被发现与白血病和乳腺癌等多种癌症的发生有关。
2024年2月23日,上海交通大学医学院附属仁济医院器官移植研究所占贞贞教授团队在Circulation上在线发表了题为“Targeting NPM1 Epigenetically Promotes Post-infarction Cardiac Repair by Reprogramming Reparative Macrophage Metabolism”的研究论文。首次发现表观调控分子NPM1在心肌梗死后调节心脏修复的关键作用,阐明了NPM1通过表观重塑巨噬细胞代谢模式,进而调控心脏巨噬细胞的修复功能与表型转换的机制。研究提示,NPM1可能作为心肌梗死后心力衰竭的潜在预后标志物和治疗靶点。

首先,研究者在临床MI患者PBMC、心肌组织的转录组测序和心脏免疫细胞单细胞测序数据中观察到NPM1的表达上升。并且在患者PBMC样本及MI小鼠模型中验证了其上调趋势,且其上调主要发生在巨噬细胞。同时发现,NPM1表达水平与患者预后标志物水平显著相关。
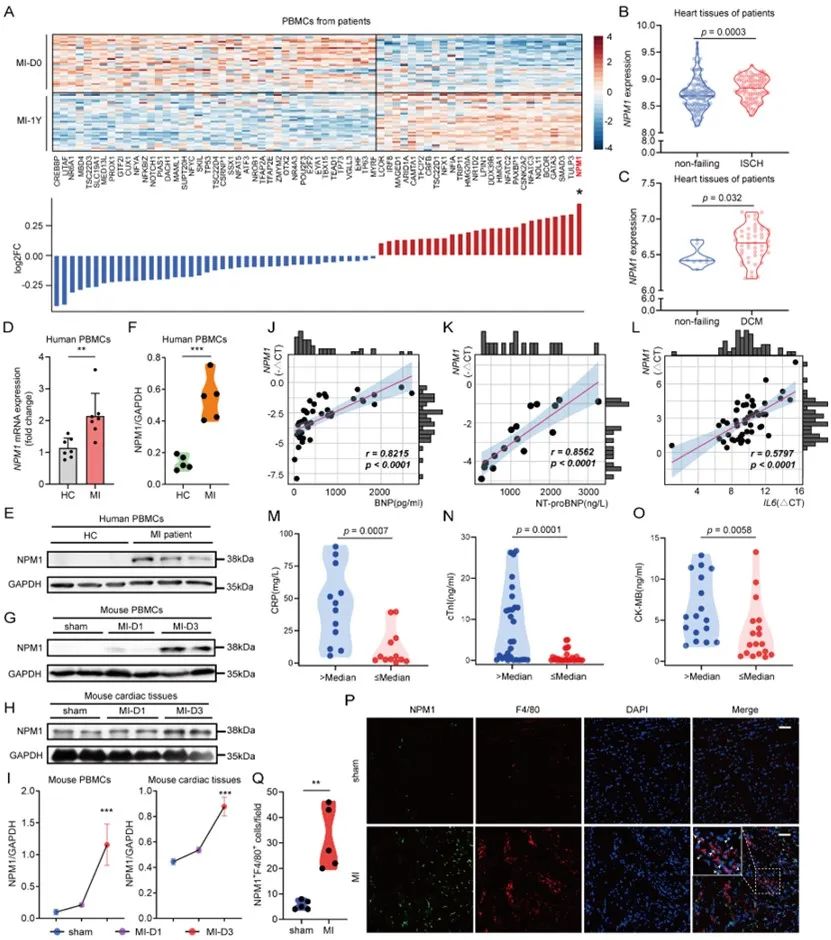
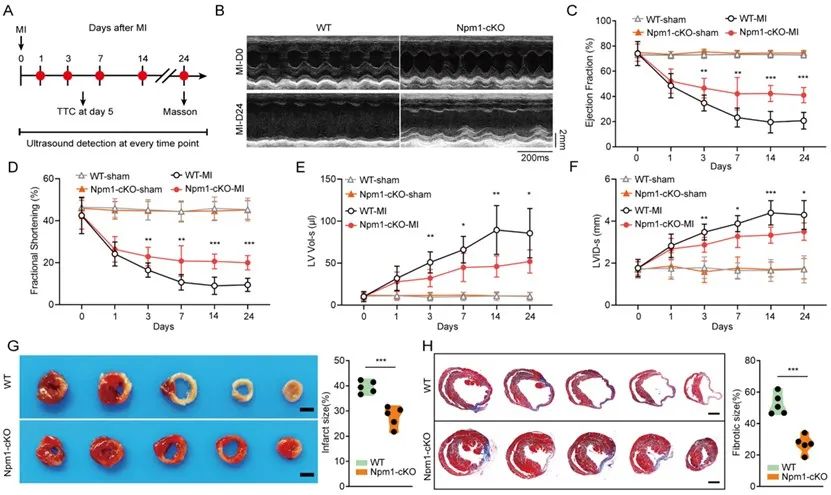
于是研究者构建巨噬细胞条件性敲除NPM1的小鼠,观察到NPM1缺失可以减轻MI小鼠心功能损伤和心室重构,改善血管新生同时限制组织纤维化水平,增加一系列心脏修复功能性分子的水平。进一步研究发现,NPM1缺失可促进心脏修复型巨噬细胞转化,增加其群体数量,并增强其功能。
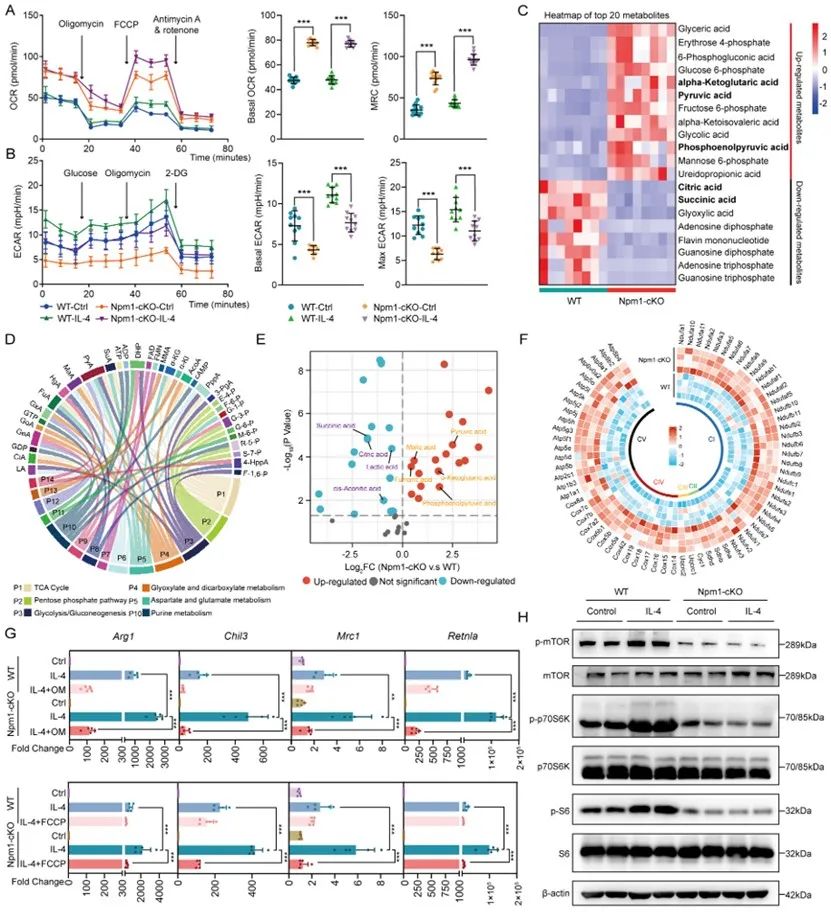
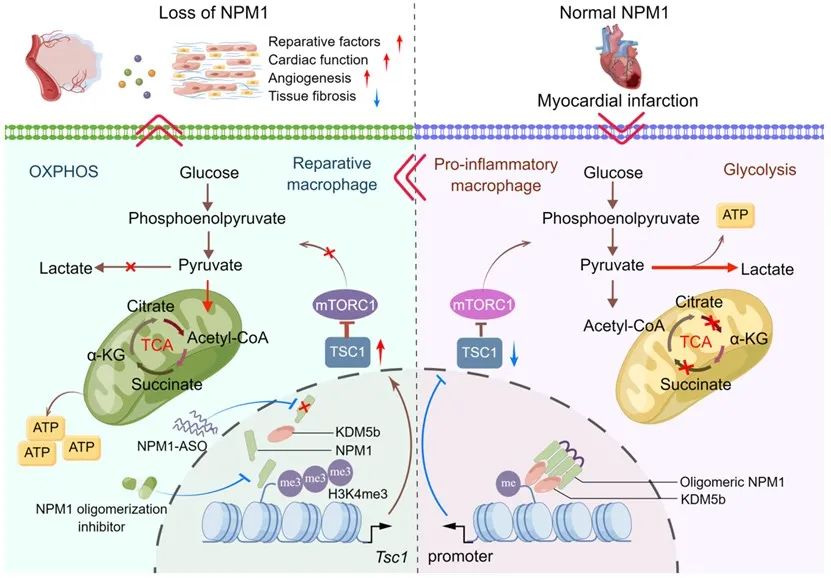
通过深入挖掘其分子机制,研究者发现NPM1通过调节巨噬细胞代谢重编程来调控其表型转化,而这一作用又是通过mTOR信号通路实现的。NPM1在MI后形成寡聚体,进而招募组蛋白去甲基化酶KDM5b至Tsc1基因启动子区降低其组蛋白H3K4me3修饰从而抑制其表达。而TSC1会进一步影响mTOR通路的活化,最终起到调节代谢模式与表型转化的作用。
基于以上机制,研究者构建靶向NPM1的反义寡核苷酸药物(ASO-NPM1)对MI小鼠进行在体干预,发现ASO-NPM1同样显著促进巨噬细胞修复型转化,改善心脏修复并减轻心功能损伤。研究者还尝试使用NPM1的寡聚化抑制剂进行在体治疗,发现其同样具有对缺血心脏的保护作用。
综上,研究者基于临床患者中观察到的现象以及小鼠模型中的验证,首次发现巨噬细胞NPM1在调节心脏缺血损伤后局部免疫微环境中的作用,并逐步挖掘其通过表观-代谢重编程调控巨噬细胞表型与功能的内在分子机制,为临床上治疗缺血性心脏病患者提供一种潜在的干预靶点与治疗策略。
该研究由上海交通大学医学院附属仁济医院/同济大学医学院占贞贞课题组完成,占贞贞教授为唯一通讯作者,同济大学医学院2020级临床医学博士研究生张晟、海军军医大学张赟恺博士为本文共同第一作者。该工作获得国家重点研发计划、国家自然科学基金等项目资助。
占贞贞教授课题组常年招聘优秀博士后和科研助理,课题组依托上海交通大学医学院附属仁济医院上海市器官移植研究所、器官移植与免疫工程技术研究中心,长期开展心脏、肝脏、肺脏等重要器官损伤修复中的免疫调节机制研究和临床转化研究。欢迎邮件联系:zhanzz2022@sjtu.edu.cn。
论文链接:
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.123.065506
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#心肌梗死# #巨噬细胞代谢#
58