放疗患者营养治疗专家共识 2021
2021-05-05
1背景
作为恶性肿瘤最重要也是效价比最高的治疗手段之一,放射治疗(以下简称“放疗”)对患者的营养状况具有正面和负面双向影响。放疗可减少肿瘤负荷、缓解肿瘤压迫和梗阻,改善患者营养摄入和营养状况;但是,头颈部放疗所致的味觉敏感度降低、放射性口腔黏膜炎和放射性口干等,胸部放疗所致的放射性食管炎,腹部、盆腔放疗所致的放射性肠炎、肠衰竭等,均会影响营养物质摄入、消化、吸收和代谢等全过程,导致营养不良的发生或营养状况的恶化。营养不良是恶性肿瘤放疗患者最常见的并发症之一。营养不良会对恶性肿瘤放疗患者造成不良影响,包括降低肿瘤细胞的放射敏感性、影响放疗摆位的精确性、增加了不良反应的发生、降低放疗的耐受性、延长总住院时间等。恶性肿瘤放疗患者进行规范、有效的营养治疗具有重要的意义,有利于保持患者体重,降低放疗不良反应,提高放疗的完成率和治疗疗效[1]。
放疗患者进行营养治疗目的包括:①诊断和治疗患者放疗前、中、后的营养不良;②降低患者的放疗不良反应,增强放疗耐受性,减少放疗非计划性中断,提高放疗完成率;③增加肿瘤细胞对放疗的敏感性,提高放疗精确度,提高患者的近远期疗效;④提高患者生活质量。
2证据
2.1恶性肿瘤放疗患者的营养状况恶性肿瘤放疗患者治疗前及治疗过程中体重丢失是营养不良的主要表现之一。MallickI等[1]的研究发现,接受根治性放疗的头颈部恶性肿瘤患者在放疗过程中体重平均丢失3.8%,其中体重丢失>5%的患者占37.9%。Vange-lovB等[2]回顾性分析134例行放疗±同步化疗±手术的口咽癌患者放疗前、放疗中的体重变化,发现严重体重丢失(1个月内下降≥5%)的发生率为67%,其中有26%的患者体重丢失≥10%。同步放化疗患者相对于单纯放疗患者有更多的体重丢失(P=0.001)。QiuC等[3]的研究纳入159例初诊鼻咽癌放疗患者,56%的患者在治疗前3个月体重丢失超过5%,而治疗后患者体重平均丢失6.9kg(2.1~12.6kg)。JiangN等[4]发现,对于中晚期食管癌患者,40.3%患者在放疗过程中体重丢失≥5%。膳食咨询、肿瘤分期早和总能量摄入≥1441.3kcal/d是体重丢失的保护性因素。DiFioreA等[5]也发现,食管癌同步放化疗患者在治疗期间体重、BMI和血清白蛋白水平均明显下降,患者体重的丢失程度与肿瘤T分期明显相关。KissN等[6]回顾性分析了96例接受高姑息或根治性放疗的小细胞和非小细胞肺癌患者从放疗前到放疗开始后90d的体重丢失情况,发现患者体重平均减轻8%(范围5%~19%),而体重丢失≥5%的患者占31%。同期化疗和疾病分期晚是体重丢失≥5%的危险因素。CacicedoJ等[7]评估了129例不同部位肿瘤患者放疗期间和治疗后1个月体重变化情况,发现其平均体重丢失分别为0.68kg和1.6kg。放疗过程中,头颈部肿瘤相对于其他部位肿瘤有更高的平均体重丢失(2.6kg比0.7kg,P=0.028)。放疗后的1个月中,头颈部肿瘤患者的平均体重丢失为3.7kg,其余患者为1.1kg(P=0.034)。
SGA、PG-SGA是肿瘤患者营养状况评估的重要工具。UnsalD等[8]采用SGA对207例不同部位的恶性肿瘤患者放疗前和放疗后营养状况进行了评估发现,放疗前患者营养不良的发生率为31%,放疗后营养不良的发生率上升至43%。其中头颈部肿瘤患者放疗后更容易发生营养不良,由放疗前的24%增加到放疗后的88%。HillA等[9]对73例胃肠道肿瘤放疗患者行PG?SGA评估,发现75.5%的患者出现不同程度的体重丢失。放疗非计划中断和不能完成计划化疗周期数的患者有更多的体重丢失。放射不良反应与PG-SGA评分密切相关(P<0.001)。
营养不良可以降低肿瘤细胞的放射敏感性,增加患者放疗摆位误差,降低治疗耐受性和近期疗效。同时,营养不良还是肿瘤局部复发和生存率低的危险因素。因此,对所有恶性肿瘤放疗患者常规进行营养风险筛查和营养评估,以便及时给予营养治疗具有重要的意义。
2.2恶性肿瘤放疗患者营养风险筛查和营养评估ESPEN推荐采用NRS2002筛查一般成年住院患者的营养风险[10]。NRS2002总分≥3说明营养风险存在,需进一步进行营养评估。营养评估主要判断患者有无营养不良及其严重程度。常用的营养评估量表有SGA、PG-SGA等。SGA是ASPEN[11]推荐的临床营养评估工具,目的是发现营养不良,并对营养不良进行分级。PG?SGA是ADA和中国抗癌协会肿瘤营养与支持治疗专业委员会推荐用于肿瘤患者营养状况评估的首选方法。
PG-SGA评分与放疗患者的放疗不良反应和长期生存相关。BahlA等[12]对50例拟行根治性放化疗的局部晚期头颈部肿瘤患者行PG-SGA评估,放疗前的中位得分为8(范围2~14);PG?SGA<9分的患者3~4级放射性黏膜炎的发生率明显低于PG-SGA≥9分者(21.8%比55.5%,P=0.01);PG?SGA<9分的患者有更高的CR率(32%比8%,P=0.05)和更长的中位生存期[(17.0±2.9)月比(16.0±2.8)月,P=0.49];多因素分析显示,PG-SGA评分<9与较好的局部控制率和较低的急性放射性不良反应有关。
BarthelemyN等[13]对肺癌放疗患者采用NRS2002筛查和PG-SGA评估患者营养状况并进行对比分析,结果显示两种量表得出的结果具有一致性。Isen-ringE等[14]对60例恶性肿瘤放疗患者采用PG-SGA和SGA评估,发现两种量表评估的患者营养状况结果一致,均较放疗前有明显下降,并与患者的生活质量明显相关。
目前尚无专门针对肿瘤放疗患者的营养风险筛查和营养评估工具,《恶性肿瘤放疗患者肠内营养治疗专家共识》[15]和《肿瘤放疗患者口服营养补充专家共识》[16]均推荐:恶性肿瘤放疗患者的营养风险筛查采用NRS2002,营养评估采用PG-SGA。
2.3恶性肿瘤放疗患者的营养治疗路径PG-SGA评分是判断患者营养不良及严重程度的重要工具,而美国肿瘤放射治疗协作组(RadiationTherapyOncologyGroup,RTOG)急性放射损伤分级既是评估放疗患者放射损伤严重程度的标准,也是评估放疗患者营养状况包括患者对营养物质摄入、消化吸收和代谢状况的重要参考因素。因此,在对恶性肿瘤放疗患者进行营养治疗前,需要综合评估每例患者的营养状况(PG-SGA评分)及患者在放疗过程中的急性放射损伤(RTOG分级)。放疗过程中,患者的营养状况和放射性损伤分级会不断发生变化,需要不断进行再评价,以便及时调整治疗方案和路径(图1)。
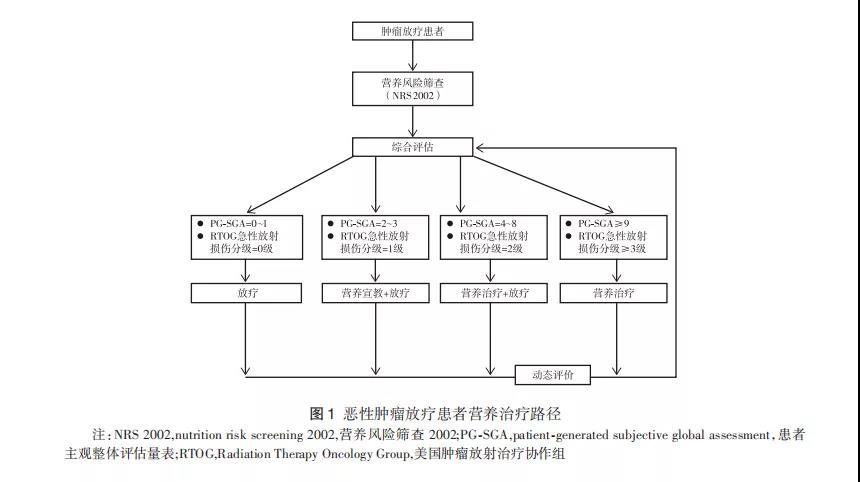
2.4恶性肿瘤放疗患者肠内营养的途径国内外营养指南均推荐ONS作为放疗患者首选营养治疗方式。对于ONS不能满足目标营养需求时应进行管饲营养,但管饲的最佳时机以及放疗前预防性置管是否有益,目前还缺乏足够的证据。对绝大多数恶性肿瘤患者来说,放疗前常规预先置入营养管在提高患者营养状况和治疗疗效、减少患者放疗中断方面并没有优势,反而增加患者负担。VangelovB等[17]回顾性研究了131例行放疗±化疗的晚期口咽癌患者的营养管置入情况,分为放疗前预防性置入营养管(预防性管饲)和治疗过程中根据患者反应情况置管(反应性管饲)两种情况。研究发现,双侧颈部淋巴结照射(P=0.001)和同步放化疗(P=0.038)的患者接受反应性管饲的比例更高。预防性管饲的患者体重丢失(5.2%±4.7%)明显低于反应性管饲的患者(9.5%±3.4%,P<0.001),但在5年生有差异。因此,双侧颈部淋巴结照射和同步放化疗的患者可考虑行预防性管饲。JiangW等[18]的前瞻性RCT纳入了100例接受放化疗的局部晚期鼻咽癌患者,分为ONS组和对照组,ONS的使用时间从放化疗的第1天到放化疗结束。结果显示,接受ONS患者在减少体重丢失、减少BMI下降和增加蛋白质摄入量方面均具有明显优势。YokotaT等[19]开展的一项研究共纳入14例西妥昔单抗联合放疗治疗局部晚期头颈部鳞状细胞癌患者,12例(85.7%)患者出现≥3级的口腔黏膜炎,其中11例(78.6%)患者需接受营养治疗。虽然缺乏更多的数据支持,但对于存在以下一种或多种情况的恶性肿瘤患者可以考虑放疗前预防性置入营养管:明显体重丢失(1个月内>5%或者6个月内>10%)、BMI<18.5kg/m2、严重吞咽梗阻或疼痛、严重厌食、头颈部恶性肿瘤预期将发生严重放射性口腔或食管黏膜炎者。
PEG-J和NGT是管饲的主要方法,两者在维持患者体重方面没有明显差异。NGT较PEG-J对吞咽功能影响小、置管的花费更少,但NGT使用时间较短,通常不超过1个月,且可能对患者的外观、家庭生活和社交活动造成一定的负面影响,因此患者的依从性更差。PEG-J较NGT使用时间更长,可以从数月至数年,移位风险低,患者的生活质量可能更好,但置管花费更高[20]。另外,PEG-J有发生造瘘口感染、疼痛,造瘘口周围皮肤损伤的风险,还可能延迟患者放疗后恢复正常饮食的时间。对于恶性肿瘤放疗患者,通常首先选择NGT,对于NGT无法满足营养需求或需要长期人工喂养的患者,则应选PEG-J[21]。由于放射性口腔炎、食管黏膜炎的影响,对于头颈部肿瘤放疗患者的管饲肠内营养以及需要长时间(>30d)肠内营养的患者,可以优先考虑PEG-J。
2.5恶性肿瘤放疗患者部分或全肠外营养的时机当患者胃肠道有功能时,应首选肠内营养。ESPEN[10]和ASPEN[22]均认为,对于放疗患者不推荐常规使用肠外营养。然而,在肠内营养不充分或不可实施时,应联合部分或全肠外营养,以增加能量及蛋白质的摄入量,减少或避免负氮平衡和喂养不足的发生。《恶性肿瘤患者的营养治疗专家共识》[23]推荐肠外营养用于需要营养治疗且不能耐受肠内营养的患者,如放疗后严重黏膜炎和严重放射性肠炎。肠外营养开始的时机仍存在争议。《成人补充性肠外营养中国专家共识》[24]推荐,对于NRS2002≥5分或危重患者营养风险评分(nutritionriskinthecriticallyillscore,NUTRIC)≥6分的高风险患者,如果肠内营养在48~72h无法达到目标能量和蛋白质需要量的60%时,推荐早期给予肠外营养治疗。而对于NRS2002≤5分或NUTRIC≤6分的低风险患者,如果肠内营养未能达到目标能量和蛋白质需要量的60%超过7d时,才启动补充性肠外营养治疗。
2.6恶性肿瘤放疗患者能量和蛋白质需求恶性肿瘤住院患者目标能量的确定推荐参考间接能量测定法所获得的基础代谢率能量水平,并且结合患者的活动强度和疾病应激状况进行判断。《中国肿瘤营养治疗指南2015版》[25]和中国临床肿瘤学会(ChineseSocietyOfClinicalOncology,CSCO)肿瘤营养治疗专家委员会制订的《恶性肿瘤患者的营养治疗专家共识》[23]、ESPEN指南[10]均推荐,放疗患者如果无法进行个体化的TEE测量,建议每天应给予25~30kcal/kg的能量。
放疗患者能量需求随放疗进行和放射不良反应发生而变化[26,27]。研究发现,头颈部恶性肿瘤放疗患者,在放疗实施的前3周,随着肿瘤负荷减少和高代谢状态的抑制,能量需求呈逐渐下降的趋势。放疗开始后第4~9周,随着放射不良反应的发生,能量需求逐渐增加。当放疗结束后,如果肿瘤得到有效控制,放疗不良反应逐渐消失,患者所需的能量逐渐恢复正常。因此,放疗患者的能量摄入目标量需要根据肿瘤负荷、应激状态和急性放射损伤个体化给予并进行动态调整。
肿瘤患者蛋白质合成和分解代谢均存在异常。对于进展期患者,蛋白质分解大于合成,部分患者还并发恶液质状态。蛋白质的需要量取决于代谢应激因素和蛋白质消耗的程度,对于恶性肿瘤放疗患者推荐提高蛋白质摄入量。ESPEN[10]指南推荐,肿瘤患者蛋白质最低摄入量1.0g/(kg·d),目标需要量为1.2~2.0g/(kg·d),进一步提高蛋白质摄入量对临床结局的影响还不明确。对于并发恶液质的放疗患者,骨骼肌量持续下降,蛋白质及能量负平衡,应进一步提高蛋白质的摄入量,可达到2.0g/(kg·d)[29]。放射线影响机体蛋白质的代谢,当肌肉受到放射线照射后,会出现急性萎缩反应,表现为肌球蛋白含量减少、肌球蛋白重链比例变化等,并且与放射线剂量有关。放疗后肌肉含量减少与患者的预后显著相关[30],但放疗患者是否需要更高的蛋白摄入量[>2.0g/(kg·d)]目前还缺乏依据。
2.7免疫营养素EdaK等[31]开展的纳入40例乳腺癌放疗患者的RCT发现,谷氨酰胺组2级放射性皮肤损伤发生率为11.1%,明显低于安慰剂组的80%(P<0.001),谷氨酰胺组和安慰剂组3级放射性皮肤损伤发生率分别为0和20%(P<0.001)。ImaiT等[32]的研究发现,对于头颈部肿瘤放疗患者,放疗同时补充β?羟基甲基丁酸/精氨酸/谷氨酰胺(干预组),相比不补充的患者(对照组),≥3级放射性皮炎发生率无差异,但2级放疗性皮炎发生率显著降低(62.6%比94.4%,P<0.05)。干预组≥1级和≥2级放射性皮炎的持续时间明显短于对照组(P<0.05)。Lopez-VaqueroD等[33]的一项双盲RCT则认为,谷氨酰胺不能减少头颈部肿瘤放疗或放化疗患者口腔黏膜炎的发生率,但对放射性皮炎的发生率有明显降低作用(84%比100%,P=0.038)。
LeungHW等[34]纳入5项研究、234例头颈部肿瘤放疗患者的荟萃分析发现,谷氨酰胺相对于安慰剂组及空白对照组在减轻放射性口腔黏膜炎的程度和风险上有优势。PattanayakL等[35]对比了给予或不给予谷氨酰胺的162例头颈部鳞癌放疗患者不良反应发生情况,结果发现,谷氨酰胺组3级放射性口腔黏膜炎的发生率明显降低,疼痛、吞咽困难、恶心、水肿、咳嗽等不良反应的发生率以及使用镇痛药和管饲的比例,均明显低于对照组。SaylesC等[36]纳入15项研究的系统评价发现,与对照组相比,口服7.5~30.0g/d谷氨酰胺使化疗和/或放疗患者的口腔黏膜炎的程度显著降低,持续时间和发作次数更少,而两组患者的恶心、呕吐、口干和厌食等不良反应的发生率相似。
一项纳入46例肺癌放疗患者的RCT研究发现,给予预防性口服谷氨酰胺(30g/d)的患者放射性食管炎的分级显著低于不使用谷氨酰胺的对照组[37]。Top-kanE等[38]回顾性分析41例经胸部照射治疗的Ⅲ期肺癌患者,其中22例(53.6%)患者预防性口服谷氨酰胺(每8小时10g),在发生2级或3级放射性食管炎的20例(48.8%)患者中,使用谷氨酰胺者7例,未服用谷氨酰胺者13例(P=0.002),所有7例严重放射性食管炎患者均为未补充谷氨酰胺者,且补充谷氨酰胺明显延迟了放射性食管炎的发生时间(22d比16d,P=0.002)。
DeUrbinaJO等[39]的双盲RCT纳入43例腹部放疗患者,分别服用30g/d的谷氨酰胺或酪蛋白,结果发现,谷氨酰胺可以降低腹部放疗所致的炎症反应和自噬反应,但没有肯定其对肠道黏膜的保护作用。而Vi-dal-Casariego A等[40]的双盲RCT纳入69例接受放疗的盆腔或腹腔恶性肿瘤患者,同样分别服用30g/d的谷氨酰胺或酪蛋白。结果发现,相对于对照组,谷氨酰胺组放射性肠炎的发生率反而更高(55.9%比22.0%,P=0.002)。CaoDD等[41]的系统评价纳入13项RCT共979例患者,发现谷氨酰胺治疗放射性肠炎的有效性高于对照组,但差异无统计学意义(OR=3.07,95%CI:0.79~11.96,P>0.05),谷氨酰胺也未能显著改善放射性肠炎、腹部绞痛和便血的症状(P>0.05)。
ω-3PUFA包括ALA、EPA和DHA。放疗期间补充ω-3PUFA有利于保持或增加体重,提高免疫力,降低炎症反应,提高患者生活质量[42-44]。Fietkau等[45]发现,富含ω-3PUFA的肠内营养配方相对于标准营养配方更能改善食管癌和头颈部肿瘤患者的营养状况和生活质量。DeAguiarPastoreSilvaJ等[42]就ω-3PUFA在肿瘤化疗或联合放疗患者中应用的系统评价显示,ω-3PUFA对保持患者体重有益,但是对于缩小肿瘤体积和延长患者生存时间并无优势。
3推荐意见
恶性肿瘤放疗患者营养不良发生率高,对治疗的疗效和不良反应影响大,应常规进行营养风险筛查和营养评估。(A)
恶性肿瘤放疗患者营养风险筛查推荐采用NRS2002,营养评估推荐采用PG-SGA。(A)
不需要对所有恶性肿瘤放疗患者常规进行营养治疗,而是应该在综合评估患者的营养状况(PG-SGA)和放射损伤(RTOG分级)的基础之上,进行及时和合理的营养治疗。(A)
ONS是恶性肿瘤放疗患者首选营养治疗方式。不推荐放疗前常规预防性置入营养管。如果头颈部及胸部肿瘤放疗患者存在以下一种或多种情况时可以考虑预防性置入营养管:明显体重丢失(1个月内>5%或者6个月内>10%)、BMI<18.5kg/m2、严重吞咽梗阻或疼痛、严重厌食、头颈部肿瘤预期将发生严重放射性口腔或食管黏膜炎者。(B)
对于肠内营养可达到正常营养需要量的恶性肿瘤放疗患者,不推荐常规进行肠外营养治疗。当患者无法通过肠内营养(如严重放射性黏膜炎、放射性肠炎或肠衰竭)获得足够的营养需要时,则需联合部分肠外或全肠外营养。(A)
恶性肿瘤放疗患者能量摄入目标量推荐为25~30kcal/(kg·d)。在放疗过程中,需要个体化给予能量摄入目标量并进行动态调整。(B)
肿瘤放疗患者推荐的蛋白质摄入量应为1.0~2.0g/(kg·d)。(B)
谷氨酰胺对降低恶性肿瘤放疗患者放射性皮肤损伤、放射性口腔黏膜炎、放射性食管黏膜炎的发生率和严重程度有益,但对于放射性肠炎的预防和治疗作用缺乏足够的临床证据。(A)
恶性肿瘤放疗患者补充富含ω-3PUFA的肠内营养制剂可能对减少患者炎症反应、保持患者体重有益,但对肿瘤消退和患者生存时间的影响证据不足。(B)
执笔人:
李涛(四川省肿瘤医院)
吕家华(四川省肿瘤医院)
石汉平(首都医科大学附属北京世纪坛医院)
共识专家组成员(以姓氏笔画为序)
于世英(华中科技大学同济医学院附属同济医院)
石汉平(首都医科大学附属北京世纪坛医院)
丛明华(中国医学科学院北京协和医学院肿瘤医院)
庄则豪(福建医科大学附属第一医院)
刘凌翔(南京医科大学第一附属医院)
江华(四川省医学科学院﹒四川省人民医院)
许红霞(陆军军医大学第三附属医院)
李铎(青岛大学营养与健康研究院)
李涛(四川省肿瘤医院)
李薇(吉林大学白求恩第一医院)
张小田(北京大学肿瘤医院)
陈伟(中国医学科学院北京协和医学院北京协和医院)
陶晔璇(上海交通大学医学院附属新华医院)
蔡红兵(武汉大学中南医院)







学习
103
但没有资源
93
营养问题提到一定重视程度是非常必要的
96
学习
120
打卡
110