肠道菌群+计算机:定制你的健康食谱与治疗方案
2016-07-26 段云峰 知识分子
你以为你是自己的主人?No!科学家说,细菌不一定答应呢。在数百万年间,肠道微生物与人科动物协同进化,共同塑造了我们的免疫系统和发育进程。这样奇妙的生命过程近年来成为科学家们的研究热点。4月29日,《科学》(Science)杂志发表肠道菌群系列研究专刊。7月7日,《自然》(Nature)杂志再发力,出版肠道微生物专刊。两家顶级期刊在相互竞争在这一领域的影响力和关注度。免疫和肠道微生物已经成为不离

你以为你是自己的主人?No!科学家说,细菌不一定答应呢。
在数百万年间,肠道微生物与人科动物协同进化,共同塑造了我们的免疫系统和发育进程。这样奇妙的生命过程近年来成为科学家们的研究热点。
4月29日,《科学》(Science)杂志发表肠道菌群系列研究专刊。7月7日,《自然》(Nature)杂志再发力,出版肠道微生物专刊。两家顶级期刊在相互竞争在这一领域的影响力和关注度。
免疫和肠道微生物已经成为不离不弃的“兄弟”。最新发表的这一系列文章概括了这个领域最前沿的进展,重点关注了肠道菌群与健康和疾病的关系,主要包括肠道微生物与人体生长发育、免疫系统、代谢系统以及抵抗病原菌等方面,研究者还提出了微生物组关联分析,有望精准地诊断和治疗疾病,以及微生物领域未来研究的发展方向。
人类发育,微生物帮了什么忙?
从受精卵到胚胎发育,人们往往只考虑人类自身的细胞和器官的发育,并没有意识到人体微生物在整个发育过程中的作用。
如今,越来越多的研究表明,人体微生物与发育密切相关。母亲的口腔、肠道以及产道中的微生物组成,都会对婴儿肠道微生物组成、发育以及免疫系统发育和代谢过程产生影响。此外,产后接触的微生物、母乳中的低聚糖和其中的微生物以及断奶后的饮食等,也都会对婴儿肠道微生物产生影响。
因而有研究认为,未来的优生优育可能需要依据人体微生物的发育过程来制定相应的疾病预防和治疗策略。
《自然》专刊的第一篇文章作者是华盛顿大学圣路易斯分校的杰夫·戈登(Jeff Gordon)教授,初步统计,仅从2015年至今,他们实验室已经发表了4篇Cell、2篇Science和1篇Nature文章。在这篇文章中,戈登教授关注的科学问题是:肠道微生物是如何通过基因和代谢途径来影响人体;人出生后,肠道微生物如何发挥作用;不同地区人的肠道菌群是否经历了一致的功能完善过程;肠道微生物的发育过程如何受母乳、断奶阶段食物种类的影响;出生后肠道微生物的发育过程阻断对儿童和成人期健康状况的影响;是否能通过特意和持续性地改变肠道微生物组成来促进健康。
与此同时,戈登教授和他的同事提出了从微生物视角来看待人类的生物学发育的过程。由于生活方式和疾病模式正在全球范围急剧变化,为此,他们还呼吁大家一起建立“人类微生物观测站”(Human microbial observatories),即从人类学的范畴研究不同种族的儿童体内微生物群落的发育过程。不得不说,这样具有全球视野的提议意义重大,期待早日开展。
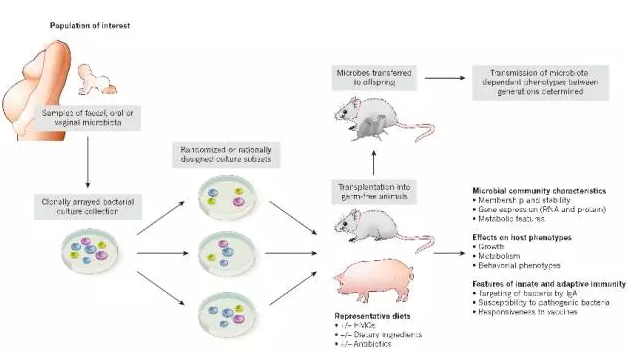
研究人类微生物群体功能特性的实验流程,图片来自Nature(Mark R. C. et al., 2016)
计算机告诉你,应该吃什么
饮食是影响肠道微生物组成的最重要因素。来自斯坦福大学医学院的贾斯汀·索恩伯格(Justin Sonnenburg)教授和来自瑞典哥德堡大学的Fredrik Bäckhed教授,撰文分析了肠道微生物与饮食如何相互作用,从而影响生理代谢。
他们发现调节饮食可影响肠道微生物,进而对宿主的代谢状况产生影响,由此来寻找潜在的干预和治疗方式。研究表明,饮食习惯导致的肥胖以及相关代谢性疾病,与II型糖尿病密切相关,其中,肠道菌群是连结饮食和代谢的关键因素,而饮食是最重要的调节物质,不仅影响肠道微生物的组成,还能影响其代谢产物。通过饮食调节,如饮食中的植物多糖,使肠道微生物产生短链脂肪酸等物质来促进人体健康,减少炎症的发生。
他们在文中提出了调节肠道微生物来促进人体健康的研究策略。饮食调节肠道菌群是一种“安全”的干预方法,结合多组学的数据和临床数据,采用机器学习等数据处理算法,可分析食物对肠道微生物的具体影响,从而有助于预测不同饮食干预在不同人体内的反应。在独立队列研究中对这些预测的结果进行验证后,就可以将上述研究结果形成个性化的饮食和营养干预方案,从而实现精准干预,改善人体健康。基于此,精准营养就指日可待,在未来决定我们每天吃什么的可能是计算机,依据计算机给出的饮食方案,就能够维持肠道微生物和人体的健康。

饮食和肠道微生物的相互作用,产生短链脂肪酸的过程,图片来自Nature (Justin L. S. et al., 2016)
微生物与先天免疫系统
先天免疫系统是人体本身具有的免疫防御体系,包括一系列的免疫细胞(主要是各类白细胞)和相应的信号传递机制。它们时刻待命,一旦发现有病菌侵入即刻开始行动,通过非特异的方式识别和防御感染源。
一般情况下,先天免疫系统并不攻击人体共生微生物,它们之间存在密切的沟通和联系,共同维护人体健康。而肠道菌群是对饮食、基因和免疫信号等外环境做出反应的信号枢纽,可影响宿主的代谢、免疫力和对感染的反应。
先天免疫系统中的造血和非造血细胞分布在宿主–微生物交互的表面,具有感知微生物或它们的代谢产物的能力,可将这些信号转化为宿主的生理反应以及对微生物生态的调节。如果先天免疫系统和肠道菌群之间的信号转导过程出现了异常,就可能导致多种疾病。
虽然肠道上皮细胞并不是先天免疫系统的成员,但是在它的表面附着了大量先天免疫系统的各种受体。先天免疫系统对肠道微生物的识别就发生在肠道上皮细胞上。肠壁细胞实际上是把肠道微生物信号传递给宿主的交互界面,包括粘膜、抗菌肽和细胞代谢的动态调节。
骨髓细胞是人体内重要的具有造血和免疫系统恢复功能的细胞。微生物能够影响多种器官中骨髓细胞的发育,要是没有微生物及其代谢产物,骨髓细胞的发育就会受到影响,例如系统性的细菌感染。虽然人体的先天免疫系统受肠道微生物影响,但是它也不是逆来顺受的“受气包”,先天免疫系统也会有选择地调节肠道微生物的组成和代谢。事实上,能够调节先天免疫系统的肠道微生物也有选择性,并不是肠道里的微生物都有此功能。
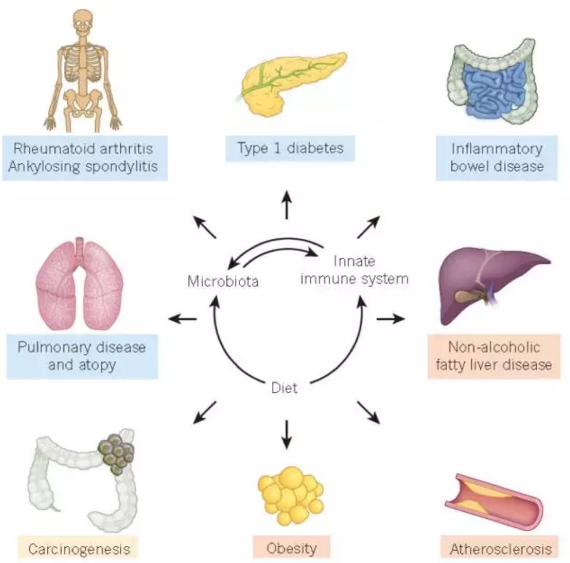
多种涉及微生物-先天免疫系统的相互影响的疾病,图片来自Nature (Christoph A.T. et al., 2016)
来自以色列魏兹曼科学院的Eran Elinav教授和Eran Segal教授指出,由于动物模型和人体存在差别,在小鼠模型中获得的研究结果仍需在人体中再次验证;现有的关于微生物和先天免疫的知识并不完美,可能还存在其它机制,微生物与先天免疫系统相互作用的关系复杂,所以需要系统地研究和筛选可作用于先天免疫系统的肠道微生物,并可能发现更多的相互作用机制。
他进一步表示,与获得性免疫比较清晰的相互作用机制相比,现在还不清楚哪些细菌、效应分子和分子机制参与了微生物对先天免疫细胞的调节。因此,在制定相关疾病的治疗方案时,需要充分考虑饮食、益生菌、药物等能够影响微生物组成的因素,它们都能直接或间接对先天免疫系统产生影响。
2015年,Elinav教授和Segal教授一篇发表在《细胞》杂志的文章显示,通过个性化饮食可以精确控制血糖,他们已经将这项技术授权给一家名为DayTwo的公司,并且二人都作为公司的成员专门提供基于微生物的个性化营养服务。他们是人体微生物领域内产学研结合,再转化为实际应用的范例。
肠道微生物与适应性免疫系统
适应性免疫系统,也称特异性免疫系统或获得性免疫系统,是针对特定病原产生的免疫系统。与先天性免疫系统不同,适应性免疫系统是后天被某些病原菌感染后,有针对性的形成的特异性免疫反应系统,该系统主要包括细胞免疫(T细胞)和体液免疫(B细胞)。由于每个人一生中遇到的病原菌的种类和机会是不同的,因此,不同人的适应性免疫系统具有十分明显的个体差异性。实际上,肠道微生物与适应性免疫系统密切相关,不同个体的适应性免疫系统受到肠道微生物的影响也不同。
日本理化研究所(RIKEN)肠道稳态实验室负责人Kenya Honda和纽约大学教授Dan Littman教授是研究免疫系统和肠道微生物关系的专家,他们介绍了黏膜上特定位置分布的免疫系统T细胞和B细胞的表型和功能受微生物影响。这些细胞在抑制对无害抗原的响应、加强肠黏膜屏障功能完整性和维持免疫系统的平衡中发挥重要作用。反之,肠道菌群失衡也可引起多种免疫系统疾病。这种可区分稳态,病原微生物和宿主之间的相互作用机制研究,有助于发现预防或调节炎症性疾病和提高肿瘤免疫治疗的疗效。
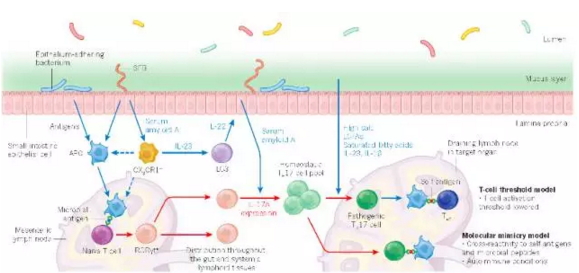
微生物介导的Th17细胞和自身免疫,图片来自Nature (Kenya Honda. et al., 2016)
肠道微生物对病原菌的抵抗
微生物对人类健康有重要作用,它们不仅跟人的先天免疫和适应性免疫系统密切相关,帮助这两个免疫系统的发育和成熟,还能够直接作用于病原菌。
近年来的研究显示,微生物的改变可导致对病原菌产生耐药性或促进病原菌感染。其中,抗生素能对肠道菌群产生深远影响,不仅改变肠道的营养状态,还可能导致致病菌的增殖。实际上,病原菌可以利用肠道微生物产生的碳和氮作为营养来源和调节信号以促进其自身的生长和发挥毒力。通过引发炎症,这些细菌能够改变肠道环境,并使用独特的系统来推动自身的增殖。
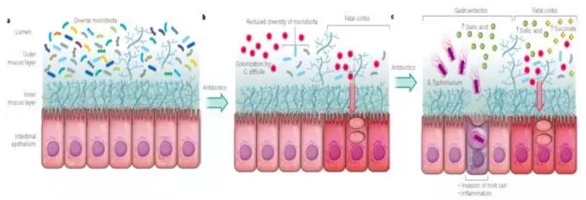
抗生素对肠道微生物和病原菌的影响,图片来自Nature (Andreas J. B. et al., 2016)
来自美国加州大学戴维斯分校的Andreas Bäumler教授主要关注病原菌的感染、抗生素的使用和肠道微生物的关系。6月,他们刚在《自然》杂志上发表关于抗生素引起肠道微生物改变机制的研究,解释了服用抗生素如何改变肠道菌群,增加沙门氏菌等病原菌生长的营养物的可获得性。
该文章的另一位作者,来自德州大学西南医学中心的Vanessa Sperandio教授主要关注病原菌感染宿主的机制。她的研究涉及细菌是如何识别宿主,以及如何利用这方面的知识来干扰细菌的感染。其曾发表关于细菌病原体,如肠出血性大肠杆菌(EHEC)、沙门氏菌、土拉杆菌等典型的“超级细菌”,是如何利用微生物菌群与宿主的这种细胞—细胞之间的信号转导方法,来判断和识别宿主环境。研究发现病原菌与宿主之间的沟通依赖激素,包括宿主的肾上腺素和去甲肾上腺素(NE)等应激激素以及细菌芳香性激素样信号Autoinducer-3。
人类为了杀灭病原菌发明了抗生素,但抗生素的使用会对人体微生物产生巨大影响,而人体微生物又与先天免疫和适应性免疫系统密切相关,这似乎形成了一个怪圈。人体共生微生物和病原菌究竟谁是敌是友,需要免疫系统来识别,三者之间形成了微妙的关系。理解微生物、宿主和病原菌之间的相互作用机制,将有助于制定通过调节微生物来对抗传染性疾病的策略。
微生物研究可用于疾病的精准诊疗
重量级人物往往都会被用来压轴。这组文章的最后一篇出自去年刚被加利福尼亚大学圣迭戈分校挖走的Rob Knight教授。他是微生态研究领域的大牛,不仅生物信息做得好,还积极鼓励大众参与科研并非常热衷于科普。
Knight教授提出的微生物基因组关联分析(MWAS)方法,实际上借鉴了全基因组关联分析(GWAS)的称谓。华大基因也曾发表过一篇文章介绍了一种宏基因组关联分析(MGWAS)的方法。实际上它们都是类似的方法,目的都是将多种复杂的基因信息和表型信息进行关联分析,从而寻找与疾病关系密切的特异基因。
DNA测序、蛋白质组学和代谢组学,计算工具的快速发展使得我们对微生物组及其与疾病之间的联系了解得越来越多,特别是时间序列研究以及多分子的视角促进了微生物基因组关联分析的发展。早期的研究结果虽然显示了微生物基因组关联分析的有效结果,但是其临床试验申请还没有被批准。由于微生物和宿主之间存在复杂的关系,记录和整合宿主的饮食、化学和健康状态,以及确定研究需要的动态变化的观测频率,对开展基于微生物的精准诊断和治疗来说具有重要意义。
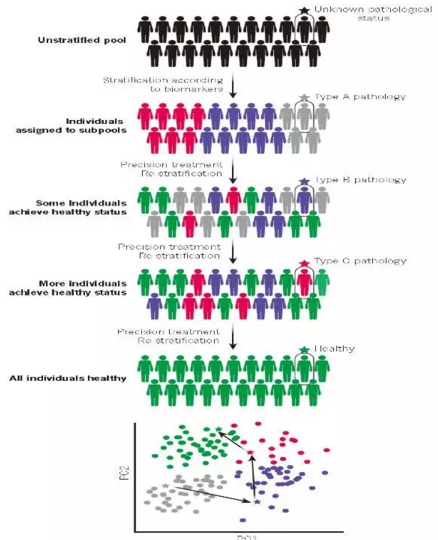
开发微生物全球定位系统(M-GPS)提供个性化干预指导,图片来自Nature ( Jack A. G. et al., 2016)
如何寻找与疾病相关的肠道微生物?事实上,科学家已经在不同的分类水平上寻找到了多种疾病的生物标记物。有些标记物是在门或属水平,如与肥胖、IBD和癌症等相关的肠道微生物。当然,有些生物标记物并不具体涉及某个菌,可能是在某一类别或者某几类菌,也可能是其它分类标准,如肠型。仅从微生物分类的水平寻找生物标记物是不够的,宏基因组分析能够发现一些与疾病相关的微生物功能基因,从微生物实际参与的代谢过程来发现疾病的特异生物标记物似乎离摸清楚微生物与疾病的关系更近一步。但是很多研究只是停留在人体微生物与疾病的相关上,建立疾病与人体微生物的因果关系才能更好应用于临床。
此外,微生物的代谢产物对人体的影响广泛,寻找和鉴定与人的健康和疾病密切相关的代谢产物能够帮助人们了解具体的分子机制,从而为干预和治疗疾病提供有效的靶点。
事实上,人体微生物并不是一成不变的,它们始终处在动态变化中,摸清其变化规律十分必要。目前所有的努力并不是为了解释健康和疾病发生的原因,最终目的是为了预防疾病,为了预测未来的健康走向,这就需要结合多组学的信息,采用MWAS的方法对疾病进行精准的诊断和治疗。
在这篇文章中,作者还提出了大量具体的原则和建议,并且提出了一个叫做微生物全球定位系统的设想,希望能够把全球不同地区、不同种族、不同饮食和生活习惯的人群进行详细区分,然后根据他们体内微生物,提供个性化的、精准的诊治方案。
Knight教授实验室致力于使用和发展最先进的计算和实验技术,来解答一些基本生物学问题,包括生物分子的组成,不同生态系统基因组和菌群,包括复杂的人体微生物生态系统的进化过程。他们实验室做了很多开放订阅和访问的科学模型,提供免费、开放源码的软件工具和公开所有可用的协议和数据,以提高大众了解微生物生态的兴趣,并进一步努力促使公众更积极地参与科学研究。目前,世界各地分析微生物测序数据最常用的免费开源软件QIIME就是来自Knight教授实验室。此外他还主持了一个“American Gut”项目,旨在让美国大众了解自己的肠道微生物组成。
参考文献
1.Charbonneau MR et al.2016. A microbial perspective of human developmental biology.Nature 535, 48–55.
2.Sonnenburg JL, Bäckhed F. 2016. Diet–microbiota interactions as moderators of human metabolism. Nature 535, 56–64.
3.Thaiss CA et al. 2016. The microbiome and innate immunity.Nature 535, 65–74.
4.Honda K, Littman DR. 2016. The microbiota in adaptive immune homeostasis and disease. Nature 535, 75–84.
5.Bäumler AJ, Sperandio V. 2016. Interactions between the microbiota and pathogenic bacteria in the gut.Nature 535, 85–93.
6.Gilbert JA et al. 2016. Microbiome-wide association studies link dynamic microbial consortia to disease. Nature 535, 94–103.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












文章很好值得关注
86
#计算机#
73
深度好文,值得学习,赞!
101
好文,值得学习,赞一个。
103
#治疗方案#
58
#肠道菌#
52