分析4400例胶质瘤:分子检测更改超1/4患者病理诊断,精准治疗显著提高预后生存
2024-10-14 苏州绘真医学 苏州绘真医学 发表于上海
本文研究胶质瘤患者生存受分子特征等影响,更新组织病理学诊断,确定预后特征,生成列线图,强调分子标准重要性及研究局限性。
随着胶质瘤的分类、风险分层和护理标准的重大转变,研究者试图了解这些肿瘤患者的总体生存如何受到分子特征、临床指标和接受治疗的影响。研究者从癌症基因组图谱(TCGA)、基因组学证据肿瘤信息交换项目(Project Genomics Evidence Neoplasia Information Exchange)和达纳-法伯癌症研究所/布列根和妇女医院(Dana-Farber Cancer Institute/Brigham and Women’s Hospital)收集了一个组织病理学诊断为胶质瘤的患者队列。该研究纳入了回顾性临床、组织学和分子数据,以及对患者生存期的前瞻性评估。
4400个胶质瘤被确定:2195个胶质母细胞瘤、1198个IDH1/2突变型星形细胞瘤、531个少突胶质瘤、271个其他IDH1/2野生型胶质瘤和205个儿童型胶质瘤。分子分型更新了27.2%的胶质瘤的原始组织病理学诊断。检测不同胶质瘤亚型的分子变异分布揭示了肿瘤发生途径中相互排斥的变异。与TCGA患者相比,非TCGA患者的总生存率显著提高,胶质母细胞瘤、IDH1/2突变型星形细胞瘤和少突胶质细胞瘤的生存率分别延长26.7%、55.6%和127.8%(均p<0.01)。本研究确定了几个预后特征,包括胶质母细胞瘤的NF1变异和21q缺失,以及IDH1/2突变型星形细胞瘤的EGFR扩增和22q缺失。利用队列的规模,研究者根据患者的年龄、肿瘤的分子特征和接受的治疗生成了列线图,以评估总生存的概率。
通过应用现代分子标准,研究者表征了胶质瘤亚型的基因组多样性,确定了临床适用的预后特征,并提供了关于患者生存期的当代更新,以作为正在进行的研究的参考。
-
在最终的组织病理学分类中,分子标准改变了>25%的胶质瘤;
-
与TCGA相比,当代胶质瘤队列显示生存率增加;
-
分子特征确定了侵袭性胶质瘤亚型,如EGFR扩增的星形细胞瘤。
研究背景
胶质瘤是成人最常见的恶性脑肿瘤,随着分子标志物的常规加入,胶质瘤的分类发生了重大转变,从而改善了肿瘤行为的预测、治疗反应和患者结局。这些分子特征最初是通过大规模研究(包括癌症基因组图谱[TCGA])阐明的,该研究是在治疗标准改变和现行分类方案引入之前开展的。随后的大规模研究探索了特定胶质瘤亚型的分子基础,或者开发了侧重于特定分子或临床特征的数据集。本研究的目标是管理和利用分子注释胶质瘤的大型、临床异质性、多机构数据集,以评估患者生存趋势,并确定可细化患者风险分层的预后分子变异。本综合分析强调了当代患者队列和历史患者队列之间的显著临床和分子差异,不同胶质瘤亚型和患者寿命之间的不同突变谱,以及影响总生存期的亚型依赖特征。
研究方法
年龄分为4组:≤19岁(儿童);20-39岁(青年);40-64岁(成人)和≥65岁(老年人)。根据WHO 2021指南和cIMPACT-NOW Updates 1-6中概述的分子标准,胶质瘤被分为5个亚组:胶质母细胞瘤、星形细胞瘤、少突胶质细胞瘤、儿童型胶质瘤和其他胶质瘤。胶质母细胞瘤是IDH1/2野生型胶质瘤,伴有胶质母细胞瘤相关的分子变异,包括TERT启动子突变、EGFR拷贝数扩增和/或合并整个7号染色体增加/10号染色体缺失(7+/10-)。星形细胞瘤是IDH1/2突变型胶质瘤,不存在染色体臂1p和19q联合缺失。少突胶质细胞瘤为染色体1p19q联合缺失的IDH1/2突变型胶质瘤。如果IDH1/2突变型胶质瘤未获得1p19q状态,存在ATRX或TP53突变表明该胶质瘤可能是星形细胞瘤。98.8%的IDH1/2突变为IDH1 R132或IDH2 R172,其余均为非典型突变。低级别儿童型胶质瘤为IDH1/2野生型胶质瘤,伴MAPK变异,无胶质母细胞瘤特异性变异。高级别儿童型胶质瘤为IDH1/2野生型伴H3K27或H3G34突变。最后,其他IDH1/2野生型胶质瘤包括剩余的IDH1/2野生型、弥漫性星形细胞胶质瘤以及那些标记为“未在其他地方分类(NEC)”的胶质瘤。
经过分子重新分类后,胶质瘤分级由WHO 2021和cIMPACT-NOW Updates 1-6确定。根据标准,所有胶质母细胞瘤均被指定为4级。如果存在CDKN2A/B纯合缺失,IDH1/2突变型少突胶质细胞瘤则被归类为3级,IDH1/2突变型星形细胞瘤被归类为4级。由于没有列出区分2级和3级IDH1/2突变型星形细胞瘤的分子标准,这些级别是根据临床注释的级别进行分配。1级胶质瘤(如果有的话)也使用儿童型和其他IDH1/2野生型胶质瘤的原始注释级别来指定。
研究结果
分子特征改善组织病理学诊断:
研究者从三个数据集确定了4400例有分子注释胶质瘤的患者(中位年龄52岁,范围0-94岁):DFCI/BWH(n=1565)、GENIE(n=2063)和TCGA(n=772;图1A;表1)。其中包括2195个胶质母细胞瘤、1198个IDH1/2突变型星形细胞瘤、531个IDH1/2突变型少突胶质细胞瘤、271个其他IDH1/2野生型胶质瘤和205个儿童型胶质瘤(89个低级别,116个高级别),均根据《世界卫生组织(WHO)中枢神经系统肿瘤分类2021》指南和cIMPACT-NOW Updates 1-6进行分类。
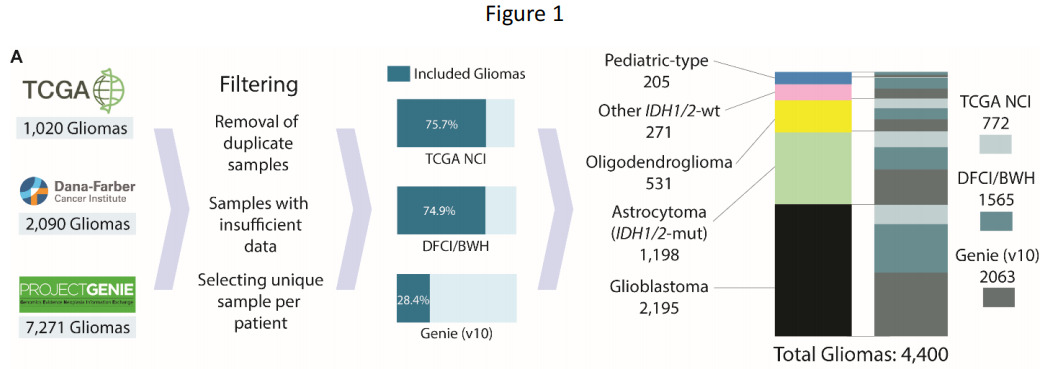
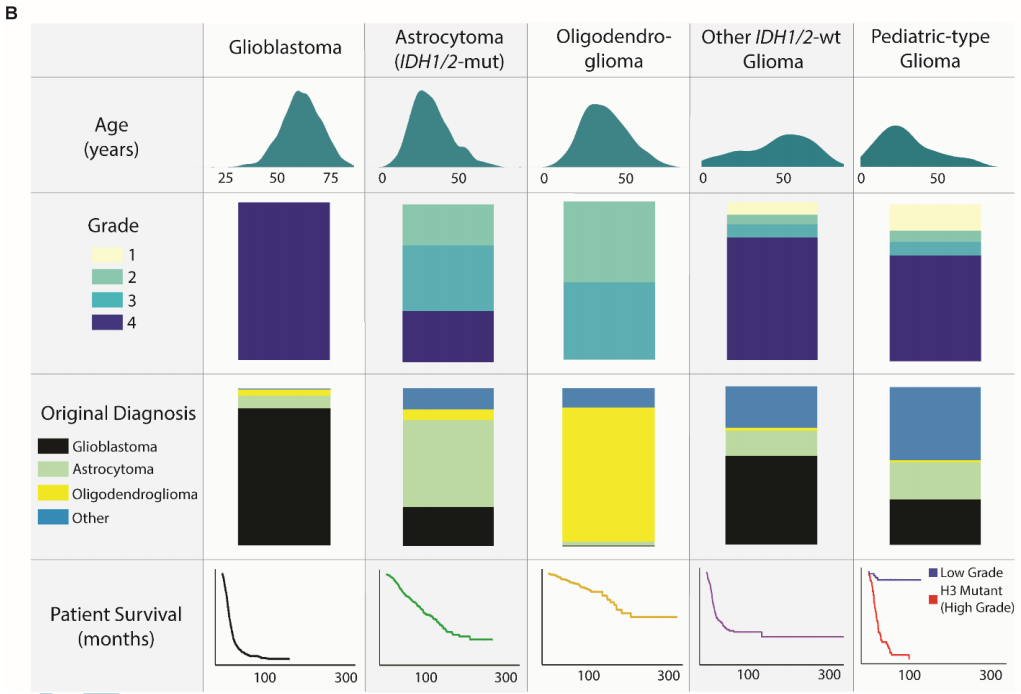
图1
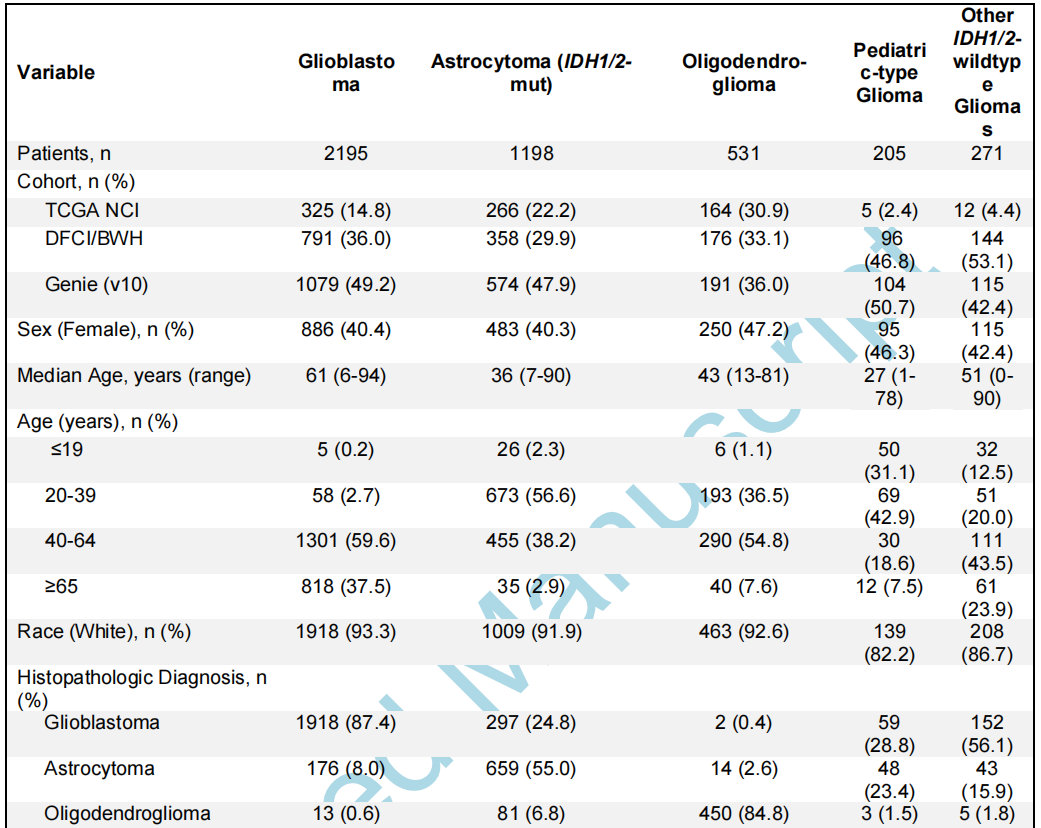
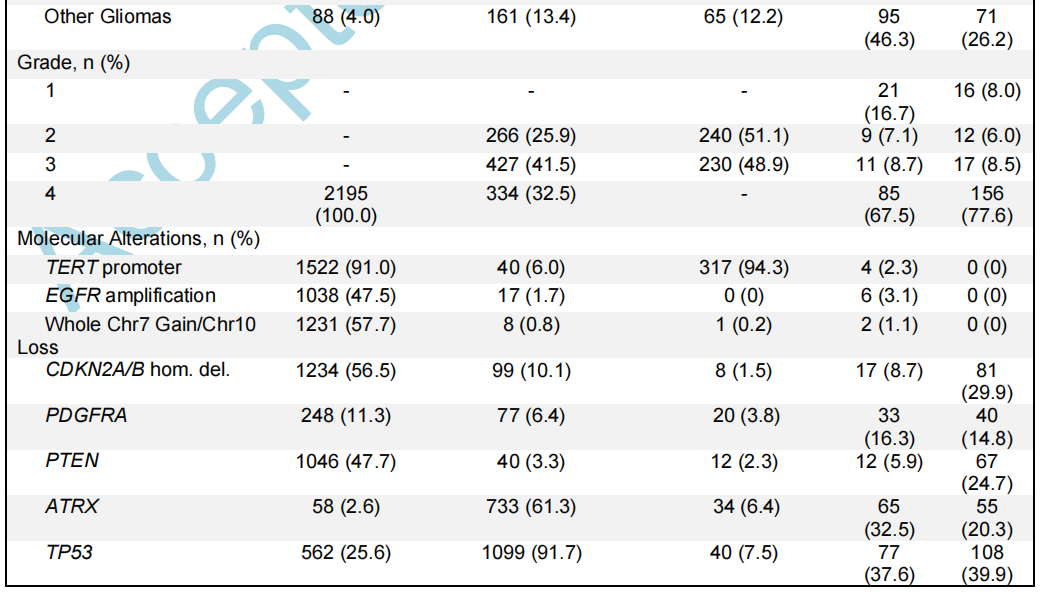

表1
分子分型从最初的组织病理学诊断中显著地细化了胶质瘤亚型。在分子分型的胶质母细胞瘤中,87.4%与其原始名称一致(图1B、表1)。分子定义的IDH1/2突变型星形细胞瘤(2-4级)在其原始组织病理学分类中表现出最大的异质性——55.0%之前被归类为星形细胞瘤,24.8%被归类为胶质母细胞瘤,13.4%被归类为其他胶质瘤,6.8%被归类为少突胶质细胞瘤。相比之下,IDH1/2突变型1p/19q编码少突胶质细胞瘤与其组织病理学名称的一致性较高(84.8%最初被归类为少突胶质细胞瘤)。儿童型胶质瘤以胶质母细胞瘤(28.8%)和星形细胞瘤(23.4%)为主,而其他IDH1/2野生型胶质瘤在组织学上大多被表征为胶质母细胞瘤(56.1%)。
胶质瘤亚型的分子变异各有不同:
在主要的胶质瘤亚型中,趋向于出现典型的分子变异(图2A、表1)。例如,虽然大多数胶质母细胞瘤有整个7号染色体增加/10号染色体缺失(7+/10-)(57.7%),但在另外31.1%的胶质母细胞瘤中发现了部分7+/10-变异。当在非胶质母细胞瘤亚型中观察整个7+/10-时,它仅存在于3级和4级肿瘤中(3级:4个肿瘤,4级:7个肿瘤)。在IDH1/2突变型星形细胞瘤中,EGFR扩增罕见(1.7%),但仅限于高级别肿瘤(3级:5个肿瘤,4级:12个肿瘤)。尽管IDH1/2突变型少突胶质细胞瘤中TERT启动子(94.3%)和CIC(69.1%)变异较多,但TP53(7.5%)和ATRX(6.4%)变异的发生率仍然较低。低级别儿童型胶质瘤以BRAF突变和重排(分别为39.3%和25.8%)和FGFR1变异(30.3%)为主,而TP53变异(39.9%)和CDKN2A/B纯合缺失(29.9%)在其他IDH1/2野生型胶质瘤中普遍存在。
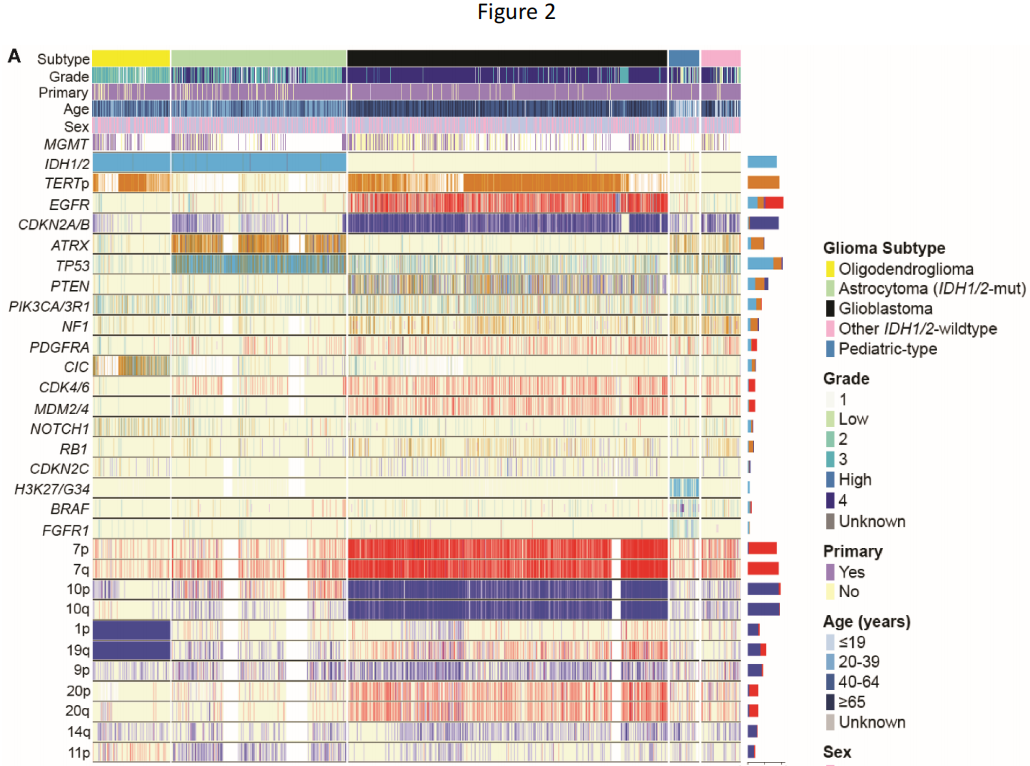
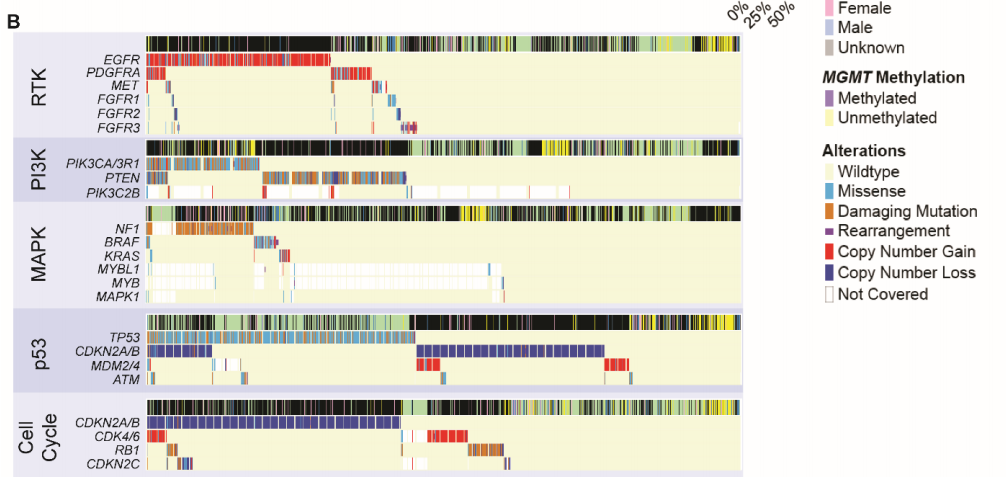
图2
接下来,研究者评估了与肿瘤发生相关的5条经常变异的通路:受体酪氨酸激酶(RTK)、磷酸肌醇-3-激酶(PI3K)、丝裂原活化蛋白激酶(MAPK)、p53和细胞周期。胶质瘤经常表现出这些通路的共变异,胶质母细胞瘤平均有2.8条通路受到影响(中位数:3),IDH1/2突变型星形细胞瘤有1.7条通路受到影响(中位数:1),少突神经胶质瘤有1.5条通路受到影响(中位数:1)。然而,胶质瘤很少在每条通路内发生多种变异,而这种现象在癌症基因组中很常见(图2B)。在RTKs中,EGFR变异与PDGFRA(8.4%)、MET(4.6%)和FGFR1-3(2.7%、2.4%、2.4%,所有P < .01)同时发生的情况有限。在分析的所有RTKs中,EGFR的重排发生率最高。在PI3K通路中,PIK3CA/3R1和PTEN突变同时发生的情况最少(8.3%,P < .01),尤其是在胶质母细胞瘤中。在MAPK通路中,NF1、BRAF和KRAS突变几乎完全互相排斥:变异病例中,3.6%发生NF1和BRAF共突变,2.2%发生NF1和KRAS共突变,而1.3%的变异病例发生BRAF和KRAS共突变(所有P < .01)。在p53通路中,虽然TP53和CDKN2A/B变异在部分胶质母细胞瘤和IDH1/2突变型星形细胞瘤中重叠,但TP53突变在IDH1/2突变型星形细胞瘤中占主导地位,而CDKN2A/B变异在胶质母细胞瘤中占主导地位。此外,在没有TP53或CDKN2A/B变异的胶质母细胞瘤亚群中也观察到MDM2或MDM4(已知的 p53调节因子)的局部扩增。最后,在其他细胞周期介质中,CDKN2A/B、CDK4/6、RB1和CDKN2C变异之间几乎没有重叠。有趣的是,不同通路之间变异的关联存在异质性,即在考虑细胞周期和p53通路时。在胶质母细胞瘤中,82.8%的病例这两种通路之间同时发生变异,CDKN2A/B变异影响细胞周期和p53通路;2.4%的胶质母细胞瘤仅在细胞周期通路中发生变异,4.8%仅在p53通路中发生变异。这与IDH1/2突变型星形细胞瘤(28.8%的病例显示共突变,0.5%仅为细胞周期通路,55.1% 仅为p53通路)和IDH1/2突变型少突胶质细胞瘤(7.9%共突变,4.3%仅为细胞周期通路,7.5%仅为p53通路)不同。
基因组的相关性和差距区分胶质瘤亚型:
当研究者对胶质瘤亚型进行分层时,观察到临床变量和分子变异之间的明显关系(图3A-C)。在胶质母细胞瘤中,CDKN2A/B和PDGFRA变异在≥65岁的患者中显著富集,而在40至64岁之间的患者中这些变异则减少(图3A)。RB1变异显示出反比关系,在40至64岁之间的患者中富集。年龄也显示出与IDH1/2突变型星形细胞瘤和少突胶质细胞瘤的分子变异有关,其中<40岁的患者与40至64岁和≥65岁之间的患者相比表现出明显相关的分变异(图3B-C)。此外,IDH1/2突变型星形细胞瘤和少突胶质细胞瘤的不同等级之间存在明显的基因组区别。4级IDH1/2突变型星形细胞瘤和3级少突胶质细胞瘤与一系列分子变异呈正相关,而2/3级IDH1/2突变型星形细胞瘤和2级少突胶质细胞瘤与几乎所有相同的分子变异呈负相关。分子变异之间的关系也显现出来:值得注意的是,EGFR变异与IDH1/2突变型星形细胞瘤中的CDKN2A/B和PDGFRA变异均呈正相关,反映了这些肿瘤中典型的胶质母细胞瘤分子变异同时发生。
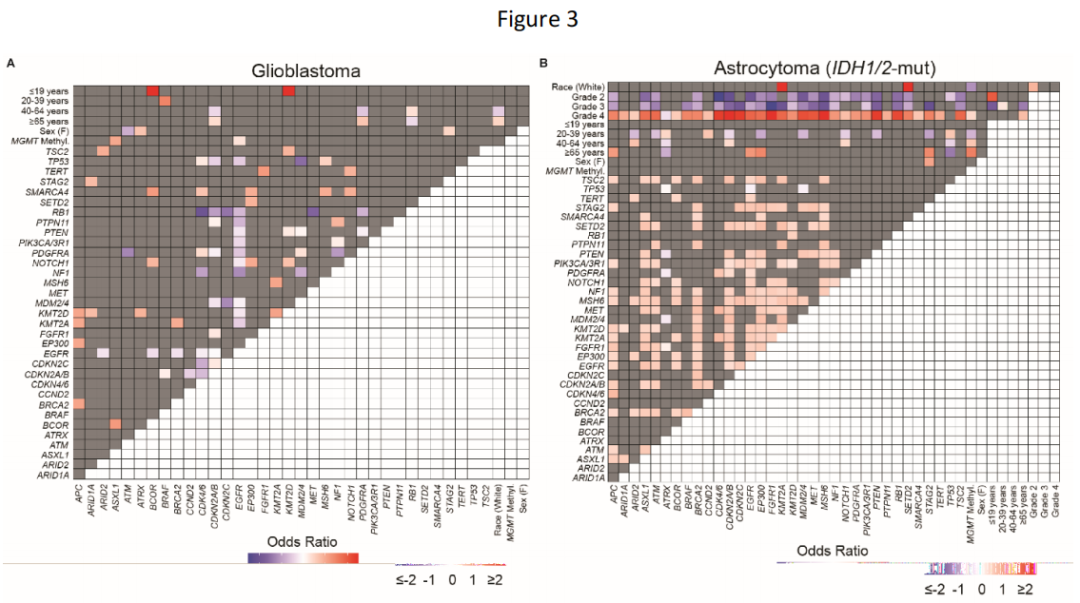
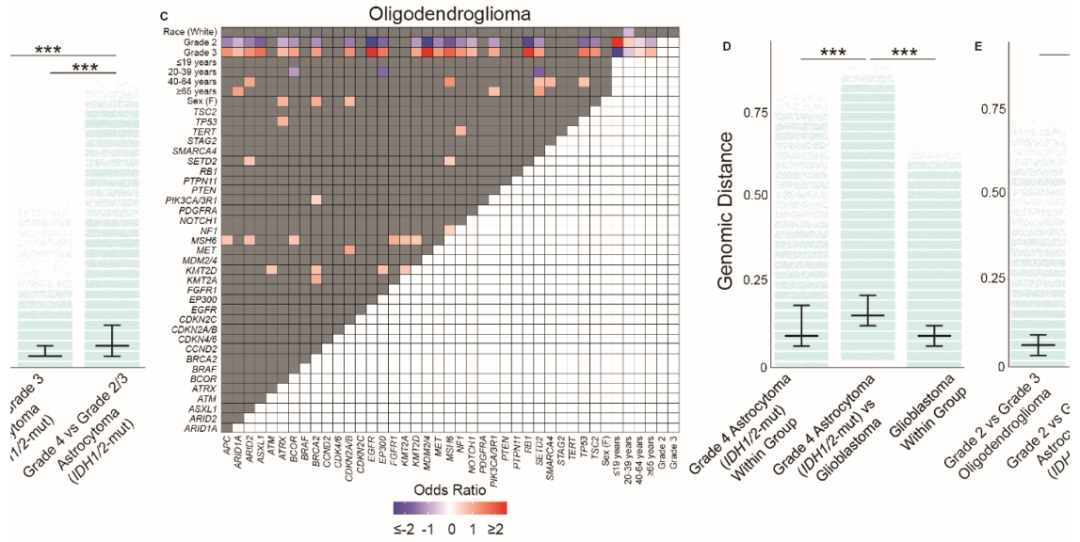
图3
研究者使用基因组差距量化了神经胶质瘤基因组的异质性。正如预期的那样,研究者观察到不同亚型的神经胶质瘤之间的基因组变异性比同一亚型内的更大。具体而言,胶质母细胞瘤与IDH1/2突变型星形细胞瘤之间的基因组差异(中位数JD:0.147)明显高于胶质母细胞瘤(中位数JD:0.088,P < .001)或IDH1/2突变型星形细胞瘤(中位数JD:0.059,P < .001)内的基因组异质性。同样,胶质母细胞瘤与少突胶质细胞瘤(中位数JD:0.118)之间以及IDH1/2突变型星形细胞瘤与少突胶质细胞瘤(中位数JD:0.088)之间的基因组差距大于各自胶质瘤亚型内的基因组异质性(所有P < .001)。
当研究者按等级细分神经胶质瘤时,发现了不同的基因组差距模式。4级IDH1/2突变型星形细胞瘤和胶质母细胞瘤之间的基因组差距(中位数JD:0.147)比4级IDH1/2突变型星形细胞瘤内部(中位数JD:0.088)或胶质母细胞瘤内部(中位数JD:0.088,P < .001,图3D)之间的基因组差异更大。此外,4级IDH1/2突变型星形细胞瘤与2/3级IDH1/2突变型星形细胞瘤之间的基因组差距比2级和3级IDH1/2突变型星形细胞瘤之间的基因组差距更大(P < .001,图3D)。4级与2-3级IDH1/2突变型星形细胞瘤之间的基因组差距超过了3级与2级少突胶质细胞瘤之间的基因组差距(P < .001,图3D)。这表明4级IDH1/2突变型星形细胞瘤具有独特的基因组组成,可将其与胶质母细胞瘤和其他2级和3级IDH1/2突变型胶质瘤区分开来。
胶质瘤队列和亚型影响生存率:
研究者观察到非TCGA队列患者的中位生存期与TCGA队列患者相比显著增加,尽管人口统计学资料相似。在所有≥20岁的原发性胶质瘤患者中,胶质母细胞瘤(18.0个月,范围:0.1-164.0个月)、IDH1/2突变型星形细胞瘤(118.5个月,范围:0.1-262.2个月)和少突胶质细胞瘤(213.9个月,范围:0.1-324.4个月)的中位生存期各不相同。对于胶质母细胞瘤,非TCGA患者的中位总生存期为19.0个月(范围:0.2-164.0个月),比TCGA患者的中位总生存期(15.0个月,范围:0.1-95.3个月,P < .001,图4A)长26.7%。非TCGA和TCGA队列之间的中位生存期差异在IDH1/2突变型星形细胞瘤中更为明显,非 TCGA患者的中位生存期为136.8个月(范围:1.0-262.2 个月),而TCGA患者的中位生存期为87.9个月(范围:0.1-157.1个月,P = .0002)(图4C)。2/3级IDH1/2突变型星形细胞瘤的中位生存期是4级IDH1/2突变型星形细胞瘤的两倍多,而2级和3级IDH1/2突变型星形细胞瘤没有显著差异。同样,在少突胶质细胞瘤的情况下,非TCGA患者的中位生存期为307.5个月(范围:0.3-324.4个月),是TCGA患者中位生存期135.0个月的两倍多(范围:0.1-183.3个月,P < .0001,图4E),而2级少突胶质细胞瘤患者在最近的随访中未达到中位生存期。
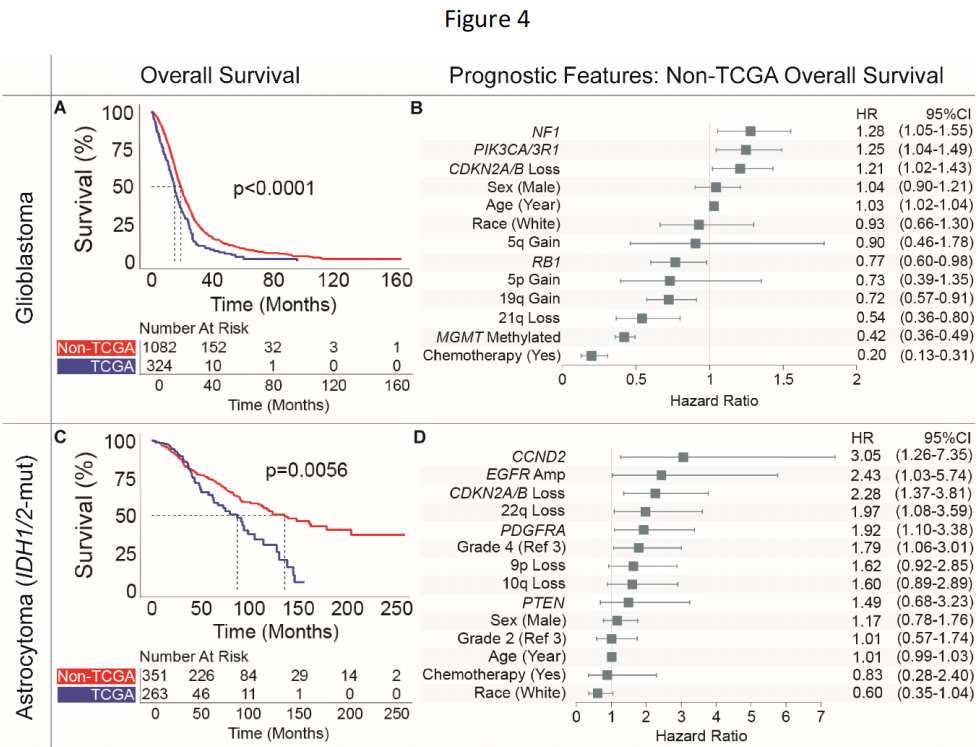
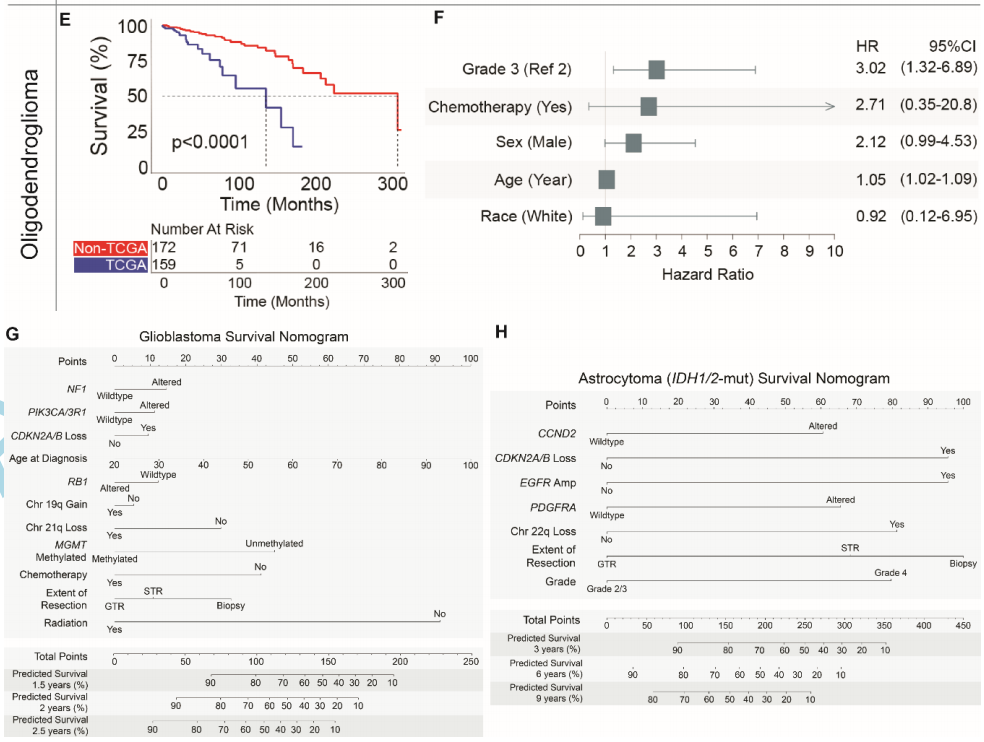
图4
各胶质瘤亚型的预后特征不同:
在非TCGA队列的多变量建模中,临床、分子和治疗特征均影响不同胶质瘤亚型的预后(图4)。几乎所有非TCGA患者均接受了化疗(94.8%),其中91.1%的化疗患者将替莫唑胺作为治疗计划的一部分。
在非TCGA胶质母细胞瘤患者中,接受化疗(HR:0.20)、甲基化MGMT(HR:0.42)、21q缺失(HR:0.54)、19q增加(HR:0.72)和RB1变异(HR:0.77)对生存有积极影响。NF1变异(HR:1.28)、PIK3CA/3R1变异(HR:1.25)、CDKN2A/B缺失(纯合或杂合,HR:1.21)和年龄增长(HR:1.03)对胶质母细胞瘤生存有负面影响(图4B)。CKDN2A/B的纯合和杂合缺失被一起评估,因为两者对总体生存率都有类似的负面影响。21q染色体缺失成为一种新的阳性预后特征,总体生存率在2年左右出现差异。为了在其他治疗数据背景下验证这些特征,在DFCI队列中进行了多变量测试,其中有手术切除范围(EOR)和放射(RT)数据。即使在调整该机构队列中的EOR和RT后,几乎所有分子特征仍然显著,包括NF1、PIK3CA/3R1、RB1和21q缺失。全切除术对生存率有积极影响(与次全切除术相比,HR:0.78),而仅活检(与次全切除术相比,HR:1.66)对生存率有负面影响。
在非TCGA IDH1/2突变型星形细胞瘤中,CCND2变异(HR:3.05)、EGFR扩增(HR:2.43)、CDKN2A/B缺失(纯合或杂合缺失,HR:2.28)、22q缺失(HR:1.97)和PDGFRA变异(HR:1.92)具有负面预后意义(图4D)。10q缺失(HR:1.60,P = .08)和9p缺失(HR:1.62,P = .09)作为负面预后特征具有重要意义。在DFCI队列中,在EOR和RT调整后,几乎所有这些特征仍然具有显著性。全切除术(与次全切除术相比)是积极的预后特征(HR:0.43),而活检(与次全切除术相比)更具可变性。与之前的结果一致,肿瘤2级与3级和MGMT甲基化不是显著的独立预后特征。
具体来看EGFR扩增、CDKN2A/B缺失、10q缺失和22q缺失,具有这4个特征中至少一个的患者与没有这些变异的患者相比生存率显著降低。EGFR扩增患者的中位生存期为37.6个月(范围:2.3-97.1个月),不到无EGFR扩增患者的中位生存期的三分之一(120.6个月,范围:0.1-262.2个月,P < .0001)。同样,CDKN2A/B纯合缺失患者的中位生存期为30.0个月(范围:2.3-167.6个月),而肿瘤中存在CDKN2A/B杂合缺失的患者中位生存期为71.6个月(范围:5.8-164.8个月),不存在CDKN2A/B缺失的患者中位生存期为136.8个月(范围:0.1-262.2个月,P < .0001)。10q缺失患者的中位生存期为43.9个月(范围:0.1-208.8个月),不到10q保留患者的中位生存期的一半(124.5个月,范围:0.1-262.2个月,P < .0001)。此外,22q缺失患者的中位生存期为45.3个月(范围:0.1-128.3个月),而22q保留患者的中位生存期为124.7个月(范围:0.1-262.2个月,P < .001)。值得注意的是,这些负面预后分子特征同时出现的情况有限,仅有25.9%的患者同时具有一种以上的这些特征(EGFR扩增、CDKN2A/B缺失、10q缺失和22q缺失)。
非TCGA IDH1/2突变型1p/19q编码少突胶质细胞瘤的预后特征很少见,没有分子变异显著影响生存,包括MGMT甲基化状态。高肿瘤分级是最强的负面预后指标(HR:3.02),其次是年龄增加(HR:1.05,图4F)。在调整EOR和RT后,DFCI队列中的情况仍然一致。对胶质母细胞瘤、IDH1/2突变型星形细胞瘤和IDH1/2突变型少突胶质细胞瘤的多变量模型的内部验证表明,模型拟合相对一致,其中IDH1/2突变型少突胶质细胞瘤模型的异质性最大。
鉴于非TCGA和TCGA队列之间的总体生存率差异,研究者检查了整个数据集中确定的上述特征,以确定可能导致队列差异的因素,包括队列状态(非TCGA或TCGA)作为协变量。在胶质母细胞瘤中,分子和临床特征基本保持稳定,包括PIK3CA/3R1变异(HR:1.31,P < .01)、CKDN2A/B缺失(HR:1.22,P = .01)、年龄增长(HR:1.03,P < .001)、RB1变异(HR:0.79,P < .05)、19q增加(HR:0.70,P < .001)、21q缺失(HR:0.55,P < .002)、甲基化MGMT(HR:0.46,P < .001)和接受化疗(HR:0.37,P < .001)。即使在控制这些特征后,队列状态与患者生存率仍显著相关,非TCGA队列状态对生存率具有积极预后作用(HR:0.56,P < .001)。即使在控制了上述每种胶质瘤亚型的特征后, IDH1/2突变型星形细胞瘤(非TCGA队列状态HR:0.55,P < .01)和IDH1/2突变型少突胶质细胞瘤(非TCGA队列状态HR:0.17,P < .001)也观察到了类似的效果。胶质母细胞瘤和IDH1/2突变型星形细胞瘤的临床和分子特征被整合到列线图中,使用包括EOR在内的数据来量化患者生存的预测概率(图4G-H)。
分子变异的分布随年龄而变化:
鉴于年龄对胶质母细胞瘤和少突胶质细胞瘤的预后意义,研究者研究了不同年龄层胶质瘤亚型的总体生存率。年龄≥65岁的胶质母细胞瘤、IDH1/2突变型星形细胞瘤或少突胶质细胞瘤患者的中位生存期低于年龄在40-64岁和20-39岁之间的患者(所有P≤.02,图5A-C)。
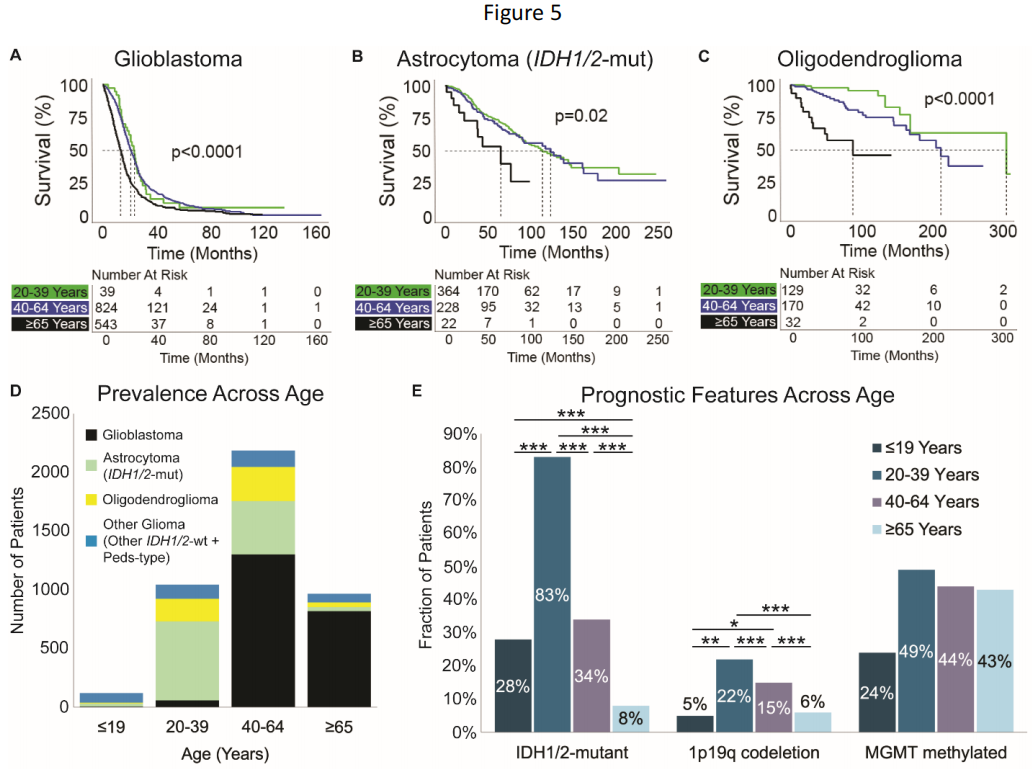
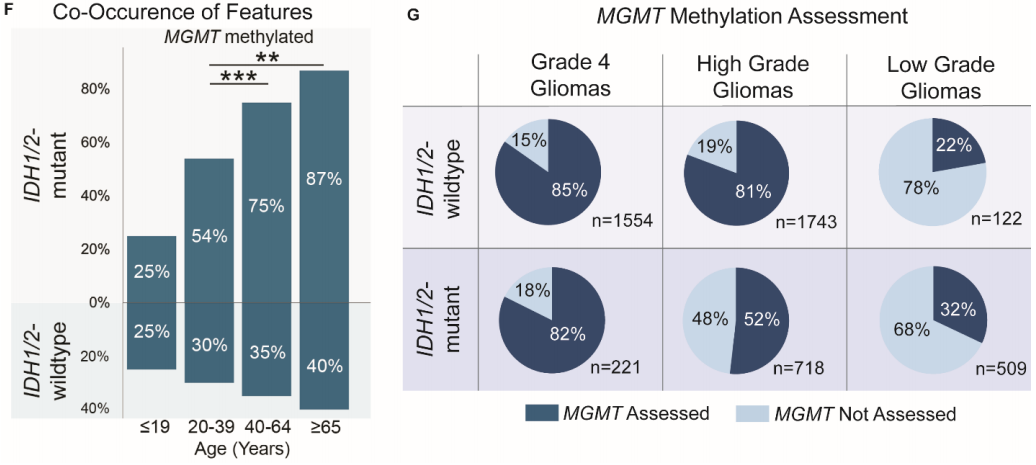
图5
随后,研究者调查了3种对不同年龄组的胶质瘤具有积极预后意义的分子特征:IDH1/2突变、MGMT甲基化和1p19q共缺失。正如预期的那样,在所有胶质瘤中,IDH1/2突变型胶质瘤的发生率随着患者年龄的增长而降低,在966名年龄≥65岁的患者中,只有75名患有IDH1/2突变型星形细胞瘤或少突胶质细胞瘤(图5D-E)。相比之下,MGMT启动子甲基化的发生率在所有成年患者中相似,在所有胶质瘤中介于43%和49%之间(X2 P = .091,图5E)。在所有IDH1/2突变型胶质瘤中,64.1%是MGMT甲基化。然而,在少数65岁以上患有IDH1/2突变的患者中,MGMT甲基化的共发生率(87%)明显高于20至39岁之间的患者 (54%,图5F,X2 P < .001)。值得注意的是,很大一部分神经胶质瘤未评估MGMT甲基化状态,尤其是在IDH1/2突变肿瘤中(图5G)。这在低级别神经胶质瘤中尤为明显,其中只有32%的低级别IDH1/2突变神经胶质瘤评估了MGMT甲基化状态,而高级别IDH1/2突变神经胶质瘤为52%,4级IDH1/2突变神经胶质瘤为82%。
讨 论
神经胶质瘤分类的分子标准与组织病理学特征的整合,将基因型的变化与肿瘤表型和临床行为联系起来,推动了神经肿瘤治疗的发展。本研究提供了胶质瘤亚型生存率评估的最新综述,剖析了胶质瘤发生的途径,并提出了整合临床和分子特征进行预后的临床适用工具。研究者在非TCGA队列中的发现进一步强调了在开发和验证分子生物标志物时使用临床代表性数据集的重要性。
与TCGA队列相比,按更现代的队列分层显示,与之前的评估相比,各种胶质瘤亚型的生存率都有显著提高。例如,非TCGA队列中的胶质母细胞瘤患者的中位生存期为19.0个月,超过了之前临床试验和TCGA队列中观察到的15.0个月的中位生存期。相比之下,IDH1/2突变型星形细胞瘤和少突胶质细胞瘤在当代的中位生存期有更显著的增加:非TCGA IDH1/2突变型星形细胞瘤患者的中位生存期为11.4 年,而少突胶质细胞瘤的中位生存期为25.6年。这些生存结果是TCGA队列以及其他全人口估计值的两倍多。值得注意的是,即使在控制了分子和临床特征后,队列状态仍然对患者的生存具有显著的预后意义。各种胶质瘤亚型生存率提高的驱动因素可能是多方面的,包括分子诊断准确性的提高、对早期干预的手术优势的认识、更安全的最大限度肿瘤切除技术的进步、化放疗的更广泛使用以及研究药物的可用性。在胶质母细胞瘤、IDH1/2突变型星形细胞瘤和少突胶质细胞瘤中,患者群体的异质性可能导致了非TCGA与TCGA生存率估计值的差异。由于许多GENIE机构不报告生存数据,因此非TCGA队列的生存率分析仅包括来自DFCI和MSKCC(两家大型、城市、研究密集型三级医疗中心)的患者。尽管如此,非TCGA队列和TCGA队列患者之间的生存率存在显著差异,这表明在评估胶质瘤的治疗标准和新疗法时使用当代患者资料非常重要。
通过对一个高效力队列进行多变量分析,研究者确定了特定于胶质瘤亚型的分子预后特征,其中大多数特征即使在调整切除范围和放疗治疗后仍对预后有重要影响。该队列的规模使研究者能够阐明罕见但重要的分子特征,包括胶质母细胞瘤中的21q缺失以及IDH1/2突变型星形细胞瘤中的EGFR扩增和22q染色体缺失。IDH1/2突变型星形细胞瘤的分子异质性在特征评估中有所体现,MYC扩增和MET变异等几个特征在单变量分析中很重要,但在多重比较校正后并不重要,与cIMPACT-NOW报告的情况类似。研究者还证明CKDN2A/B杂合缺失对总体生存率的负面影响类似于CDKN2A/B纯合缺失,表明即使CDKN2A/B基因不完全缺失,它在胶质母细胞瘤中也具有预后价值。评估通过临床使用的检测方法确定的CDKN2A/B杂合缺失的影响对于确保它成为不良预后的有力生物标志物至关重要。与胶质母细胞瘤和IDH1/2突变型星形细胞瘤相比,少突胶质细胞瘤没有显示出与预后相关的特定分子变异。这一观察结果表明,高级别少突胶质细胞瘤可能以与肿瘤级别相关的更多样化的基因组变异为特征,而不是少数主要频繁的驱动突变决定高级别行为。将分子特征与生存相关的传统标志物(例如患者年龄增加)放在一起,可以精确预测生存情况,并识别出可能受益于早期靶向治疗的患者。
患者年龄增加与不良预后特征相关,如先前在较小群体中所证实的。老年患者更有可能患有高级别肿瘤(少突胶质细胞瘤和星形细胞瘤)和不利的PDGFRA变异(胶质母细胞瘤)。两个更有利的特征,IDH1/2突变和1p19q共缺失,随着患者年龄的增长而减少。有趣的是,MGMT甲基化的发生率在各个年龄组中相当。此外,在有限数量的具有IDH1/2突变的老年患者中,这些个体同时发生MGMT甲基化的可能性显著更高。这可能表明,有一部分年龄≥65岁的患者可能患有生物学上更有利的胶质瘤亚型。然而,只有32%的低级别IDH1/2突变型胶质瘤患者和52%的高级别IDH1/2突变型胶质瘤患者接受了MGMT甲基化状态评估。此外,在IDH1/2野生型肿瘤中,近五分之一的高级别胶质瘤和超过四分之三的低级别胶质瘤未接受MGMT状态评估,这些患者的MGMT甲基化状态对于治疗选择至关重要。这凸显了需要进行更广泛的MGMT分子分析,以确定可能从现有疗法中受益的患者。
相关性分析和基因组差距测量进一步强调了不同胶质瘤亚型的分子变异、组织病理学等级和患者生存率之间的紧密关联。与低级别少突胶质瘤(2级)和星形细胞瘤(2/3级)相比,高级别少突胶质瘤(3级)和IDH1/2突变型星形细胞瘤(4级)表现出更高的突变负荷和独特的生存特征。相比之下,2级和3级IDH1/2突变型星形细胞瘤之间的相对分子同质性和相似的生存率强调了缺乏能够可靠区分这些等级的明确特征。虽然它们的突变特征有一些相似之处,但每种胶质瘤亚型都表现出独特的分子特征。胶质母细胞瘤具有几种众所周知的变异,这些变异主要分为不同的肿瘤发生途径。例如,在胶质母细胞瘤中,CDKN2A/B变异与p53和细胞周期通路 (如TP53、MDM2/4、CDK4/6和RB1 ) 中的许多变异互相排斥,这两条通路都包括CDKN2A/B。相比之下,IDH1/2突变型星形细胞瘤在各种通路中具有更广泛的共存有害变异,包括CDKN2A/B和EGFR之间。尽管存在这些关联,但4级IDH1/2突变型星形细胞瘤与胶质母细胞瘤在基因组上存在显著差距,从而强化了它们与胶质母细胞瘤的不同分类。每种胶质瘤亚型的独特突变谱支持了这样一种观点,即分子驱动的胶质瘤分类系统可以提高精确度并改善分子特征与临床行为之间的相关性。
虽然本研究描述了胶质母细胞瘤、IDH1/2突变型星形细胞瘤和少突胶质细胞瘤的预后指标,但由于样本量较小,研究者无法全面分析儿童型和其他IDH1/2野生型胶质瘤的分子特征。为了更好地了解这些不太常见的胶质瘤亚型的基因组驱动因素和生存差异,有必要进行一项强有力的队列研究。这些肿瘤表现出与IDH1/2野生型胶质母细胞瘤相似的侵袭性临床病程,在本队列中,中位总生存期为20.4个月,与IDH1/2野生型胶质母细胞瘤相似。正交技术,例如DNA甲基化分析可以进一步区分其他IDH1/2野生型神经胶质瘤的特征,一项研究表明其他IDH1/2野生型神经胶质瘤与IDH1/2野生型神经胶质母细胞瘤的甲基化特征存在重叠。
本分析存在一些局限性,其中许多局限性是使用大型回顾性数据集所固有的。尽管研究者努力手动更新所有可用的机构数据以延长随访时间并验证分子和治疗信息,但大型存储库中的数据输入和存储错误可能影响了本队列中使用的临床和分子信息。此外,由于分子数据是在20年间收集的,某些基因的覆盖范围存在异质性,突变的检测方式也存在差异。这包括使用的检测和平台,其中一些可能会影响数据的报告,例如杂合和纯合拷贝数变异。用于MGMT甲基化分析的方法的差异(无论是在队列之间还是在队列内)都可能导致报告的启动子甲基化频率的不准确性。批次效应和胚系过滤流程也可能导致报告的分子变异频率发生变化。这些因素限制了可用于生存预测的具有完整分子数据的样本数量。虽然本研究的目标是尽可能多地捕获临床和分子变量,但可能还存在其他因素,导致TCGA和非TCGA队列之间的生存差异。最后,除了分子分析的局限性之外,患者生存数据的可用性也限制了可以纳入多变量建模的患者数量。努力在公共数据集中进行可靠的数据注释仍然是本研究的目标,这将增强利用大型异构数据源来定义稳定且具有临床意义的分子标志物的能力。
尽管存在这些考虑,但研究者相信这些分析为未来临床试验的发展提供了最新的生存基准。这里提供的统一资源有助于解读成人胶质瘤中分子变异的意义,为患者和医疗保健提供者提供指导。
参考文献:
Ghosh HS, Patel RV, Woodward E, et al. Contemporary Prognostic Signatures and Refined Risk Stratification of Gliomas: An Analysis of 4,400 Tumors. Neuro Oncol. Published online August 21, 2024. doi:10.1093/neuonc/noae164

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胶质瘤# #分子特征#
67